PCNA、EGFR在糖尿病雄性SD大鼠睾丸组织的表达及相关因素分析
2010-10-20付建茹郑少雄
孔 艳,付建茹,郑少雄
(天津医科大学第二医院内分泌代谢科,天津 300211)
糖尿病(DM)是一种几乎影响全身各系统的慢性疾病,也被公认为男性性功能障碍的原因之一,可导致生育低下,影响男性患者的生殖功能[1],可多层次地影响精子生成的内分泌环境、精子生成的过程及损害勃起和射精[2],动物模型数据表明,糖尿病雄性动物的繁殖力是显著下降的[3-4],精子的质量也发生了损害[4-5]。DM与不育有关的诸多因素中包括一个重要的因素——内分泌因素[6]。增殖细胞核抗原(PCNA)作为一种核内多肽,对细胞由G1期向S期过渡起着重要的调节作用[7],参与脱氧核糖核酸合成、复制、切割、修复,已被用来定量分析睾丸组织生殖细胞DNA合成,有效反映细胞增殖活性[8]。表皮生长因子受体(EGFR)是一个由1 186个氨基酸组成的分子量为170kDa的跨膜糖蛋白,能与EGF等因子结合,传递到细胞内,细胞核内,加速核酸和蛋白质的合成,促进多种细胞分裂增殖、分化,对睾丸发育和精子发生有重要作用[7]。本实验主要通过建立糖尿病模型探讨PCNA及EGFR作为两种影响生殖功能的因子,对正常及不同病程糖尿病SD大鼠睾丸功能的影响,并观察睾丸形态,为DM雄性生殖功能障碍的发病机制和治疗提供一定的理论依据。
1 材料和方法
1.1 实验动物及分组 雄性SD大鼠30只,自由饮水进食,随机分为正常组(A组)10只,予生理盐水灌胃,实验组20只,每日给予高脂高糖乳剂灌胃。两组每日均自由进食饲料,6周后实验组空腹12 h后予小剂量链脲佐菌素 (STZ,Sigma公司)按30mg/kg体重尾静脉注射诱导2型糖尿病模型。而正常对照组大鼠均予等量无菌枸橼酸-枸橼酸钠缓冲液尾静脉注射。以FPG≥16.7mmol/L为诊断糖尿病大鼠的标准,实验组大鼠于第8周造模成功。后继续维持高糖高脂饮食,并分为DM 4周组(B组)和DM 8周组(C组)大鼠各10只,分别于4周后、8周后处死。
1.2 试剂 鼠抗大鼠PCNA,兔抗大鼠EGFR,ABC试剂盒及DAB显色剂、胰岛素放免试剂盒、睾酮测定试剂盒、血脂4项试剂盒均购于天津灏洋生物技术有限公司。小剂量STZ购自美国Sigma公司。
1.3 指标测定 断尾取血,用罗氏血糖仪测定血糖值(每次测血糖前一天晚上禁食,次日晨9时测空腹血糖);腹主动脉取血离心收集血清置于-70℃冰箱中待测胰岛素、糖化血清蛋白等。放免法检测血清胰岛素;比色法检测血清糖化血清蛋白;化学发光法测定血清睾酮。
1.4 切片制备 颈脱臼处死后,取双侧睾丸,称重,10%甲醛固定24 h后,常规石蜡包埋,制成连续5μm的切片,裱于覆有APES的载玻片上。
1.5 免疫组织化学染色 切片经脱蜡,蒸馏水冲洗,PBS冲洗3min/次,共3次,打孔液浸泡10min,3%H2O2去离子水孵育5~10min,以消除内源性过氧化酶活性,PBS冲洗,热修复15min,复温至室温后消化液37℃进行消化10min,PBS冲洗3min/次,共3次,山羊血清封闭30min。弃去上层液,务须冲洗,按常规ABC染色方法进行以下步骤:PCNA一抗浓度为1∶50,标本置湿盒内4℃过夜;然后滴加生物素化二抗(1∶200)37 ℃孵育 30 min;最后滴加辣根过氧化物酶标记链酶卵白素(1∶200),37℃孵育30min,DAB显色后苏木精复染,常规脱水片。每个标本计数3张切片,每张切片检查10个高倍视野,随机选取组织结构保存较好的曲细精管,计算免疫反应阳性细胞的百分比。EGFR按常规ABC染色方法进行,EGFR一抗浓度为1∶50,标本置湿盒内4℃过夜;然后滴加生物素化二抗(1∶200)37℃孵育30min;最后滴加辣根过氧化物酶标记链酶卵白素(1∶200),37℃孵育30min,DAB显色后苏木精复染,常规脱水片。每个标本计数3张切片,每张切片检查10个高倍视野,随机选取组织结构保存较好的曲细精管,计算免疫反应阳性细胞的百分比。
1.6 数据处理 采用SPSS11.5统计软件,方差分析、SNK法比较3组间的差异、线性相关性分析。
2 结果
2.1 3组间的血脂值比较 见表1。
表1 3组大鼠的血脂水平比较,mmol/L)

表1 3组大鼠的血脂水平比较,mmol/L)
与正常组比较*P<0.05;与正常组,糖尿病组内比较**P<0.05;糖尿病组内比较#P<0.05
TG 1.198±0.232 1.484±0.286*1.777±0.379**9.021 0.001 n 10 10 10 HDL 0.821±0.178 1.002±0.259 1.333±0.319**10.077 0.001 TC 1.969±0.192 3.209±0.793*3.199±0.803*11.643<0.05组别A组B组C组FP LDL 0.411±0.089 0.536±0.234#0.349±0.067#4.032 0.029 VLDL 0.850±0.103 1.367±0.481*1.089±0.271 6.361 0.005
2.2 3组间糖化血清蛋白、血糖、胰岛素、胰岛素抵抗指数及体重比较 见表2。随着病程的增加,糖化血清蛋白升高,3组之间比较有统计学意义;糖尿病大鼠空腹血糖水平、胰岛素抵抗指数高于正常组,且有统计学意义,但4周组与8周组大鼠没有统计学意义;正常组与4周组大鼠空腹胰岛素水平差异没有统计学意义,而8周组大鼠的胰岛素水平较正常组及4周组大鼠升高,有统计学意义;糖尿病大鼠的体重低于正常组,有统计学意义,但4周组与8周组大鼠比较没有统计学意义。
表2 3组大鼠的糖化血清蛋白、血糖、胰岛素、胰岛素抵抗指数及体重比较
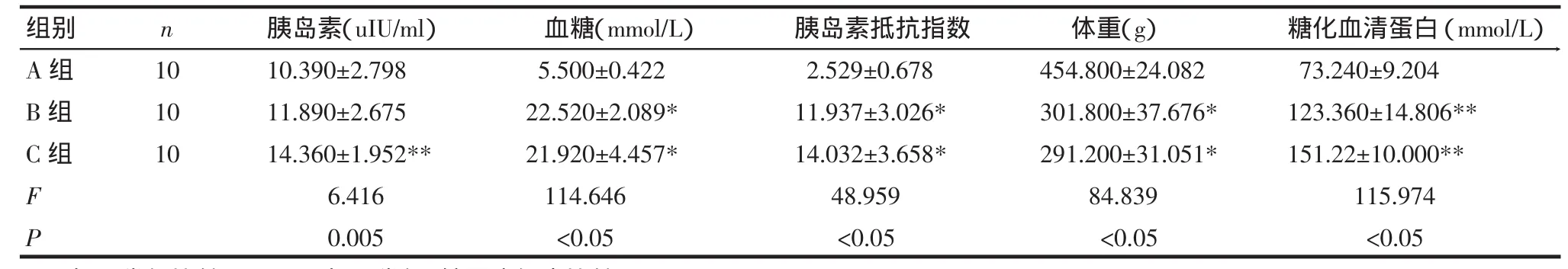
表2 3组大鼠的糖化血清蛋白、血糖、胰岛素、胰岛素抵抗指数及体重比较
与正常组比较*P<0.05;与正常组,糖尿病组内比较**P<0.05
n 10 10 10组别A组B组C组FP胰岛素(uIU/m l)10.390±2.798 11.890±2.675 14.360±1.952**6.416 0.005胰岛素抵抗指数2.529±0.678 11.937±3.026*14.032±3.658*48.959<0.05血糖(mmol/L)5.500±0.422 22.520±2.089*21.920±4.457*114.646<0.05体重(g)454.800±24.082 301.800±37.676*291.200±31.051*84.839<0.05糖化血清蛋白(mmol/L)73.240±9.204 123.360±14.806**151.22±10.000**115.974<0.05
2.3 3组间睾丸重量、PCNA、EGFR及睾酮比较 见表3。随着病程的增加,糖尿病组睾丸重量、睾丸组织PCNA、EGFR免疫阳性细胞百分率值、血清睾酮较正常组下降,且有统计学意义(P<0.05),而4周组与8周组大鼠之间没有统计学意义。但PCNA、EGFR与血糖的变化趋势是相反的,PCNA与血糖之间的相关系数是r=-0.665,EGFR与血糖之间的相关系数是r=-0.540,两者与血糖均呈负相关。PCNA、EGFR与睾丸重量呈正相关,相关系数分别为r=0.496(P=0.009),r=0.454(P=0.012)。PCNA 与血清睾酮水平呈正相关,相关系数为 r=0.538(P=0.002),EGFR与血清睾酮水平无相关性(P=0.086),PCNA及EGFR在睾丸组织中表达分别见图1、2。
表3 3组大鼠睾丸重量、睾酮、PCNA及EGFR免疫阳性细胞百分率比较

表3 3组大鼠睾丸重量、睾酮、PCNA及EGFR免疫阳性细胞百分率比较
与正常组比较*P<0.05
n 10 10 10组别A组B组C组FP睾丸重量(g)3.350±0.207 2.790±0.536*3.000±0.205*6.443 0.005 EGFR(%)0.283±0.037 0.245±0.028*0.225±0.026*9.408 0.001 PCNA(%)0.268±0.0 27 0.229±0.027*0.212±0.017*14.258<0.05睾酮(ng/ml)2.934±2.218 0.153±0.048*0.481±0.152*11.801<0.05

免疫阳性产物位于细胞核,阳性颗粒为浅黄色至棕黄色,通常呈颗粒状,小部分呈弥散状。免疫阳性细胞包括精原细胞和初级精母细胞,少数支持细胞也有着色。免疫组化示糖尿病组较正常组棕黄色较深;8周组较4周组大鼠睾丸组织PCNA表达率无统计学意义,颜色几乎相当。
正常和糖尿病大鼠睾丸精母细胞、精子细胞、支持细胞和间质细胞均呈阳性反应,且免疫阳性产物呈细颗粒状,弥散分布于细胞浆或包膜下,部分在细胞核上也有分布,但间质细胞免疫阳性较其他细胞为弱。免疫组化示糖尿病组较正常组棕黄色较深;但8周组大鼠较4周组大鼠无统计学意义,颜色相差不是很大。
3 讨论
DM患者常有睾丸功能异常,特别是血中游离睾酮水平降低,雌二醇水平反而升高,而且随着病程的延长而加重,内分泌功能的异常是常见可治的性功能障碍或生殖功能障碍的发病原因之一[6]。糖尿病对睾丸组织PCNA表达起负相作用,而且随糖尿病病程进展即血糖升高,PCNA表达呈明显下降趋势,说明糖尿病可以损伤睾丸功能[7]。本实验结果表明糖尿病4周及8周组大鼠睾丸组织的PCNA表达的阳性率显著低于正常组,且具有统计学意义,糖尿病4周组和8周组间PCNA的表达阳性率虽然没有统计学差异,但是睾丸组织中PCNA的变化与血糖是呈负相关的。生长因子如EGF、TGF-α,下丘脑、腺垂体或激素受体异常也可能是男性功能障碍的原因之一,糖尿病神经病变所致的男性功能障碍更为常见[9]。部分男性不育患者体内激素水平之所以正常,是由于大量的调节因子如生长因子对维持正常生殖能力发挥了重要的作用,因此局部生长因子不适当的合成和释放在很大程度上影响男性性腺的自分泌和/或旁分泌途径,进而可能导致睾丸功能障碍[10]。
PCNA在睾丸生精细胞胞核内表达,且主要见于精原细胞和精母细胞,精子细胞少见。它既促进精原细胞的有丝分裂,又促进精母细胞的减数分裂,从而加速精子的生成。睾丸内细胞增殖对补充足够的生精细胞和体细胞、维持正常成年人生精是非常重要的[11]。在糖尿病对精子影响研究中发现DM大鼠的睾丸直径、平均曲细精管直径及PCNA指数明显下降,病理学显示糖尿病大鼠睾丸组织生殖细胞塌陷和弥漫缺乏[9]。Seethalakshmi等[12]研究显示糖尿病大鼠睾丸重量显著下降。另有报道,与正常人相比,糖尿病患者的血浆睾酮水平是降低的[13]。本实验结果也显示糖尿病组睾丸重量、血清睾酮水平较正常组下降,有统计学差异,4周组较8周组大鼠比较无统计学意义,但PCNA与睾丸重量及睾酮水平具有正相关性。D’Andrea等[14]应用免疫病理法检测暴露在有毒物质环境中大鼠睾丸组织的PCNA PI(增值指数),发现它能敏感、可靠、早期评估与大鼠睾丸增生程度有关的毒性作用。临床研究显示正常人睾丸的PCNA PI平均值约86.5%,而不育患者即生殖细胞无精子产生,PI为0[15]。因为PCNA与精子密度密切相关,其合成减少可能是患者精子发生紊乱的原因,因此它是检测不育患者生殖细胞动力学的有用的分子标记,并可作为患者临床治疗前后的监测指标[16]。
EGFR作为TGF-α和EGF的一种双重受体,能促进睾丸细胞增殖,维持正常睾丸大小。此外生长刺激激素,如卵泡刺激素和睾酮调节转化生长因子α和EGFR表达[17]。生精过程中,EGF与EGFR结合影响靶细胞——Sertoli和Leydig细胞的功能,从而改变雄激素的合成或其他因子的分泌,或通过旁分泌方式调节管周肌样细胞与生殖细胞相互作用。EGF可抑制Sertoli细胞中芳香化酶将睾酮转化为雌二醇,维持局部高浓度的睾酮[18];EGF可影响Leydig细胞分泌睾酮的能力,能提高线粒体中细胞色素P450对胆固醇底物的利用,增加3β2羟甾脱氢酶的活性,显著促使Δ52孕烯醇酮转化为孕酮,促进睾酮合成[19]。EGFR对精子生成、睾丸支持细胞和管周细胞之间相互作用有重要影响,并影响精子细胞生殖力、胚胎质量和怀孕[20]。EGFR还可通过改变直接刺激因子的基因表达,间接激发精原细胞增殖,也可以作为额外的内分泌因子,与内分泌因素如卵泡刺激素共同来调节精原细胞增殖;与EGFR相关的受体有ErbB1、ErbB2、ErbB4等,细胞内信号传导通路有MAPK级联和PI3K级联途径[21]。羊驼EGF和EGFR细胞特异性表达在发育中和青春期后睾丸组织,这种特定时期的表达显示出其在睾丸发育和功能调节方面具有重要的作用[22]。大鼠EGFR基因的剔除已经证明睾丸的发育发生了改变[23]。有推断EGFR的减少使EGF与受体结合减少,第二信使cAMP和第三信使c-Fos均减少,以致核转录和核基因PCNA的表达减弱[24]。
本项研究受实验设施、SD大鼠例数等实验条件的限制及温度、湿度等环境因素影响,没有观察到4周与8周组间大鼠睾丸PCNA及EGFR表达的差别。从文献报道[25]推测是由于一种抗氧化蛋白-金属硫蛋白Metallothionein(MT)的过表达能够保护B细胞的DNA免受损伤,影响DM大鼠成模可能导致DM病程组4周和8周大鼠的血糖、胰岛素水平没有统计学差异。但我们仍然可得出结论:PCNA及EGFR在糖尿病大鼠睾丸表达减少,在一定程度上影响了睾丸生精和睾酮分泌,并使睾丸重量下降,并且随糖尿病病情的加重而恶化,导致不同程度的生殖系统功能障碍。
[1]Salama M,TsujiM,Tamura M,et al.Impact of aging and diabetes mellitus on the expression of the proliferating cell nuclear antigen in rat testicular tissue[J].Arch Androl,1998,40(2):95
[2]Sexton WJ,Jarow JP.Effect of diabetesmellitus upon male reproductive function[J].Urology,1997,49(4):508
[3]Ballester J,MunozMC,Dominguez J,etal.Insulin-dependent diabetes affects testicular function by FSH-and LH-linked mechanisms[J].JAndrol,2004,25(5):706
[4]ScaranoWR,Messias AG,Oliva SU,etal.Sexual behaviour,sperm quantity and quality after short-term streptozotocininduced hyperglycaemia in rats[J].Int JAndrol,2006,29(4):482
[5]Amaral S,Moreno AJ,SantosMS,etal.Effectsofhyperglycemia on sperm and testicular cells of Goto-Kakizaki and streptozotocintreated ratmodels fordiabetes[J].Theriogenology,2006,66(9):2056
[6]白炳生,姚凯声,单立刚.糖尿病所致雄性生殖功能障碍的研究进展[J].中国实用医药,2008,3(30):199
[7]岳凤鸣,杜心欣,高福禄,等.糖尿病对小鼠睾丸组织中PCNA表达的影响[J].中国男科学杂志,2001,15(3):154
[8]Cameron DF,Rountree RE,ShultzD,etal.Sustained hyperglycemia results in testicular dysfunction and reduced fertility potential in BBWOR diabetic rats[J].Am JPhysiol,1990,259(6 Pt1):E881
[9]Altay B,Cetinkalp S,Doganavsargil B,etal.Streptozotocin-induced diabetic effects on spermatogenesis with proliferative cell nuclear antigen immunostainingofadult rat testis[J].Fertil Steril,2003,80(2):828
[10]Kassab M,Abd-Elmaksoud A,AliMA.Localization of the epidermal growth factor (EGF)and epidermal growth factor receptor(EGFR)in thebovine testis[J].JMolHistol,2007,38(3):207
[11]Schmahl J,Eicher EM,Washburn LL,etal.Sry induced cellproliferation in themousegonad[J].Development,2000,127(6):65
[12]Seethalakshmi L,Menon M,Diamond D.The effect of streptozotocininduced diabetes on the neuroendocrine male reproductive tractaxisof theadult rat[J].JUrol,1987,138(1):190
[13]IAndo S,RubensR,RottiersR.Androgen plasma levels inmale diabetics[J].JEndocrinol Invest,1984,7(1):21
[14]D’Andrea MR,Lawrence D,Nagele RG,etal.PCNA indexing asa preclinical immunohistochemical biomarker for testicular toxicity[J].JBiotech Histochem,2008,83(5):211
[15]Zeng L,Kong XT,Su JW,etal.Evaluation of germ-cell kinetics in infertilepatientswith proliferating cellnuclear antigen proliferating index[J].JAsian JAndrol,2001,3(1):63
[16]Salama N,TsujiM,Tamura M,etal.Proliferating cell nuclear antigen in testes of infertilemen with varicocele--preliminary results of interrelationship with sperm countbeforeand after varicocelectomy[J].Scand JUrolNephrol,2003,37(1):48
[17]Cupp AS,Skinner MK.Expression,action,and regulation of transforming growth factor alpha and epidermal growth factor receptor duringembryonic and perinatal rat testisdevelopment[J].JAndrol,2001,22(6):1019
[18]于军桥,邵继春,王久源.表皮生长因子及其受体对雄性生殖系统的影响[J].四川生理科学杂志,2002,24(1):4
[19]SordoulletC,Chauvin MA,Hendrick JC,etal.Sites of interaction between epidermal growth factor and transforminggrowth factor beta in the control of steroidogenesis in cultured porcine leydig cells[J].Endocrinology,1992,130(3):1352
[20]Erdog赞ru T,Gülkesen KH,BahceciM,etal.The roleofexpression of extracellularmatrix proteins and epidermal growth factor receptor activity on fertilization capacity of testicular harvested spermatozoa[J].Andrologia,2002,34(2):98
[21]AbéK,Eto K,AbéS.Epidermal growth factormediates spermatogonial proliferation in newt testis[J].JReprod Biol Endocrinol,2008,6(6):7
[22]He J,Dong C,You R,etal.Localization of epidermal growth factor(EGF)and its receptor(EGFR)duringpostnatal testisdevelopmentin thealpaca(Lamapacos)[J].JAnimalReprod Sci,2009,116(1/2):155
[23]Levine E,Miyashiro L,Skinner MK.Role of transforming growth factor alpha related ligands and the epidermal growth factor receptor in embryonic testisdevelopment[J].BiolReprod,2000,62(2):477
[24]高福禄,岳凤鸣,庞晓静,等.db/db自发型糖尿病小鼠睾丸EGFR,c-Fos表达研究[J].解剖学杂志,2001,24(6):532
[25]Chen H,Carlson EC,Pellet L,et al.Overexpression ofmetallothionein in pancreatic beta-cells reduces streptozotocin induced DNA damageand diabetes[J].Diabetes,2001,50(9):2040
