迎春花抑菌活性物提取工艺
2010-10-19罗玉燕卢成瑛桂克印
罗玉燕,卢成瑛,,*,伍 钢,桂克印
(1.吉首大学生物资源与环境科学学院,湖南 吉首 416000;2.吉首大学 湖南省林产化工工程重点实验室,湖南 张家界 427000)
迎春花抑菌活性物提取工艺
罗玉燕1,卢成瑛1,2,*,伍 钢2,桂克印2
(1.吉首大学生物资源与环境科学学院,湖南 吉首 416000;2.吉首大学 湖南省林产化工工程重点实验室,湖南 张家界 427000)
目的:优化迎春花花中抑菌活性物质的提取工艺。方法:以抑菌效果为指标,在单因素试验的基础上,确定提取溶剂的体积分数、提取温度和提取时间进行4因素3水平正交试验。结果:最佳提取工艺条件为:溶剂为体积分数90%乙醇溶液,60℃水浴加热2h;提取物对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、藤黄八叠球菌和变形杆菌的的最小抑菌浓度均为0.125g/mL,最小杀菌浓度均为0.25g/mL;提取物经强酸及高温处理后抑菌效果不明显,在碱性环境、紫外光、氧化还原剂处理后抑菌活性稳定;提取物的乙酸乙酯和正丁醇部位具有抑菌活性。结论:本实验所建立的工艺方法可应用于迎春花花中抑菌活性物质的提取。
迎春花花;提取;抑菌活性
Abstract:Objective:To optimize the extraction processing of antibacterial substances fromJasminum nudiflorumLindl flowers. Methods:On the basis of antibacterial activity as an index, orthogonal experiments were used to investigate the effects of solvent concentration, extraction temperature and extraction time on extraction rate of antibacterial substances fromJasminum nudiflorumLindl flowers. Results:The optimal extraction conditions were 90% ethanol, extraction temperature of 60 ℃ and extraction time of 2 h. The extract fromJasminum nudiflorumLindl flowers had the minimum inhibitory concentration of 0.125 g/mL and the minimum bactericidal concentration of 0.25 g/mL forStaphylococlus aureus,Sarcina lutea,Bacillus subitilis,Proteusbacillus vulgarisandEscheichia coli. Strong acid and heating treatments of the extract could result in the loss of antibacterial effect. On the other hand, antibacterial activity of the extract was not affected by UV, oxidants and reductants in alkaline environments. Antibacterial substances were existed in ethyl acetate and n-butanol phase during extraction process. Conclusion:The extraction processing in this study is feasible to extract bioactive substances with antibacterial activity fromJasminum nudiflorumLindl flowers.
Key words:flower ofJasminum nudiflorumLindl;extract;bacteriostatic activity
木犀科茉莉花属植物迎春花(Jasminum nudiflorumLindl.)在长江流域各地广有栽培,其花、叶亦为湘西民间常用草药。叶苦、平,可清热解毒、止血、止痛,用于治疗跌打损伤、外伤出血、口腔炎、妇科炎症、痈疖肿毒和外阴搔痒等症。花常作茶饮,其味甘、涩、平,清热利尿、解毒,可治疗头痛发热、泌尿系统感染和下肢溃疡[1]。文献记载迎春花的花、叶含丁香甙、迎春花苷和迎春花苦味质,有清热解毒之功效[2]。国内外已有迎春花叶和花中化学成分报道[3-7]。为有效地开发利用迎春花这一丰富的资源植物,本实验对迎春花花中的抑菌活性物的提取进行研究。
1 材料与方法
1.1 材料、试剂与仪器
迎春花花:2010年4至5月2010年4~5月采于吉首大学校园内,经吉首大学城乡资源与规划学院植物分类学廖博儒教授鉴定,45℃烘干,粉碎。
金黄色葡萄球菌(Staphylococlus aureus1.879)、大肠杆菌(Escheichia coli1.797)、藤黄八叠球菌(Sarcina lutea1.880)、枯草芽孢杆菌(Bacillus subitilis1.1849)、变形杆菌(Proteusbacillus vulgaris1.491)菌株均购于中国菌种保藏中心,本实验室冷冻保藏。
试剂为分析纯。
KQ-250E超声仪 昆山超声仪器有限公司;HH-6数显恒温水浴锅 金坛市富华仪器有限公司;RE-540旋转蒸发仪 Yamato公司;HM-20S pH酸度计 TOA电子公司;PW/10-002培养箱 重庆实验设备厂;CCV-1311超净工作台、SM-52高压蒸汽灭菌锅、AEG-220电子天平 日本岛津公司。
1.2 方法
1.2.1 迎春花抑菌活性物质提取工艺确定
1.2.1.1 单因素提取试验
提取溶剂体积分数的确定:在确定水浴加热提取时间3h、提取温度60℃的条件下,以1:30的料液比分别用蒸馏水、体积分数10%~90%乙醇溶液和无水乙醇进行提取,比较不同乙醇体积分数对提取迎春花花中抑菌活性物质的抑菌活性的影响。
加热提取温度的确定:在确定水浴加热提取时间为3h,及上一实验确定的提取溶剂体积分数的条件下,以1:30的料液比在15、30、45、60、75、90℃的温度条件下提取,比较不同提取温度对迎春花中抑菌活性物质的抑菌活性的影响。
超声辅助提取时间的确定:在上述试验确定的提取温度和提取溶剂浓度下,以1:30的料液比分别进行超声波处理,比较不同超声时间对提取迎春花中抑菌活性物质的抑菌活性的影响。
加热提取时间的确定:在上述单因素最佳条件下,以1:30的料液比在水浴锅中加热0.5、1、1.5、2、2.5、3、3.5、4h以确定提取时间对迎春花中抑菌活性物质的抑菌活性的影响。
1.2.1.2 正交试验

表1 正交试验因素水平表Table 1 Factors and levels of orthogonal experiments
根据上述单因素试验确定的条件范围,用乙醇作溶剂,以溶剂体积分数(A)、提取温度(B)、提取时间(C)、超声时间(D)四因素三水平,选择L9(34)正交试验进行迎春花花中抑菌活性物质提取的优化试验(表1),并进行方差分析,得出最佳提取条件。
取一定量干燥迎春花加入适量溶剂水浴加热提取(液固比30:1),滤液减压浓缩至生药质量浓度为1g/mL,检测各提取物对金黄色葡萄球菌、大肠杆菌、变形杆菌,藤黄八叠球菌及枯草芽孢杆菌生长的抑制活性,方差分析得最佳活性提取物的提取方法。
1.2.2 抑菌活性测定[8]
在盛有100片Φ6mm无菌滤纸片的小瓶中加入1mL提取液,45℃烘干备用。将试验菌种接于试管斜面,37℃、24h培养,重复两次活化菌种;向活化菌种管中加入适量无菌生理盐水,刮取菌苔、混匀,麦氏比浊配成108CFU/mL的菌悬液备用。在超净工作台上向营养平板中分别加入0.1mL菌悬液,L型玻棒涂布均匀,将药敏纸片等距放入含菌平板,37℃、12h培养后开始观测记录结果。另设蒸馏水为阴性对照,提取溶剂为空白对照,1mg/mL黄连素为阳性对照。
1.2.3 最小抑菌浓度(MIC)与最小杀菌浓度(MBC)测定
采用试管二倍稀释法测定最小抑菌浓度,称取最佳提取条件下提取的化合物1g置于小试管中,加入无菌培养基1.0mL,然后取出0.5mL放入第2管中,加入培养基0.5mL,依次类推,稀释成不同浓度,再用刻度滴管加入浓度为5×106CFU/mL(麦氏比浊)的各种菌液0.05mL,充分摇匀,使各试管的菌液浓度为5×105CFU/mL,含药量分别为1、0.5、0.25、0.125、0.0625、0.0312g/mL,置37℃摆床(200r/min)中培养16~24h观察结果,观察试管澄清度,若液体培养基混浊,表示细菌生长,若液体培养基完全清亮,表示无细菌生长。无细菌生长的最小浓度为最小抑菌浓度。设未加菌液为空白对照,黄连素为阳性对照。
将无细菌生长的液体培养基中取出0.1mL涂布平板,置37℃温箱中培养16~24h观察有无细菌生长。无细菌生长的最小浓度为最小杀菌浓度。
1.2.4 抑菌活性稳定性实验[9-10]
1.2.4.1 酸碱稳定性实验
用HCl、NH4OH稀释液将最佳条件下提取的提取物的pH值分别调至2、4、5、6、7、8、9、10、12,K-B纸片法测定抑菌活性。
1.2.4.2 热稳定性实验
试管分装适量提取物,置70、85、100、121℃处理15min,K-B纸片法测定抑菌活性。
1.2.4.3 紫外光处理试验
将5mL提取液分装于10cm培养皿中,置紫外灯(256nm,6W,样距25cm)下照射不同时间,K-B纸片扩散法测定抑菌活性。
1.2.4.4 氧化还原剂处理实验
于试管提取物中分别添加0.5%和1%的VC,0.25%和0.5% Na2SO3,0.25%和0.5% H2O2,处理15min,KB纸片法测定抑菌活性。
1.2.5 抑菌活性物的初步分离
将90%乙醇的提取物依次用石油醚、乙酸乙酯、正丁醇萃取,各萃取3次,将各萃取液及萃余水相适量浓缩至药液质量浓度为1g/mL,K-B纸片法测定抑菌活性。
2 结果与分析
2.1 最佳提取条件测定
2.1.1 单因素试验结果

图1 提取溶剂体积分数对抑菌活性物的影响Fig.1 Effect of solvent concentration on antibacterial activity of extract
由图1可以看出,当提取溶剂乙醇体积分数小于50%时,提取物对5种试验菌没有抑菌效果,当随着提取溶剂体积分数的提高,提取物的抑菌效果越来越明显,到90%时达到最大,所以选择90%的乙醇体积分数作为迎春花花中抑菌活性物的最适提取体积分数。

图2 加热提取温度对抑菌活性物的影响Fig.2 Effect of extraction temperature on antibacterial activity of extract

图3 超声提取时间对抑菌活性物的影响Fig.3 Effect of ultrasonic treatment time on antibacterial activity of extract
由图2得出,水浴加热提取时,随着温度的升高,抑菌活性物对5个受试细菌的抑菌效果均明显增大,但超过60℃时开始下降,所以60℃左右为水浴加热提取的最佳温度。
从图3的超声提取时间对抑菌活性物的影响可以看出,超声波处理后,活性物的抑菌活性随超声时间的增加并无明显变化。

图4 加热提取时间对抑菌活性物的影响Fig.4 Effect of extraction time on antibacterial activity of extract
由图4可知,水浴加热提取时间对活性物的抑菌活性影响较大,在加热1~3h之间活性物的抑菌效果较明显。
2.1.2 正交试验结果

表2 正交试验结果直观分析表Table 2 Results of orthogonal experiments
正交试验结果的直观数据分析表明,R3>R4>R1>R2,即因素C影响最大,因素D、A次之,因素B影响最小,方差分析结果表明,各因素均无显著影响,即因素影响主顺序为C、D、A、B。提示在迎春花花中抑菌成分提取时水浴加热的方法可取,但时间应当控制好,而超声波处理显著降低其抑菌活性,故不宜做超声波处理。
直观分析和方差分析得A2B2C2D1,即90%乙醇、60℃、2h、不超声为迎春花花中抑菌活性物提取最佳条件。以此作为以后实验提取物的提取条件(表2、3)。
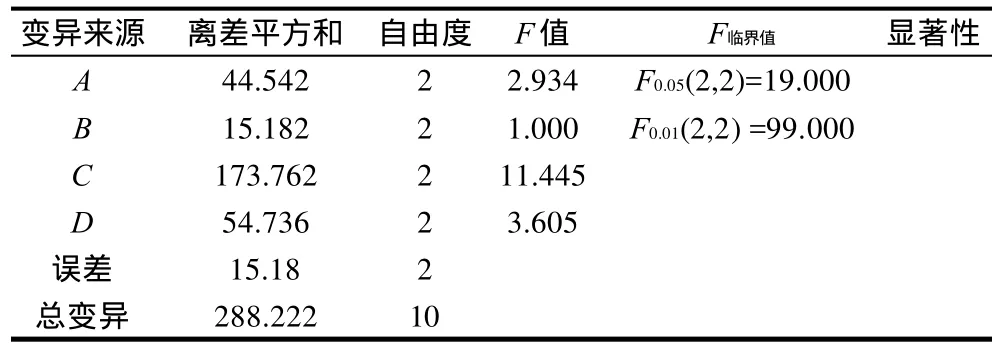
表3 正交试验方差分析表Table 3 Variance analysis of orthogonal experiments
2.2 最小抑菌浓度(MIC)和最小杀菌浓度(MBC)测定
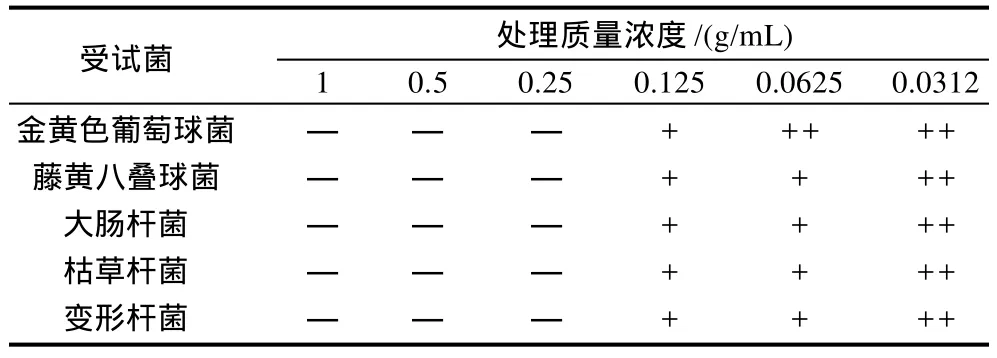
表4 迎春花花提取物最小抑菌浓度测定Table 4 Minimum inhibitory concentration of the extract fromJasminum nudiflorumLindl flowers
迎春花花提取物对5个受试菌的最小抑菌浓度均为0.125g/mL(表4),对5个受试菌的最小杀菌浓度均为 0.25g/mL(表 5)。

表5 迎春花花提取物最小杀菌浓度测定Table 5 Minimum bactericidal concentration of the extract fromJasminum nudiflorumLindl flowers
2.3 提取物抑菌活性稳定性实验
2.3.1 酸碱稳定性
实验表明提取物碱处理后抑菌活性较为稳定,酸对其活性影响较大。pH值≤2时,受试菌没有出现明显的生长抑制,但pH值≥4时,抑菌活性较为稳定(表6)。
2.3.2 热稳定性
提取液经高温处理后进行抑菌活性测定,结果表明高温处理对其抑菌活性有明显影响(表7)。
2.3.3 紫外光处理实验
提取物经过紫外光处理后均具强抑菌活性,表明紫外光处理对其抑菌活性无显著影响(表8)。
2.3.4 氧化还原剂处理实验
提取物经氧化还原剂处理后仍具有强抑菌活性,提示提取液抑菌活性物对强氧化还原剂具有较高的稳定性(表9)。
表6 酸碱处理后提取物的抑菌圈直径(±s,n=5)Table 6 Inhibition zone diameters of the extract with acid treatments (±s,n=5)mm
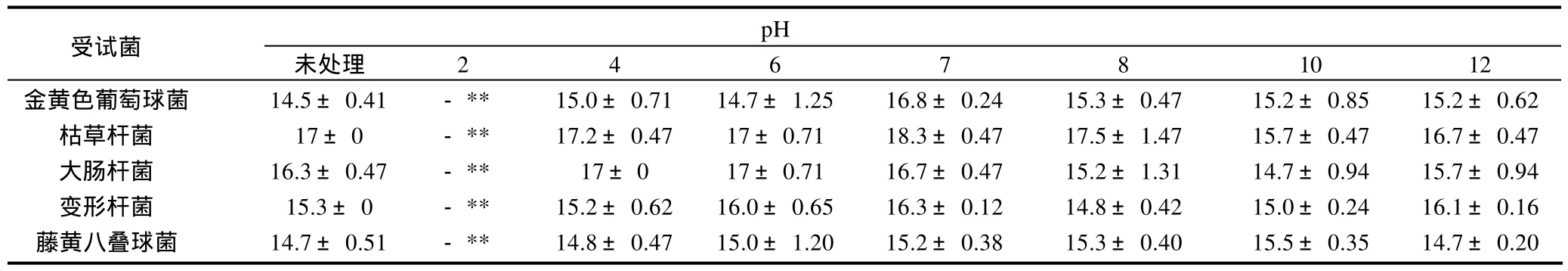
表6 酸碱处理后提取物的抑菌圈直径(±s,n=5)Table 6 Inhibition zone diameters of the extract with acid treatments (±s,n=5)mm
注:“-”表示没有明显抑菌圈(下同);**.P<0.01。
受试菌pH未处理 2 4 6 7 8 10 12金黄色葡萄球菌 14.5±0.41 - ** 15.0±0.71 14.7±1.25 16.8±0.24 15.3±0.47 15.2±0.85 15.2±0.62枯草杆菌 17±0 - ** 17.2±0.47 17±0.71 18.3±0.47 17.5±1.47 15.7±0.47 16.7±0.47大肠杆菌 16.3±0.47 - ** 17±0 17±0.71 16.7±0.47 15.2±1.31 14.7±0.94 15.7±0.94变形杆菌 15.3±0 - ** 15.2±0.62 16.0±0.65 16.3±0.12 14.8±0.42 15.0±0.24 16.1±0.16藤黄八叠球菌 14.7±0.51 - ** 14.8±0.47 15.0±1.20 15.2±0.38 15.3±0.40 15.5±0.35 14.7±0.20
表7 热处理后提取物的抑菌圈直径(±s,n=5)Table 7 Inhibition zone diameters of the extract with heating treatments (±s,n=5)mm

表7 热处理后提取物的抑菌圈直径(±s,n=5)Table 7 Inhibition zone diameters of the extract with heating treatments (±s,n=5)mm
热处理温度与时间未处理 70℃、30min 70℃、1h 85℃、30min 85℃、1h 100℃、30min 100℃、1h 121℃、20min金黄色葡萄球菌 17.5±0.41 16±0.82 16.8±0.24 14.7±0.47 12±0.82 10.2±0.62 8±0.82 —枯草杆菌 17±0 17±0 17.7±0.24 16.3±0.47 15.3±0.25 13.7±0.24 7.2±0.85 —大肠杆菌 17.3±0.47 16.7±0.47 17.3±0.94 15.5±0.41 13.8±0.24 9.7±0.24 8.5±0 —变形杆菌 16.8±0.24 15.8±0.23 16.1±0.51 15.5±0.26 14.4±0.23 10.5±0.15 8.9±0 —藤黄八叠球菌 15.3±0.21 14.8±0.25 13.8±0.26 12.5±0.56 11.8±0.60 9.80±0.30 9.0±0.26 —受试菌
表8 365nm紫外光处理后提取物的抑菌圈直径(±s,n=5)Table 8 Inhibition zone diameters of the extract with UV treatment at 365 nm (±s,n=5)mm

表8 365nm紫外光处理后提取物的抑菌圈直径(±s,n=5)Table 8 Inhibition zone diameters of the extract with UV treatment at 365 nm (±s,n=5)mm
15 30金黄色葡萄球菌 17±0 18.3±0.94 16.5±0.41 17.2±0.62枯草杆菌 16.7±0.94 17.7±0.94 17.8±1.03 18.2±0.85大肠杆菌 17±0.41 18±0 17.5±0.41 18.5±0.41变形杆菌 15.2±0.23 16.0±0.50 15.7±0.30 14.8±0.27藤黄八叠球菌 14.8±0.68 15.2±0.40 15.7±0.58 14.3±0.79受试菌 365nm紫外光处理时间/ min 05
表9 氧化还原剂处理后提取物的抑菌圈直径(±s,n=5)Table 9 Inhibition zone diameters of the extract with oxidant and reductant treatments (±s,n=5)mm

表9 氧化还原剂处理后提取物的抑菌圈直径(±s,n=5)Table 9 Inhibition zone diameters of the extract with oxidant and reductant treatments (±s,n=5)mm
空白对照未处理 0.5% VC 1% VC 0.25% Na2SO30.5% Na2SO30.25% H2O20.5% H2O2 1% VC 0.5% Na2SO30.5% H2O2金黄色葡萄球菌 16±0 16.7±0.24 16.2±1.20 17.1±0.83 16±0.72 15.3±0.9018.2±0.45 - - -枯草杆菌 15.7±0.92 16.4±0.31 17.2±0.74 17.3±0.27 16±0 15.6±0.64 16±0.62 - - -大肠杆菌 16±0.21 16±0.82 16.2±0.62 18±0 15.3±1.25 15.3±1.2517.7±0.64 - - -变形杆菌 15.6±0.32 15.8±0.75 16.0±0.56 15.4±0.42 15.8±0.32 14.8±0.2515.0±0.42 - - -藤黄八叠球菌 14.8±0.80 15.3±0.32 15.3±0.45 15.8±0.43 16.0±0.42 15.7±0.5215.5±0.80 - - -受试菌 氧化还原剂处理
2.4 抑菌活性物的初步分离
采用溶剂萃取法对抑菌活性物进行初步分离,各部位组分抑菌实验表明迎春花花中抑菌活性物质可溶于乙醇、乙酸乙酯和正丁醇(表10)。

表10 不同溶剂萃取物的抑菌圈直径Table 10 Inhibition zone diameters of the extract from different extraction solvents mm
3 结 论
本研究对迎春花提取物的抑菌活性进行系统研究,通过正交试验确证最佳提取条件为90%乙醇、60℃、水浴加热2h;提取物对金黄色葡萄球菌、枯草杆菌、大肠杆菌、变形杆菌和藤黄八叠球菌的最小抑菌浓度为0.125g/mL;提取物在强酸性环境中不稳定,紫外光、氧化还原剂处理对抑菌效果没有影响,但高温处理后以及在碱性环境中对其抑菌有影响。实验表明迎春花提取物具有一定的抑菌活性,迎春花花的乙醇提取物具有较明显的抑菌活性,在医药和食品防腐领域具有广阔的应用前景。
[1] 《全国中草药汇编》编写组. 全国中草药汇编[M] . 2版. 北京:人民卫生出版社, 1996:330.
[2] 江苏新医学院. 中药大辞典[M]. 上海:人民出版社, 1975:1156-1157.
[3] ANDARY C, TAHROUCH S, MARION C, et al. Caffeic glycoside esters fromJasminum nudiflorumand some related species[J].Phytochemistry, 1992, 31:885-886.
[4] TANAHASHI T, TAKENAKA Y, NAGAKURA N, et al. Five trimeric secoiridoid glucosides fromJasminum polyanthum[J]. Phytochemistry,1998, 48(2):317-322.
[5] TAKENAKA Y, TANAHASHI T, TAGUCHI H, et al. Nine new secoiridoid glucosides fromJasminum nudiflorum[J]. Chem Pharm Bull, 2002, 50(3):384-389.
[6] 杨振, 郑敏燕, 魏永生. 迎春花脂肪酸成分的GC/MS分析[J]. 应用化工, 2006, 35(4):307-315.
[7] 康文艺, 王金梅, 姬志强, 等. 迎春挥发性成分HS-SPME-GC-MS分析[J]. 天然产物研究与开发, 2009, 21(1):84-86; 121.
[8] 卢成瑛, 徐东翔, 杜勇, 等. 檵木叶抑菌活性成分提取分离与检测[J].食品科学, 2005, 26(7):40-42.
[9] 卢成瑛, 杨伟波, 黄早成, 等. 迎春花叶抑菌活性物研究[J]. 食品科学, 2007, 28(12):43-46.
[10] 卢成瑛, 唐克华, 黄早成, 等. 檵木花红色素提取物抑菌活性研究[J].食品科学, 2005, 26(10):107-110.
Extraction Processing of Antibacterial Substances fromJasminum nudiflorumLindl Flowers
LUO Yu-yan1,LU Cheng-ying1,2,*,WU Gang2,GUI Ke-yin2
(1. College of Biology Resource and Environmental Sciences, Jishou University, Jishou 416000, China;2. Key Laboratory for Forest Products and Chemical Industry Engineering of Hunan, Jishou University, Zhangjiajie 427000, China)
S685.18
A
1002-6630(2010)22-0129-05
2010-06-30
湖南省自然科学基金项目(03JJY6016)
罗玉燕(1983—),女,硕士研究生,研究方向为植物生态学。E-mail:luoyuyan2008@yahoo.com.cn
*通信作者:卢成瑛(1952—),女,教授,研究方向为植物资源开发利用。E-mail:lcy2109@163.com
