不同饲喂方式对生长猪背最长肌中钙蛋白酶抑制蛋白表达量以及肉嫩度的影响
2010-10-19沈阳农业大学刘婷婷朱宇旌
沈阳农业大学 张 勇 刘婷婷 朱宇旌
随着生活水平的提高,消费者对畜禽肉产品的瘦肉率和肉品质要求越来越高。一般瘦肉率主要体现在肌肉生长上,而肉的嫩度在很大程度上影响肉质。畜禽宰杀后,肌肉会变僵硬,过一段时间后,则会变得鲜嫩多汁,这个过程称之为肉的嫩化过程。在这个过程中,钙蛋白酶系统起着关键的作用,其中钙蛋白酶抑制蛋白(calpastatin)是高效且十分专一的钙蛋白酶(calpain)活性抑制蛋白,通过基因调控技术可以提高其在肌肉组织中的表达来抑制钙蛋白酶的活性,从而达到提高肌肉生长的目的。肉的嫩化与钙蛋白酶的活性有关,因此可以通过激活钙蛋白酶或降低钙蛋白酶抑制蛋白活性的方式提高肉的嫩度,改善肉质。本试验旨在研究不同的饲养方式对猪背最长肌中钙蛋白酶抑制蛋白表达量的影响及其与肌肉嫩度的关系,为以后进一步研究钙蛋白酶系统与肉品质的关系提供理论依据。
1 材料与方法
1.1 试验设计 选择日龄,胎次,体重相近,身体健康杜×长×大三元杂交生长肥育去势公猪54头,猪平均体重60 kg左右开始试验,随机分为3个处理,每个处理3个重复,每个重复6头猪。其中第1个处理为对照组(自由采食),第2个处理为限饲组,限饲30%,第3个处理为补偿生长组(前20 d限饲30%,后20 d自由采食)。预饲期1周,试验期40 d,40 d后进行屠宰试验,在第13~16骨间取猪背最长肌样本,肌肉样本迅速用液氮冷冻。-80℃保存。
1.2 试验日粮 试验日粮为自配料,参照NRC(1998)中60~90 kg猪的营养需要进行日粮设计,具体组成及营养水平见表1。
1.3 饲养管理 试验猪均采食干粉料,自由饮水,不供应青料。预饲期间所有猪均自由采食,并按正式试验要求计算每天耗料量,试验期限饲组按照自由采食组的70%饲喂,所有猪每天喂3次,分别为 07∶00、11∶30 和下午 5∶30 点,且 3 d 调整一次限饲组日采食量。
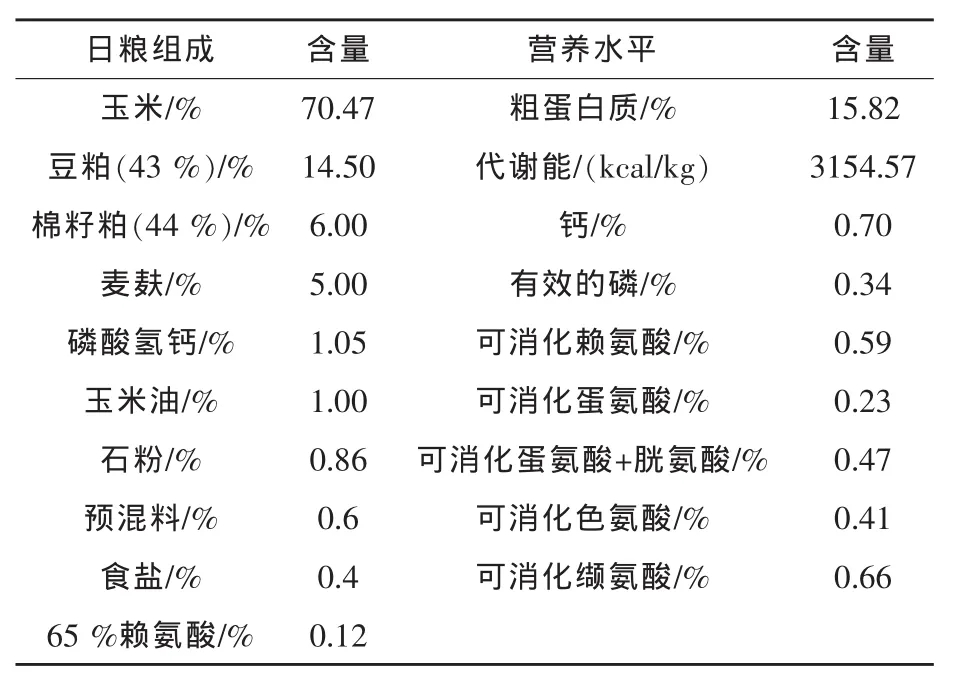
表1 基础日粮组成及营养水平
1.4 肉嫩度(剪切力)的测定 取第13~16胸椎部背最长肌一段,将试样肉表面附着的脂肪除去,装入塑料薄膜袋中包扎好,放在15~16℃条件下24 h进行尸僵前处理。然后将肉样置于冰箱冷藏层,在4℃条件下熟化24 h。取出完成熟化的肉样,在室温下放置1 h。然后,打开塑料薄膜包装袋,用温度计插入肌肉中心部,再包扎好肉样,保持袋口向上,放入80℃恒温水浴锅中,加盖后持续加热,直至肌肉中心温度达到70℃为止。取出肉样,放置于室温下使肌肉冷却至20℃备用。将冷却至20℃肉样,按与肌纤维呈垂直方向切取宽度为1.5 cm的肉片,再用1.27 cm直径的圆形取样器顺肌纤维方向钻切肉样块,做10个重复。记录10个肉块的剪切力值,计算算术平均数,单位用牛顿(N)表示。
1.5 用Western Blotting检测猪背最长肌中钙蛋白酶抑制蛋白的表达量
1.5.1 提取蛋白质并测定其浓度 使用蛋白质提取试剂盒(购自利普莱基因技术公司),先将肌肉从-80℃冰箱中取出后立即放入经灭菌的研钵中,加入液氮后将肉样研碎,装入10 mL离心管中-80℃冷冻保存。称取大约100 mg的肌肉样品,放入2 mL的离心管中,加入0.8 mL的蛋白裂解液,用组织匀浆机将肉样匀浆。取0.5 mL匀浆液加入1 mL蛋白质提取液,混匀室温静置10 min。 4℃,10000 r/min离心 10 min,用针管将液体吸出,将蛋白膜晾干。分别加2%的SDS约400 μL于各管中,沸水中煮10 min,将蛋白质完全溶解变性,4℃过夜。最后12000 r/min常温离心蛋白质溶液10 min,将不溶性沉淀离心出来,取上清液放入-80℃冰箱中保存待用。蛋白质浓度用考马斯亮蓝法测定 (购自碧云天蛋白质测定试剂盒)。
1.5.2 SDS-PAGE电泳 采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE,polyacrylamide gel electrophoresis)方法可对蛋白质的组分进行分离 (电泳槽用上海天能生产VE-180垂直板电泳槽)。每个加样孔的加样量统一为6 μg。10%分离胶(ddH2O 1.9 mL;30%Acr/Bis 1.7 mL;1.5 mol/L Tris-HCl (pH 8.8)1.3 mL;10%SDS 0.05 mL;10%过硫酸铵 0.05 mL;TEMED 0.002 mL),浓缩胶的浓度为5%[(ddH2O 1.4 mL;30%Acr/Bis 0.33 mL;1 mol/L Tris-HCl(pH 6.8)0.25 mL;10%SDS 0.02 mL;10%过硫酸铵 0.02 mL;TEMED 0.002 mL)];跑胶时恒压浓缩胶中电压80 V,分离胶中电压100 V。
1.5.3 转膜 将凝胶上的蛋白质用电转移槽 (上海天能Tanon,VE-186转移电泳槽)转移到硝酸纤维素膜上(NC膜),转膜在冰水浴的条件下进行,恒流100 mA转移90 min。此过程是试验中最为关键的一步。
1.5.4 封闭及抗体的孵育将转移完蛋白质的NC膜用脱脂奶粉配制的5%的封闭液37℃封闭2 h,然后用封闭液稀释的钙蛋白酶抑制蛋白抗体(1∶5000)2 mL,摇床上孵育 NC 膜,时间为 2 h(钙蛋白酶抑制蛋白抗体为Abcam公司生产的鼠单克隆抗体)。然后用TBST缓冲液漂洗膜4次,每次10 min。再用HRP标记的山羊抗鼠IgG第二抗体(1∶8000)孵育 NC膜,与一抗反应产物反应。反应时间为1 h(第二抗体购自天根生化科技有限公司)。然后用TBS漂洗液漂洗二抗3次,每次10 min。
1.5.5 底物显色及结果处理 用底物显色法使钙蛋白酶抑制蛋白显色,所用显色剂是二甲基联苯胺(DAB)。显色后的NC膜用扫描仪扫描,然后用用捷达JD801凝胶成像与分析系统进行图像处理和灰度扫描,得出钙蛋白酶抑制蛋白的IOD值。
1.6 数据分析 试验结果用SPSS 16.0统计软件进行单因素方差分析和多重比较,数据结果用平均数±标准差表示,并对数据进行相关分析。
2 结果与分析
2.1 不同饲喂方式对肉嫩度的影响 见表2。
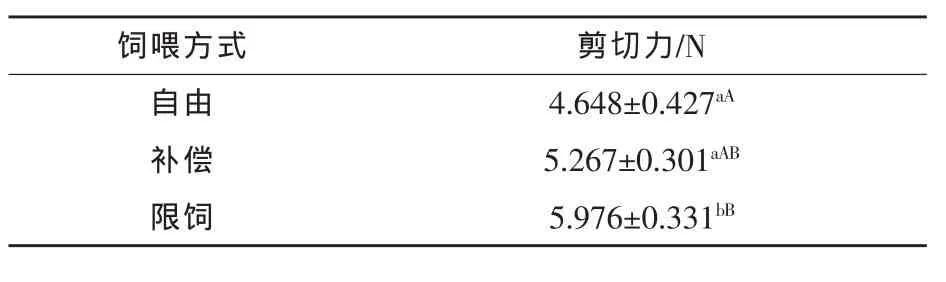
表2 不同饲养方式下对猪肉剪切力值的影响
表2显示:剪切力补偿生长组比自由组提高13.32%(P>0.05),限饲组比补偿生长组提高13.29%(P<0.05),限饲组比自由组提高28.38%(P<0.01)。
2.2 不同饲养方式对猪背最长肌中钙蛋白酶抑制蛋白表达量影响 见图1和表3。
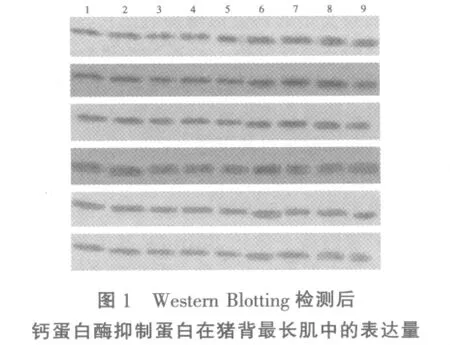
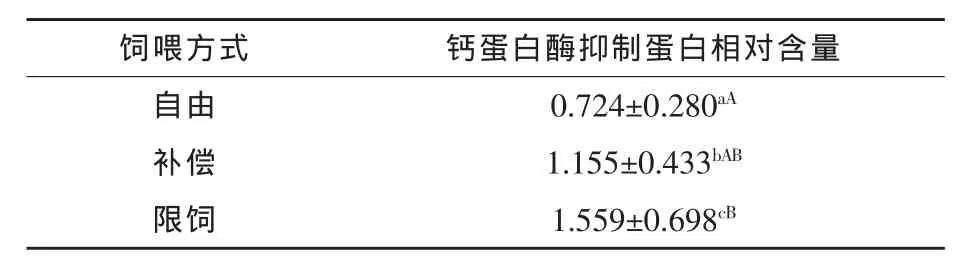
表3 不同饲养方式对猪背最长肌中钙蛋白酶抑制蛋白表达量的影响
图1为6张扫描后的NC膜,结果显示为54头试验猪背最长肌中的钙蛋白酶抑制蛋白,其中每张片子上有9条蛋白印记,这9条蛋白质印记分别代表9头猪的钙蛋白酶抑制蛋白表达量。自由、补偿生长、限饲组各3头猪,其中1、2、3为自由采食组,4、5、6 为补偿生长组,7、8、9 为限饲组。
表3显示,钙蛋白酶抑制蛋白表达量补偿生长组比自由组提高59.53%(P<0.05),限饲组比补偿生长组高34.98%(P<0.05),限饲组比自由组提高 115.33%(P<0.01)。
2.3 钙蛋白酶抑制蛋白表达量与肌肉剪切力的相关性 见图2。
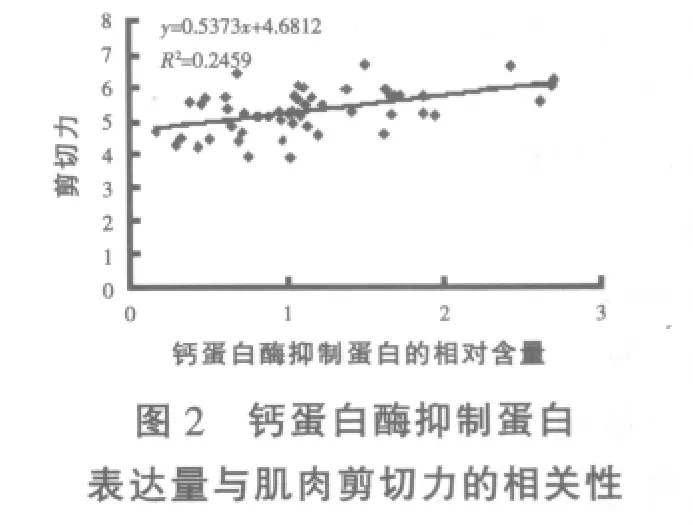
图2显示,钙蛋白酶抑制蛋白的表达量与肌肉剪切力相关性不显著(P>0.05),但呈上升趋势。
3 讨论
3.1 不同饲养方式对肌肉嫩度的影响 肉的嫩度是指肉在食用时口感的老或嫩,反映了肉的质地,由肌肉中各种蛋白质结构特性决定。对肉嫩度的评价主要根据其柔软性、易碎性、可咽性来判定。这些都是由人的口来感觉评判的,但也可以通过仪器来评价,如剪切力。肉的嫩度受饲养、营养及宰后加工、储存等多种因素的影响。近年来,国内外许多学者对不同饲喂方式对肉嫩度的影响进行了研究。汪尧春(1996)研究表明,限饲不利于肉嫩度和多汁性的提高。Ellis等(1996)报道,限饲降低了肉的嫩度、多汁性和(或)风味。Lametsch等(2006)认为,补偿生长后猪肉嫩度显著增加。
本试验表明,以自由组为对照,补偿生长组和限饲组的剪切力依次升高,并且补偿生长组和自由组差异不显著,限饲组和补偿生长组差异显著,而限饲组和自由组差异极显著。也就是说限饲极显著降低了猪肉的嫩度,而补偿生长可显著改善这种状况。这与许多前人的研究结果相似,改变饲喂方式可以作为调节肉嫩度的一种方法,但不是最好的方法。
3.2 不同饲养方式对背最长肌中钙蛋白酶抑制蛋白表达量的影响 国内外关于不同饲喂方式对钙蛋白酶抑制蛋白在猪背最长肌中蛋白质表达量的影响鲜有报道。Higgins等(1988)研究发现,羔羊饲喂高于其维持需要的营养对其钙蛋白酶系统无影响;Thomson等(1992)报道,限制采食使羔羊μ-钙蛋白酶/钙蛋白酶抑制蛋白活性显著升高,从而后肢蛋白质降解速度显著升高;然而禁食使断奶羔羊μ-钙蛋白酶/钙蛋白酶抑制蛋白活性显著降低,但后肢蛋白质降解速度仍显著升高。Thomson等(1997)认为,营养水平对断奶阉公羊骨骼肌钙蛋白酶系统活性均无影响,但肌肉蛋白质沉积速度与钙蛋白酶抑制蛋白活性呈正相关,肌肉蛋白质降解速度与μ-钙蛋白酶活性呈负相关。禁食使兔肌肉蛋白降解增加2倍,钙蛋白酶抑制蛋白mRNA水平增加312倍,但活性均无变化(Higgins等,1988)。由本试验可见,与自由采食组相比,背最长肌中钙蛋白酶抑制蛋白的表达量补偿生长组、限饲组依次显著上升,且补偿生长组和自由采食组,限饲组和补偿生长组差异显著,而限饲组和自由采食组差异极显著。也就是说限饲可显著增加钙蛋白酶抑制蛋白的蛋白表达量,加强了翻译水平。
3.3 猪背最长肌中钙蛋白酶抑制蛋白表达量与肌肉剪切力的相关性 嫩度是决定肌肉食用品质的重要指标之一。肌肉内结缔组织、肌间脂肪及保水性等和肌肉的嫩度均有一定的相关性,但不是影响肌肉嫩度的主要因素,而宰后肌肉在成熟过程中,骨架蛋白的降解对嫩度的提高起主导作用。Taylor等(1995)等发现,内源性的钙激活蛋白酶系对肌肉骨架蛋白的降解有重要的作用,试验用钙激活蛋白酶的提取液处理分离的肌原纤维,结果发现,肌原纤维的Z线崩溃并逐渐消失,很大程度上削弱了肌原纤维,同时肉的嫩度也得以大大提高。目前,大量的研究已证实;钙激活蛋白酶系广泛存在于各组织中,与动物的生长速度和宰后肌肉的嫩化有着密切的关系。
本试验对钙蛋白酶抑制蛋白表达量和肌肉剪切力做了相关回归分析,随着钙蛋白酶抑制蛋白表达量的增多,剪切力值就越大,肉的嫩度越差,这与许多前人的研究结果相似。Kristensen等(2002)研究认为,m-钙蛋白酶涉及猪肉生长,而μ-钙蛋白酶和钙蛋白酶抑制蛋白的宰后活性与猪肉的嫩化作用有关。Melody等(2004)研究表明,钙蛋白酶及其抑制蛋白与肌肉发育之间存在着密切相关,钙蛋白酶抑制蛋白能提高肌肉的嫩度值,而肌原纤维又占成熟骨骼肌蛋白重量的50%~60%,所以通过调节钙蛋白酶和钙蛋白酶抑制蛋白的活性可调节肌肉的发育,从而提高家畜的瘦肉率和产出率,提高肌肉的质量。Koohmaraie 和 Geesink(2006)研究认为,高水平的钙蛋白酶抑制蛋白能抑制宰后肌肉蛋白水解和嫩化,μ-钙蛋白酶作用于宰后肌肉蛋白水解和嫩化是间接性的。
近年来,对钙蛋白酶抑制蛋白与肉嫩度相关性进行了一系列研究。孙立彬等(2005)对125头杂交猪进行屠宰测定,通过钙蛋白酶抑制蛋白基因型与屠体性状、肉质性状的相关分析,得出钙蛋白酶抑制蛋白基因对肌内脂肪含量具有显著影响。证明了钙蛋白酶抑制蛋白基因是一个对肉质相关性状非常有用的候选基因。程丰等(2006)发现,钙蛋白酶抑制蛋白基因的一定基因型与猪肉的嫩度存在相关性,钙蛋白酶抑制蛋白基因存在Ras1、msp1、Hinf1等内切酶的酶切位点,为钙蛋白酶抑制蛋白基因作为猪肉嫩度的候选基因奠定了基础。杨晓慧等(2006)对莱芜猪、大白猪、杜洛克和商品杂交猪的钙蛋白酶抑制蛋白Ser638Arg突变位点的多态性分析,证实Ser638Arg突变可能促进钙蛋白酶抑制蛋白的磷酸化,从而影响猪屠宰后肌肉的蛋白质水解。武艳群等(2007)研究了钙蛋白酶抑制蛋白基因限制性内切酶片段长度多态性(RFLP)与金皮F2代猪眼肌面积、眼肌系水力和眼肌导电率等屠宰性状的关系。结果显示,ABCDEF基因型个体比BBDDFF基因型个体眼肌面积小12.42%,从而进一步证明了钙蛋白酶抑制蛋白基因是一个与肉质相关性非常高的候选基因。
4 结论
4.1 不同的饲喂方式对背最长肌的剪切力值影响显著,与自由采食组相比,对猪采取限制饲养的方式,极显著降低了猪肉的嫩度,而先限饲后补偿生长可以显著改善这种状况。
4.2 不同的饲喂方式导致背最长肌中钙蛋白酶抑制蛋白的表达量不同,与自由采食组相比,限饲组极显著提高了钙蛋白酶抑制蛋白的表达量,加强了钙蛋白酶抑制蛋白的翻译水平。
4.3 背最长肌肌肉剪切力值随背最长肌中钙蛋白酶抑制蛋白的表达量增多而有增加的趋势。
4.4 综上所述,自由采食时,肥育猪背最长肌中钙蛋白酶抑制蛋白表达量较少,嫩度较好。而限饲使钙蛋白酶抑制蛋白表达量增多,降低了肉的嫩度。
[1]程丰,赵云焕,易本驰,等.猪CAST基因PCR-RFLPs与肉质相关性的分析[J].河南农业科学,2006,2:103 ~ 106.
[2]孙立彬,孟和,王起山,等.猪2型钙蛋白酶抑制蛋白基因cDNA的克隆序列分析[J].上海交通大学学报(农业科学版),2005,23(3):66 ~ 69.
[3]汪尧春.饲料营养与猪肉品质[J].饲料研究,1996,7:11 ~ 13.
[4]武艳群,吴旧生,赵晓枫,等.猪CAST基因与肌纤维组织学特性及屠宰性状的相关性分析[J].遗传,2007,29(1):65 ~ 69.
[5]杨晓慧,刘源,武英,等.猪钙蛋白酶抑制蛋白基因的多态性分析[J].中国畜牧杂志,2006,42(19):8 ~ 9.
[6]Bee G,Calderini M,Biolley C,et al.Changes in the histochemical properties and meat quality traits of porcine muscles during the growing-finishing period as affected by feed restriction,slaughter age,or slaughter weight[J].J Anim Sci,2007,85(4):1030 ~ 1045.
[7]Ellis M,Webb A J,Avery P J,et al.The influence of terminal sire genotye sex slaughter weight feeding regime and slaughter house on growth performance and carcass and meat quality in pigs and on the organoleptic properties of fresh pork[J].J Anim Sci,1996,62:521 ~ 530.
[8]Higgins J A,Lasslett Y V,Bardsley R G,et al.The relation between dietary restriction or clenbuterol (aselective beta 2 agonist)treatment on muscle growth and calpain proteinase(EC 3.4.22.17)and calpastatin activities in lambs[J].Br J Nutr,1988,60(3):645 ~ 652.
[9]Koohmaraie M,Geesink G H.μ-Calpain is essential for postmortem proteolysis of muscle proteins1[J].J Anim Sci,2006,84:2834 ~ 2840.
[10]Kristensen L,Therkildsen M,Riis B,et al.Dietary-induced changes of muscle growth rate in pigs:effects on in vivo and postmortem muscle proteolysis and meat quality[J].J Anim Sci,2002,80:2862 ~ 71.
[11]Lametsch R,Kristensen L,Larsen M R,et al.Changes in the muscle proteome after compensatory growth in pigs[J].Anim Sci,2006,84:918 ~922.
[12]Melody J L,Lonerqan S M,Rowe L J,et al.Early postmortem bilchemical factor influence tenderness and water-holding capacity of three porcine musles[J].J Anim Sci,2004,82:1195 ~ 205.
[13]Taylor G,Geesink H,Thompson F,et al.Is Z-Disk degradation responsible for postmortem tenderization[J].J Anim Sci,1995,73:1351 ~ 1367.
[14]Thomson B C,Hosking B J,Sainz R D,et al.The effect of nutritional status on protein degradation and components of the calpain system in skeletal muscle of weaned wether lambs[J].Journal of Agriculture Science,1997,129:471~477.
[15]Thomson B C,Oddy V H,Sainz R D,et al.Nutritional effects on the calpain system in the skeletal muscle of sheep[A].Proceedings of the new zealand society of animal production,1992,52:101 ~ 102.
