微细腔内甲烷湿空气低温重整特性热力学分析
2010-10-14冉景煜赵柳洁
冉景煜 赵柳洁
(重庆大学动力工程学院,重庆 400044)
微细腔内甲烷湿空气低温重整特性热力学分析
冉景煜*赵柳洁
(重庆大学动力工程学院,重庆 400044)
从理论上探讨低温(小于973 K)、压力、空碳比及水碳比对重整特性及甲烷转化率的影响,以及各参数的合理取值范围;同时,对甲烷自热重整系统与无氧重整系统进行了性能对比.研究结果表明:微细腔在温度大于633 K,反应压力小于0.10 MPa,空碳(摩尔)比为2.0以及水碳摩尔比在1.0-2.5之间有利于甲烷自热重整反应的发生;自热重整与无氧重整体系相比,当甲烷质量流量一定时,有氧系统可以在较低的水碳比和较低的温度条件下获得较高的甲烷转化率和氢气产量.
微细腔; 低温; 自热重整; 热力学分析; 无氧系统; 对比
Abstract:We studied the effects of reaction pressure,molar ratios of air to methane and steam to methane on the reforming process at temperatures below 973 K theoretically.Their reasonable ranges were also studied.We also compared the performance of a methane autothermal reforming system and a non-oxygen system.Results show that methane autothermal reforming occurs much more easily at temperatures above 633 K,reaction pressures below 0.10 MPa,a molar ratio of air to methane of 2.0,and a molar ratio of steam to methane between 1.0 and 2.5.At a definite methane mass flow,a higher methane conversion rate and hydrogen yield can be obtained at lower temperatures and in lesser steam to methane ratio in an autothermal reforming system compared with a non-oxygen system.
Key Words: Micro-combustor;Low temperature;Autothermal reforming;Thermodynamic analysis;Non-oxygen system;Contrast
在微细腔中加氢来保持燃料燃烧的稳定和不熄火是很多科研人员研究的热点,氢气的加入扩展了燃料的着火极限,并降低着火温度.有学者将氢气直接加入到燃料气中用来改善燃烧[1-2];也有学者提出可利用甲烷水蒸气的高温(1100 K左右)重整,使产生的部分氢气混入尚未燃烧或正在燃烧的混合气中,从而改善燃料的着火、燃烧特性[3-5];自热重整制氢技术与甲烷水蒸气重整相比,变外供热为自供热,反应热量利用较为合理,既可以限制反应器内的高温,又降低了体系的能耗[6-7],从而比较容易实现在微细腔初始段的低温和欠氧环境中产氢.目前甲烷自热重整的研究主要集中在大空间下不同反应器和不同催化剂对获取大量合成气产生的影响[8],而对微细腔燃烧特性与催化重整的研究基本围绕高温环境下氢气-氧气、甲烷-空气或甲烷-水蒸气展开[9-10].针对甲烷湿空气低温自热重整特性来改善燃烧以实现微尺度下燃料持续稳定燃烧的基础性研究报道极少.因而有必要深入研究微细腔内低温低燃料流量自热重整反应的特性和影响因素.
于此,本文采用平衡常数法对微细腔中甲烷自热重整在低温下的反应特性进行了热力学分析,从理论上探讨欠氧条件下温度(小于973 K)、压力、空碳比(摩尔比)和水碳比(摩尔比)对自热重整产氢以及甲烷转化率的影响,并对有氧的自热系统与无氧重整系统进行性能对比,以期获得微细腔内低温低水碳比下自热重整反应的规律及合理反应参数,为进一步实验研究和开发微细腔催化重整燃烧技术提供理论基础与依据.
1 微细腔内甲烷自热重整体系
甲烷自热重整反应实际上是部分氧化重整和甲烷水蒸气重整的耦合,通过调控这两个过程的反应速率来实现系统自热运行是可行的.自热重整理想的整体反应可用如下化学式表示[11]:

由此可知氧气与甲烷摩尔比φ是比较关键的参数.当φ=0时,代表水蒸气重整反应的条件,该反应为强吸热反应;当φ增大时,即原料气中氧气含量增大,反应的吸热程度降低;当φ=0.44时,反应中的热量达到最低值.通常,甲烷自热重整反应在放热条件下(φ≥0.44)进行,即满足空气与甲烷的摩尔比应大于或等于2,产生的热量用于弥补热量损失和提高反应温度[12].
微细腔中甲烷湿空气自热重整是一个复杂的体系,部分氧化反应所放出的热量应高于甲烷水蒸汽重整所吸收的热量,两个过程既可以分两步进行也可以混在一起进行.暂不考虑碳的析出和氮氧化物的生成,在此采用Christensen等[13]推荐的主要反应如下:

上述反应式虽多,但对化学平衡来说,只需研究对应的独立反应.独立反应是指一组包含了体系所有物种的反应,且其中任一个方程式不能用组中其余反应式的线性组合求得.而体系另外的反应式均可从这组独立反应的线性组合中求得[14].这一体系中共有 CH4、H2O、CO、H2、CO2、O2、N2七种物质,它们由C、H、O、N四种元素组成,因此应有三个(物种数-元素数=7-4=3)独立反应.反应(2)-(4)满足上述独立反应的特点,且是诸多学者在甲烷重整研究中认可的重要反应.本文选此三个反应进行热力学平衡计算,体系的其他反应均可由这三个反应的线性组合获得.
热力学方法是通过对反应平衡时最大产率、平衡转化率及平衡体系各物质浓度的计算,判断出化学反应进行的程度,从而考察体系进行的可行性.一般而言,微反应器结构微小,物料在其中停留时间较短、易出现反应效率低下等问题.但微反应器本身能在小尺度空间上耦合吸热和放热反应,使得传热系数比传统反应器提高2个数量级,可将传统的秒级甲烷重整反应提高为毫秒级反应过程,约为0.01-0.1 ms[5].本文主要是研究毫米级微细腔,如直径是1 mm的微细圆管道,其质量流量选为7 g·h-1,即使管道长度仅为1 mm(微细腔长度一般大于1 mm),气体停留时间约为0.29 ms,大于反应发生的时间,符合平衡反应研究的条件.
此外,物料停留的时间与质量流量成反比,选择合理的流量则是整个研究的基础.对于停留时间低于甲烷反应时间时,甲烷质量流量对体系影响较大;当气体在微细腔内的停留时间超过反应发生所需的时间即反应达平衡时,甲烷质量流量对结果的影响不大,在满足一定功率的前提下优先选择较低的质量流量.本文是针对物料停留的时间大于反应时间的研究,故进行定甲烷质量流量的热力学分析.近几年国内外发展起来体积在1 cm3量级上的微型发动机,能产生大约10-100 W的功率,设计工况耗燃料在7 g·h-1左右[15],在此基础上,选取甲烷质量流量为6.6 g·h-1作为基础参数,用以开展后续的热力学平衡计算.
2 热力学计算方法
通过上述分析得出的独立反应,找出各反应的平衡常数关系式.因为参加反应的物种应同时满足所有独立反应的平衡,建立方程可求得体系平衡时的气相组成,从而获知组分特性变化.
2.1 反应平衡常数的计算

表1 298 K及常压下各物质的热力学常数Table 1 Thermodynamic constants of each substance under 298 K and atmospheric pressure
热容Cp与温度T的函数关系如下[16](a、b、c各值见表1):

由 △G⊖(298)=-RTlnK298求出 lnK,代入(12)式可计算出积分常数项IK,得到各反应平衡常数与温度的函数关系见表2和表3,K2-K4分别表示为反应(2)-(4)式的平衡常数.可以看出,随着反应温度的升高,K2的值虽然随之减小,但其对应的值相对大得多,也就是说相同温度下反应(2)比其他各反应更易发生,为自热体系所需能量提供一定的保障.平衡常数K3的值随温度升高在973 K以后陡然增大,说明高温更有利于吸热反应的甲烷水蒸气重整.而平衡常数K4则随着温度的升高逐渐减小,温度低时其值较大,在973 K以后,变化相对较小,说明温度过高会抑制放热反应(4)的进行.从化学平衡的角度讲,该低温体系存在一个促使各反应能顺利进行的温度范围.
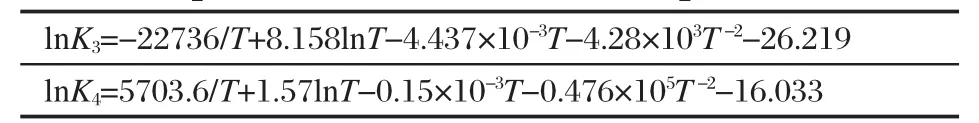
表2 反应平衡常数与温度的关系Table 2 Relationship between reaction equilibrium constant and temperature

表3 不同温度下的反应平衡常数Table 3 Reaction equilibrium constant at different temperatures
2.2 重整反应平衡各组分特性模型
甲烷与氧气易发生氧化反应,欠氧条件时氧气消耗完全:
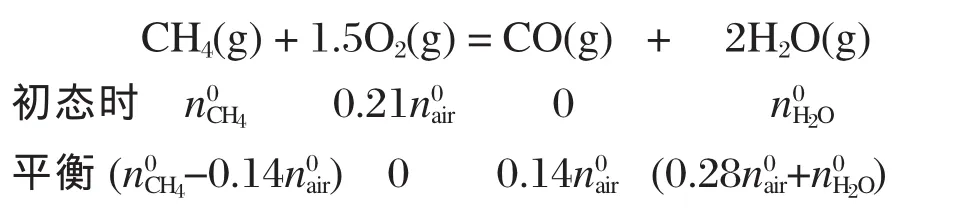
再设反应(3)中 CH4转化了x mol·h-1,反应(4)中CO转化了y mol·h-1,

那么平衡时各组分的摩尔流量ni见表4.定义CH4转化率:CO2和 CO 选择率:组分产量单位为mol·mol-1.
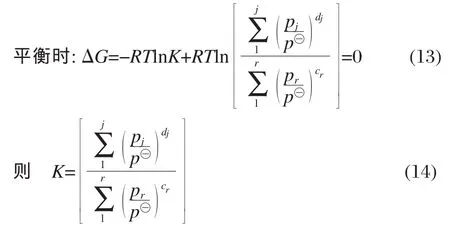
pj表示生成物分压;pr表示反应物分压;dj和cr分别表示各反应中生成物和反应物对应的化学计量数),通过气体状态方程将气体组分分压换算成摩尔浓度[14]可得:
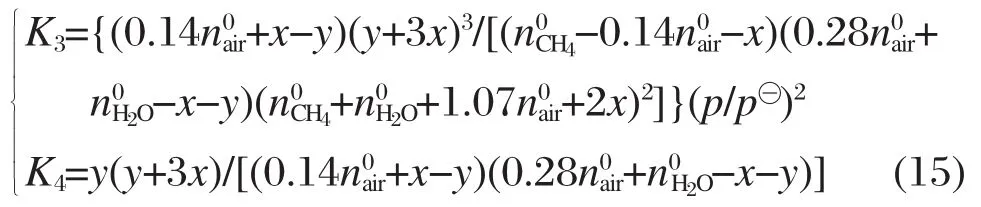

表4 反应平衡时各组分的摩尔流量Table 4 Molar flow of each component at reaction equilibrium
将不同温度下计算得到的平衡常数K3和K4的值代入式(15),建立方程组.利用MATLAB软件计算该非线性方程组即可获取对应温度、压力及原料配比条件下,各物质的平衡组成.针对微细腔的尺寸特点,参照文献[12]和化学反应式(1)的摩尔比,选取微细腔基本反应参数是:甲烷质量流量MCH4=6.6 g·h-1,α=2.0,β=1.0,p=p⊖,物料进气温度即反应温度.
3 重整反应特性热力学分析结果与讨论
3.1 温度的影响
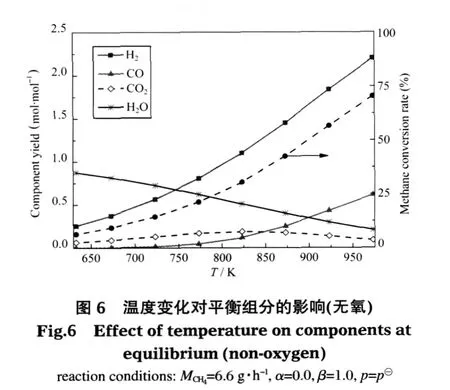
基本参数不变 (MCH4=6.6 g·h-1,α=2.0,β=1.0,p=p⊖),考察温度对热力平衡时各组分产量的影响,如图1和表5所示.结果发现,温度在达到633 K以后才能同时发生甲烷部分氧化反应(2)、甲烷水蒸气重整(SMR)反应(3)和水汽转换(WGS)反应(4),并有微量氢气产生.633 K时H2产量为0.27 mol·mol-1,主要来源于WGS反应,CH4转化率为28%,二者在633-973 K之间增长幅度较大,达973 K后两值分别维持在2.30 mol·mol-1和95%左右;CO的产量也一直增加,973 K以后其值在0.68 mol·mol-1左右;生成的CO2随温度变化先增加后减小,在823 K时产量最大为0.41 mol·mol-1;H2O的产量随温度增大一直在减小,但也在973K以后趋于稳定.这里973 K以后的变化特性与文献中的模拟结果[3]较为一致.这是因为温度的增加极大程度地推动了SMR反应的进行,导致CH4转化率,CO、H2的增加和H2O的减少.在低温条件下水汽转换(WGS)反应(4)进行的程度较大,使得CO2的量增加,而温度的增加和H2O的减少都抑制WGS反应的进行,从而导致CO2的含量在823 K时达到最大并开始逐渐减少.虽然WGS反应对CO有一定的消耗,但总体来说呈不断增长趋势,温度的增加对该反应颇为不利,所以在较低温段(小于823 K)CO增加的幅度很小,在较高温段增加幅度加大.
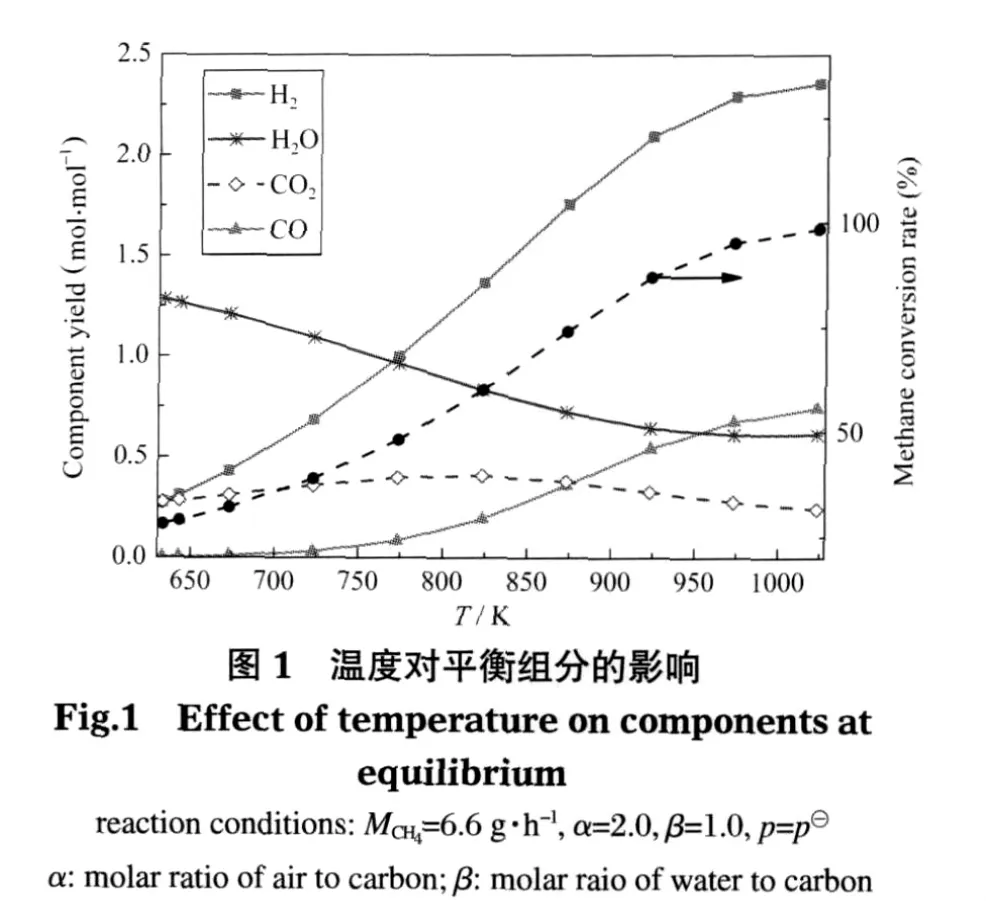
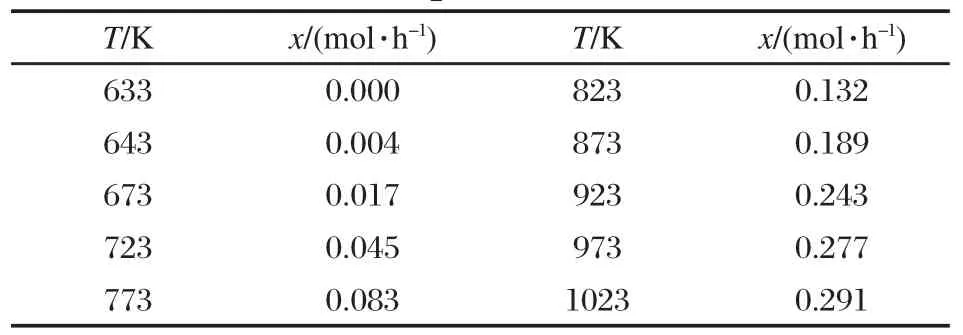
表5 不同温度下反应(3)中转化甲烷的量Table 5 Reacted methane in reaction(3)at different temperatures
从图中可以看出,温度在633-973 K之间可实现微细腔内甲烷自热重整,并在此范围内能获得高于28%的甲烷转化率和大于0.27 mol·mol-1的氢气产量,且CO2的体积含量在823 K达到最多为0.41 mol·mol-1.温度超过973 K以后,各组分变化相对平稳.
3.2 压力的影响
原料气进气组成不变(MCH4=6.6 g·h-1,α=2.0,β=1.0),考察温度为973 K时反应压力对热力学平衡时各组分的影响,见图2.可以看出,随着压力增大,CH4转化率和H2的产量均有所减少,其中CH4转化率下降的幅度较大.如反应压力为0.10 MPa时,H2产量为 2.29 mol·mol-1,CH4转化率为 95.2%;反应压力为0.15 MPa时,二者对应的值分别为2.19 mol·mol-1和91.40%,反应压力从0.10 MPa增加到0.15 MPa,H2量减少了 0.10 mol·mol-1,而 CH4转化率下降了3.80%.其他组分含量随压力增加变化并不大,CO、CO2、H2O 的产量分别维持在 0.70、0.28、0.60 mol·mol-1左右.从化学平衡的角度出发,该反应体系是体积增大反应,压力过高,反应向体积减小的方向进行,CH4转化率和H2产量因此减少,不利于该体系重整反应的发生.
表6反映了633 K及以上温度时,不同压力下甲烷水蒸气重整反应中转化甲烷的量.可以看出压力大于0.10 MPa以后,633 K对应的值为负值,说明此时SMR反应困难;大于633 K时,SMR反应都适量开展并随着温度的升高转化的甲烷量增多,这与前面温度影响的分析结果一致.如反应压力为0.12 MPa时,633 K转化的甲烷量为-0.002 mol·h-1,653、773、873 K 对应的值分别是 0.005、0.046、0.130 mol·h-1.所以反应压力应不大于0.10 MPa,才有利于633-973 K范围内实现微细腔低温自热重整产氢.
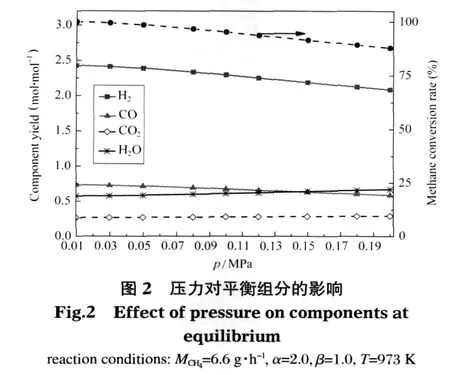

表6 不同压力下反应(3)中转化甲烷的量Table 6 Reacted methane in reaction(3)under different pressure

3.3 空气含量的影响
除空碳比外,其他基本参数保持不变(MCH4=6.6 g·h-1,β=1.0,p=p⊖),考察 973 K 下空碳比对热力学平衡时各组分的影响,见图3.如图所示,随着空碳比的增加,CH4转化率、H2O和CO2的产量都逐渐增加;H2和CO产量先略有增加,在空碳比增加到1.0以后有小幅度减少,而在空碳比达2.0以后,二者下降的幅度明显增大.如空碳比为0.5时,CH4转化率为79.97%,H2O、CO2、H2和CO的产量分别是 0.28、0.13、2.32、0.67 mol·mol-1;空碳比为 1.0 时,CH4转化率为 87.10%,H2O、CO2、H2和 CO的产量分别是0.38、0.17、2.36、0.70 mol·mol-1; 空 碳 比 为 2.0 时 ,CH4转化率为95.2%,其余各项对应的产量分别是0.61、0.28、2.30、0.67 mol·mol-1;空碳比为 3.0 时,以上各项对应的值分别为 98.40%、0.89、0.39、2.08、0.59 mol·mol-1.不难看出,空碳比从0.5到3.0,CH4转化率、H2O和CO2的产量分别增加了 18.43%、0.61和0.26 mol·mol-1;H2和CO的产量在空碳比从0.5增加到 1.0时,分别增加了 0.04和 0.03 mol·mol-1,空碳比从1.0变化到2.0,二者却下降了0.06和0.03 mol·mol-1,空碳比从2.0继续增加到3.0,二者的产量居然下降了0.21和0.08 mol·mol-1.这是因为欠氧环境中氧气的增加易促进了CH4、H2及CO的氧化,使得甲烷转化率、H2O和CO2的产量相应增加.而且参与SMR反应的甲烷量在空碳比为1.0时也最大,占进料气中甲烷含量的73%,见图4.H2和CO在氧气量严重不足时(空碳比小于1.0),甲烷转化率较低,作为二者主要来源的SMR反应在体系中占主导地位.此时体系本身热量不多,因此增加极少量氧气参与反应获得的热量和水既促进SMR反应产氢也促进WGS反应,H2和CO增加的产量大于被氧化减少的量,故表现为先增加.随着空碳比(大于1.0)的增加,体系热量逐渐增加,参与SMR反应的甲烷量逐渐减少,尤其是空碳比大于2.0以后减少幅度更大,如空碳比为1.0时,参与SMR反应甲烷比例为73.00%;空碳比为2.0时,对应的值下降为67.20%;空碳比为3.0时,其值却下降到56.40%,H2和CO在体系中增加的量因此减少较快,而空气的增加使两者被氧化消耗的量增大,故两者在空碳比为1.0以后呈减少趋势,并在空碳比达到2.0以后迅速下降.

另外从图4中CO和CO2的选择率变化来看,空碳比较小时,CO的选择率比CO2高得多,体系生成CO占优势,如空碳比为1.0时,二者的选择率分别为83%和17%.CO的选择率随着空碳比的增加一直减小;而CO2却相反,且空碳比大于4.0以后,CO2的选择率反超CO.由此看出空碳比增加对体系CO向CO2的转化很有利,CO的产量也因消耗幅度不断增大最终呈减小趋势.
由此看出欠氧条件时,体系较易产生氢气.但氧气量过多,会使得氢气因被氧化而大量消耗.为了尽可能维持多的氢气产量和提高甲烷转化率,综合考虑微细腔内空碳比不易过高.在本文所示的反应条件下,空碳比为2.0时,甲烷的转化率已达95%以上,此时氢气的产量也达2.30 mol·mol-1,满足反应体系的要求.
3.4 水蒸气含量的影响
大空间下研究甲烷水蒸气重整产氢要求保持较高的水蒸气甲烷比率(3.0-5.0),文中对甲烷湿空气重整的研究是为实现少量氢气的产生,稳定和加强微细腔内的燃烧.不难理解,水蒸气过多会导致微尺度环境温度降低,影响燃烧效果,在此以研究低燃料流量(水碳比小于3.0)的自热重整为主.
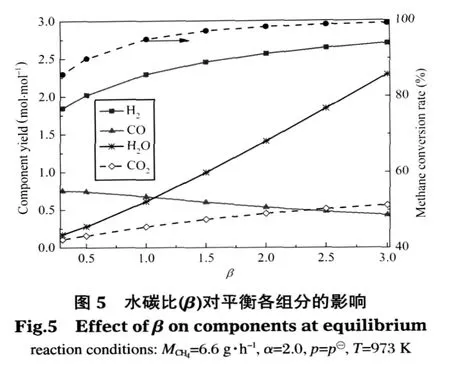
甲烷质量流量、空碳比和反应压力不变(MCH4=6.6 g·h-1,α=2.0,p=p⊖),图 5 考察了 973 K 时水碳比对热力平衡时各组分的影响.如图所示随着水分的增加,H2、H2O、CO2的产量和 CH4的转化率都随之增加,唯独CO的产量随之减小.如水碳比为1.0时,CH4转化率为 95.20%,H2、H2O、CO2和 CO 的产量分别为 2.29、0.61、0.28 和 0.67 mol·mol-1;水碳比为2.0时,CH4转化率为98.40%,其余各项对应的值为2.56、1.41、0.45 和 0.53 mol·mol-1.水碳比从 1.0 增加到 2.0,前四项分别对应增加了 0.27、0.80、0.17 mol·mol-1和 3.20%,而 CO 的产量减少了 0.14 mol·mol-1.这是因为水分的增加推动了反应(3)、(4)式向正方向移动,导致CH4转化率、H2和CO2产量增加,而甲烷在SMR反应中增加的幅度小于CO在反应(4)中转化增加的幅度,如水碳比为1.0时,x和y值对应为0.28和0.11 mol·h-1;水碳比为2.0时,二者对应为0.29和0.19 mol·h-1,水碳比从 1.0变化到2.0,参与SMR反应的甲烷增加了0.01 mol·h-1,对应该反应生成的CO也增加0.01 mol·h-1,而参与WGS反应消耗的CO量增加了0.08 mol·h-1,所以CO的产量表现为减少.
从图5中还可看出,随着水碳比的增加,甲烷转化率和氢气产量增加的幅度都逐渐减少,如水碳比为0.5时,CH4转化率为90.08%,H2的产量为2.02 mol·mol-1;水碳比为1.5时,二者对应的值分别为97.33%和2.45 mol·mol-1.水碳比从0.5增加到1.0,二者分别增加了5.12%和0.29 mol·mol-1;而水碳比从1.0增加到1.5,二者的增加量分别减少到2.13%和 0.16 mol·mol-1.此外,水碳比达 2.5以后,CH4的转化率和H2的产量趋于稳定,二者上升的空间不大.如水碳比为2.5时,CH4转化率为98.96%,H2的产量为2.64 mol·mol-1;水碳比为3.0时,二者对应的值分别为99.30%和2.70 mol·mol-1.水碳比从2.5增加到3.0,二者仅分别增加了0.34%和0.06 mol·mol-1.
在本文甲烷质量流量一定的条件下,微细腔内水碳比选择在1.0-2.5之间比较适宜,既可以满足水蒸气的含量不易过高,又能保持95%以上的甲烷转化率和较高的产氢量.
3.5 有氧与无氧系统的比较
空碳比分别取为2.0和0.0,其他基本参数不变(MCH4=6.6 g·h-1,β=1.0,p=p⊖),考察不同温度下有氧和无氧条件时平衡组分变化的情况,见图1、6、7.从图1和图6对比可知,随着温度的变化两种反应系统平衡时各组分的变化趋势大致相同,即温度越高,CH4的转化率、H2和CO的产量越高;H2O量越少;CO2的产量先增加后减小且均在823 K达最大值.由图7(a)可知,在相同的低温环境中,有氧系统甲烷的转化率和氢气产量都高于无氧系统.这是因为在有氧环境中,氧的存在有利于原料气中甲烷氧化反应的发生,氧化反应本身放出的热量和部分水分的增加大大促进了强吸热SMR反应的进行,而低温条件本身就利于WGS反应的进行,从而有氧条件下甲烷的转化率和氢气产量相对比较高;而无氧环境中甲烷主要通过从外界吸收大量的热和送入的水蒸气重整产生氢气,温度较低时不利于重整反应的进行,所以甲烷转化率和氢气产量较低.
空碳比分别取为2.0和0.0,甲烷质量流量和反应压力不变,考察973 K不同水碳比对有氧和无氧系统平衡时甲烷转化率和氢气产量的影响,见图7(b).可以看出,随着水碳比的增加,有氧系统的甲烷转化率明显高于无氧系统.如水碳比为1.0时,有氧体系甲烷转化率为95.2%,而无氧体系对应的值只有70.40%.
此外,当水碳比较小时(小于1.0),在相同的甲烷质量流量和反应温度条件下,有氧系统比无氧系统相比,氢气量要高得多.如水碳比为0.5时,有氧体系氢气产量为2.02 mol·mol-1,而无氧体系对应的值为1.35 mol·mol-1.这是因为,水碳比小于1.0时,氢气的量主要依赖参与SMR反应中水的量,有氧系统中甲烷氧化反应生成的部分水弥补了SMR反应水分不足的情况,生成的氢气相对较多;而无氧系统单靠外界提供的少量水,甲烷转化量小,生成氢气的量自然小于有氧系统.当水碳比大于1.0时,有氧系统产生氢气的量小于无氧系统对应的量.这是因为此时水蒸气的量相对充足,氢气的产生主要依赖参与SMR反应中甲烷的量,有氧系统中部分氧化消耗了甲烷,使得SMR反应量减少;而无氧系统中,甲烷主要用来与水蒸气发生重整产氢,从反应式(3)、(4)物质前后的摩尔比变化可知,氢气增加的量比有氧系统多,所以无氧系统中氢气的产量逐渐大于有氧系统.
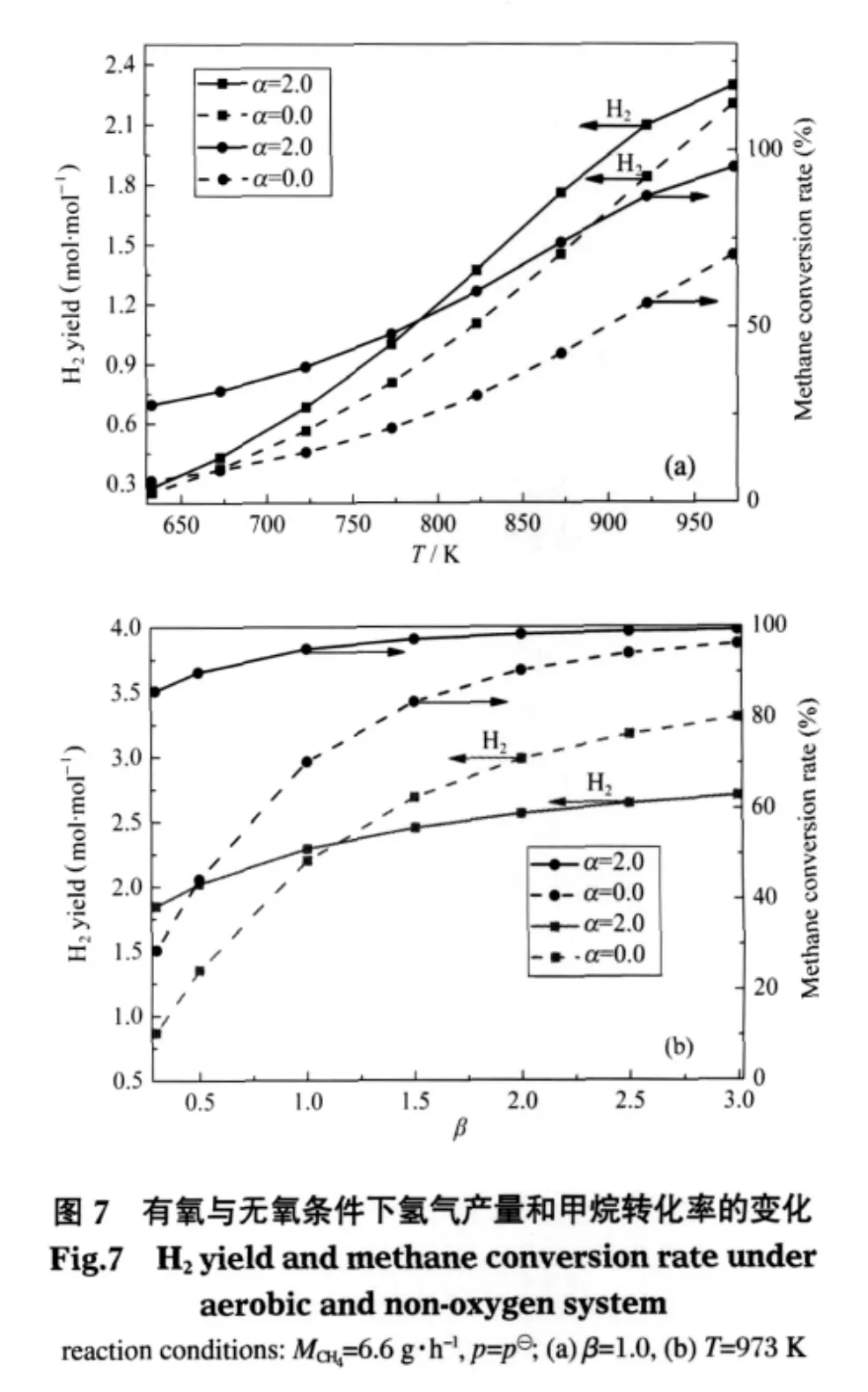
因此,要想在微细腔内实现甲烷自热重整制氢,获得较高的甲烷转化率和氢气量来促进腔内的点火和稳燃,在相同的甲烷质量流量条件下,有氧系统比无氧系统在低温和低水碳比的环境中更具有优势.
4 结 论
(1)温度在633-973 K之间能实现微细腔内甲烷自热重整,各组分在此区间的变化幅度较大,温度超过973 K以后,各组分的体积含量趋于稳定,小于此范围甲烷自热重整不易发生.此范围内能获得高于28%的甲烷转化率和高于0.27 mol·mol-1的氢气产量;并且温度在823 K时,CO2产量最多为0.41 mol·mol-1.
(2)微细腔内压力过高,反应会向体积减小的方向进行,甲烷转化率和氢气产量减少,其余组分变化不大.反应压力应维持在不大于0.10 MPa的条件下,才更有利于633-973 K范围内实现微细腔低温自热重整产氢.
(3)微细腔内随着空碳比的增加,甲烷转化率、H2O和CO2的产量均增加,H2和CO的产量在空碳比为1.0时最大分别为2.36和0.70 mol·mol-1,此后有所减少但变化不明显,而空碳比大于2.0后H2和CO迅速下降.体系中CO2选择率随空碳比增加一直升高,CO则相反,但空碳比较小时,CO的选择率比CO2高得多,空碳比大于4.0以后,CO2的选择率超过CO.为了维持较多的氢气产量和较高甲烷转化率,空气量不应太大.空碳比为2.0时,氢气产量达2.30 mol·mol-1,而甲烷的转化率可达95%以上.
(4)水碳比的增加有利于自热重整产氢及甲烷转化的进行.在一定甲烷质量流量条件下,微细腔内的水碳比选择在1.0-2.5之间比较适宜,既满足水量不易过高,又能保持95%以上的甲烷转化率和较高的氢气产量.
(5)在微细腔的低温环境下,有氧的甲烷自热系统比无氧甲烷重整系统更具有优势.甲烷质量流量一定时,在相同的低水碳比条件下,有氧系统能获得更高的甲烷转化率和氢气产量.
1 Hua,J.S.;Wu,M.;Kumar,K.Chem.Eng.Sci.,2005,60(13):3497
2 Wang,Y.;Chin,Y.H.;Rozmiarek,R.T.;Johnson,B.R.;Gao,Y.;Watson,J.;Tonkovich,A.Y.L.;Vander Wiel,D.P.Catal.Today,2004,98(4):575
3 Ran,J.Y.;Hu,J.H.Proceedings of the Chinese Society for Electrical Engineering,2007,27(8):42 [冉景煜,胡建红.中国电机工程学报,2007,27(8):42]
4 Zhang,L.;Yan,Y.F.Microfabrication Technology,2008,1:49[张 力,闫云飞.微细加工技术,2008,1:49]
5 Tonkovich,A.L.Y.;Yang,B.;Perry,S.T.;Fitzgerald,S.P.;Wang,Y.Catal.Today,2007,120(1):21
6 Dias,J.A.C.;Assaf,J.M.J.Power Sources,2005,139(1/2):176
7 Ayabe,S.;Omoto,H.;Utaka,T.Appl.Catal.A-Gen.,2003,241(1/2):261
8 Chan,S.H.;Ding,O.L.Int.J.Hydrog.Energy,2008,33:633
9 Zhang L.;Yan,Y.F.Journal of Chemical Industry and Engineering(China),2009,60(3):627 [张 力,闫云飞.化工学报,2009,60(3):627]
10 Hu,G.X.;Wang,M.L.;Li,Y.H.Proceedings of the Chinese Society for Electrical Engineering,2004,24(1):201 [胡国新,王明磊,李艳红.中国电机工程学报,2004,24(1):201]
11 Lee,S.H.D.;Applegate,D.V.;Ahmed,S.;Calderone,S.G.;Harvey,T.L.Int.J.Hydrog.Energy,2005,30:829
12 Ahmed,S.;Krumpelt,M.Int.J.Hydrog.Energy,2001,26:291
13 Christensen,T.S.;Primdahl,I.I.Hydrocarbon Process Int.Ed.,1994,5:39
14 Chen,Z.Y.Chemical thermodynamics and refractory compositions.Beijing:Metallurgical Industry Press,2005:162-172 [陈肇友.化学热力学与耐火材料.北京:冶金工业出版社,2005:162-172]
15 Furjes,P.;Bognar,G.;Barsony,I.Sensor Actuat.B-Chem.,2006,120(1):270
16 Ye,D.L.Practical handbook of thermodynamic data of inorganic.Beijing:Metallurgical Industry Press,2002:1-9,228-1183[叶大伦.实用无机物热力学数据手册.北京:冶金工业出版社,2002:1-9,228-1183]
Thermodynamic Analysis of Low Temperature Methane Wet-Air Reforming in a Microcombustor
RAN Jing-Yu*ZHAO Liu-Jie
(College of Thermal Power Engineering,Chongqing University,Chongqing 400044,P.R.China)
O642
Received:April 12,2010;Revised:July 9,2010;Published on Web:September 28,2010.
*Corresponding author.Email:ranjy@cqu.edu.cn;Tel:+86-23-65103114.
The project was supported by the National Natural Science Foundation of China(50876118)and New Century Excellent Talent Project of Ministry of Education,China(NCET-08-0605).
国家自然科学基金(50876118)和教育部新世纪优秀人才计划(NCET-08-0605)资助项目
