红薯叶多糖的分离纯化及其结构鉴定
2010-09-29张体祥于立芹李亚萍
刘 捷,张体祥,于立芹,卢 奎,李亚萍
(河南工业大学化学与化工学院,河南郑州 450001)
红薯叶多糖的分离纯化及其结构鉴定
刘 捷,张体祥,于立芹,卢 奎,李亚萍
(河南工业大学化学与化工学院,河南郑州 450001)
研究从红薯叶中提取的水溶性多糖的分离、纯化,单糖组成和结构,为红薯叶的开发利用提供参考.通过正丁醇 -三氯乙酸 (体积比为 20︰1)除蛋白、透析法除小分子杂质后,经 Sephadex G-100葡聚糖凝胶柱分离得到了精制多糖 I BL(I).通过凝胶过滤法、薄层层析 (TLC)、气相色谱 (GC)、紫外光谱(UV)、红外光谱 (I R)等分析手段初步确定了其组成和结构.红薯叶多糖 I BL(I)为均一组分,相对分子质量为 2.63×104,其单糖组成为木糖、甘露糖、葡萄糖,其物质的量的比为 0.47︰0.35︰0.18.I BL(I)具有典型的多糖特征吸收峰,其结构中存在β型糖苷键.
红薯叶;多糖;分离纯化;单糖组成;结构
0 引言
红薯 (Ipomoea batatas Lam),又称甘薯、番薯、山芋等,其产量仅次于水稻、小麦、玉米.红薯叶多糖是其主要功能性成分[1],研究表明红薯叶多糖具有抗肿瘤[2]、提升血小板[3]、抗突变[4]等生物活性.目前,红薯叶多糖的提取采用水提醇沉法,提取的粗多糖黏度大且不稳定,多糖的种类和结构也不明确,这给红薯叶多糖的开发利用带来了困难.
红薯叶多糖的提取和含量测定已有报道[5],但是关于红薯叶多糖的纯化和多糖的组成分析尚未见文献报道.鉴于此,笔者利用 Sephadex柱色谱等方法对红薯叶粗多糖进行了纯化分离,并结合薄层色谱、气相色谱、UV、IR等分离分析技术对其组成结构及理化性质进行了研究.
1 材料与方法
1.1 原料
红薯叶:采集于山东聊城市郊区,晾干粉碎成粉末,储存冰箱.红薯叶粗多糖由本实验室提取[6].
1.2 试剂
葡萄糖、半乳糖、甘露糖、阿拉伯糖、木糖、果糖:上海市国药集团化学试剂有限公司;T500、T70、T40、T10葡聚糖标准品:瑞典 Phar macia公司;葡聚糖凝胶 (Sephadex G-100;Sephadex G-200):美国 Sigma公司;透析袋:Sigma公司;其他试剂均为国产分析纯.
1.3 仪器
微型高速万能试样粉碎机:北京市永光明医疗仪器厂;RE—52c型旋转蒸发仪:上海亚荣生化仪器厂;SZ—93自动双重纯水蒸馏器:上海亚荣生化仪器厂;BSZ—100自动部分收集器:上海青浦沪西仪器厂;SHA—B恒温水浴振荡器:江苏常州国华电器厂;真空冷冻干燥机:北京四环科学仪器厂;凝胶分离柱:上海亚荣生化仪器厂;BL—3205电子天平 (精度 ≥0.000 1g):日本岛津公司;Prestige—21型傅立叶变换红外光谱仪:日本岛津公司;UV—2450紫外 -可见分光光度计:北京普析通用仪器有限责任公司;GC—9790气相色谱仪:浙江温岭福立分析仪器有限公司;SE—54毛细管柱 (0.5μm×0.25 mm ×15 m):中国科学院兰州化物所.
1.4 方法
1.4.1 红薯叶多糖的分离纯化
将提取的红薯叶粗多糖经正丁醇 -三氯乙酸(20︰1)脱蛋白、透析法除去小分子杂质.取 5.0 mg脱蛋白多糖,用 1 mL蒸馏水溶解后,入 Sephadex G-100葡聚糖凝胶柱,用 0.1 mol/L的 NaCl进行洗脱,流速为 1 mL/min,洗脱液由分部收集器进行收集,每管 5 mL,用苯酚 -硫酸法跟踪检测,分别合并出峰的流出液,减压浓缩至一定体积,醇沉、过滤、干燥,即得精制多糖.
1.4.2 多糖的纯度鉴定
将 Sephadex G-100装柱,用 0.05 mol/L的NaCl平衡 1 d.然后将纯化、分离后的精制红薯叶多糖用少量平衡液溶解,上样.用 0.05 mol/L的NaCl缓冲液以 20 mL/h流速进行洗脱,按 4 mL体积分部收集,用苯酚 -硫酸法跟踪检测.若形状为对称的单一峰,则表示为均一组分.
1.4.3 多糖相对分子质量的测定[7]
用 SephadexG-200装柱 ,用 0.1 mol/L NaCl溶液按恒定流速 (20 mL/h)平衡 24 h.将葡聚糖标准品 (T500、T70、T40、T10)和蓝色葡聚糖分别相继上 Sephadex G-200层析柱,洗脱条件同平衡时的条件,收集及检测与多糖的纯度鉴定方法相同 ,分别测得洗脱体积 V1、V2、V3、V4,蓝色葡聚糖所测为柱床的洗脱体积 Ve,按 Vt/Ve与相对分子质量对数关系作图,应为一直线关系.
根据以上步骤得出红薯叶多糖的洗脱体积V样,计算 V样/Ve值,查标准曲线计算出红薯叶多糖相对分子质量M.
1.4.4 紫外 -可见光谱分析
配制 10%精制红薯叶多糖水溶液,以蒸馏水为空白,在 200~800 nm范围内扫描.
1.4.5 红外光谱分析
称取 3 mg干燥的红薯叶多糖,与 200 mg KBr粉末于红外灯下在玛瑙钵中轻轻研磨均匀,KBr压片后直接上样.在 4 000~400 cm-1范围内扫描.
1.4.6 单糖组成分析
1.4.6.1 多糖的水解
将纯化分离后的红薯叶多糖溶于 2 mL 2 mol/L硫酸中,封管于沸水浴中水解 6 h,水解液离心,在上层清液中加入BaCO3(s)中和过量的硫酸,再将离心得到的上层清液浓缩至适当浓度后,进行硅胶 G薄板层析.
1.4.6.2 多糖糖腈乙酸酯衍生化[8]
称取多糖 10 mg,加入 2 moL/L三氟乙酸 5 mL,100℃密闭水解 6 h.水解液于 50℃减压蒸发至干,在 60℃的烘箱中干燥至干.然后加入 10 mg盐酸羟胺和 0.5 mL吡啶,放入 90℃水浴加热反应 30 min,并不断振荡.取出后冷至室温,加入0.5 mL醋酸酐,在 90℃水浴中继续反应 30 min进行乙酰化,反应产物可直接进行气相色谱分析.
1.4.6.3 TLC条件
以乙酸乙酯 -异丙醇 -水 (体积比为 26︰14︰7)为展开剂,以单糖标准品为对照点样,苯胺 -二苯胺显色(85℃加热 10 min).
1.4.6.4 GC分析
SE—54色谱柱:0.5μm ×0.25 mm ×15 m.检测器:FI D.空气流量:300 mL/min;氢气流量:30 mL/min.程序升温:150℃下保持 4 min,然后以10℃/min升至 160℃,保持 8 min,再以 5℃/min升至 180℃,保持 2 min,再以 20℃/min升至250℃,保持 5 min.进样口温度:250℃;检测器温度:240℃;载气压力:0.06 MPa.将样品图谱与标准单糖图谱对照,确定红薯叶多糖的单糖组分.
1.4.7 理化性质
碘 -碘化钾反应:将精制红薯叶多糖样品制成 1 mg/mL溶液,取 1 mL加入碘 -碘化钾溶液,观察颜色变化.
茚三酮反应:取 1 mg/mL的精制红薯叶多糖溶液 1 mL,加入 0.5 mL 0.1%茚三酮乙醇溶液,混匀,煮沸 1~2 min,冷却,观察颜色变化.
Molish反应:取 1 mL浓度为 1 mg/mL的精制红薯叶多糖溶液,加入 2滴Molish试剂即 10%α-萘酚的乙醇溶液,混合均匀后将试管倾斜 45°,沿试管壁慢慢加入 1 mL浓硫酸 (勿摇动),竖立试管,观察浓硫酸和糖交界面颜色的变化.
2 结果与分析
2.1 不同方法脱蛋白效果的比较
本试验对 Sevag法、三氯乙酸法、HCl法、正丁醇 -三氯乙酸法 4种常规除蛋白方法进行了比较,结果见表1.
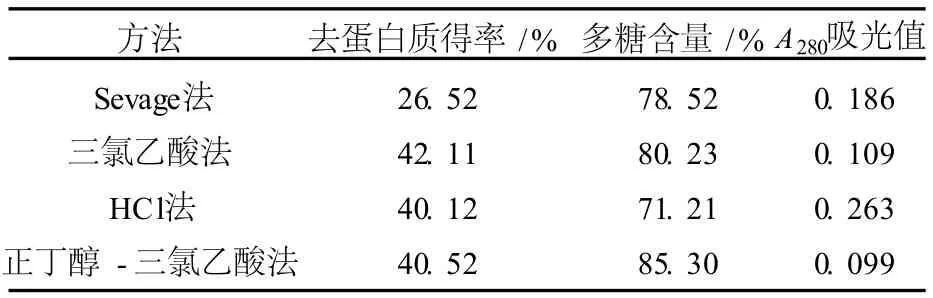
表1 几种去蛋白方法的比较
在 4种除蛋白的方法中,正丁醇 -三氯乙酸(体积比为 20︰1)法得到的多糖在 A280处吸光值最小,多糖含量为 85.30%.因此,选用正丁醇 -三氯乙酸法作为去蛋白的方法.
2.2 红薯叶多糖的柱色谱分离(图 1)
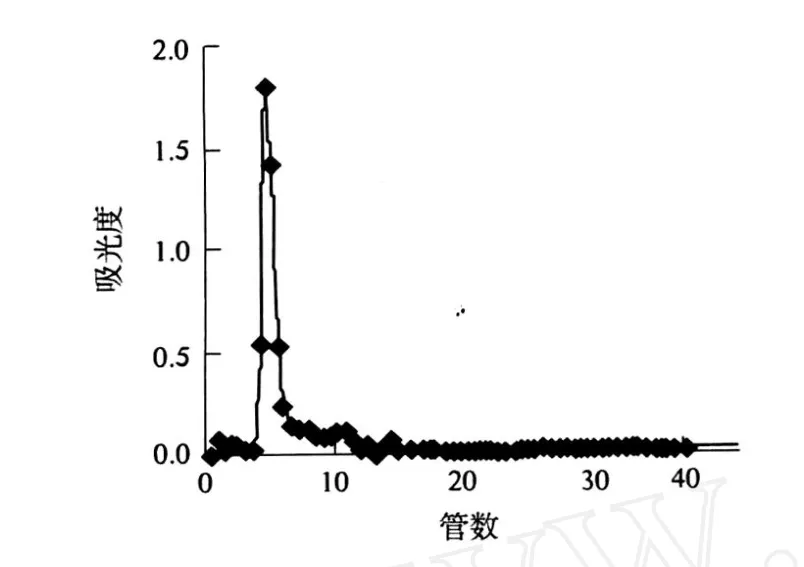
图1 红薯叶多糖在 Sephadex G-100的流出曲线
从图 1可以看到,红薯叶多糖样品经 Sephadex G-100柱层析洗脱,只有一个峰.收集第 9管的流出液,减压浓缩至一定体积,醇沉、过滤、干燥,即得精制多糖,命名为 I BL(I).说明经过Sephadex G-100葡聚糖凝胶柱,可以分离得到一种红薯叶多糖.
分离纯化后的红薯叶多糖 I BL(I)为灰白色粉末,溶于水,不溶于乙醇、丙酮、乙醚、氯仿等有机溶剂.理化性质测定显示:苯酚 -硫酸反应呈阳性,碘 -碘化钾反应、茚三酮反应均呈阴性,说明样品中不含淀粉、氨基酸和蛋白质;Molish反应均呈阳性,说明样品是非淀粉糖.因此,红薯叶多糖经分离纯化后,纯度高,属于水溶性中性多糖.
2.3 纯度鉴定和相对分子质量的测定结果(图 2)
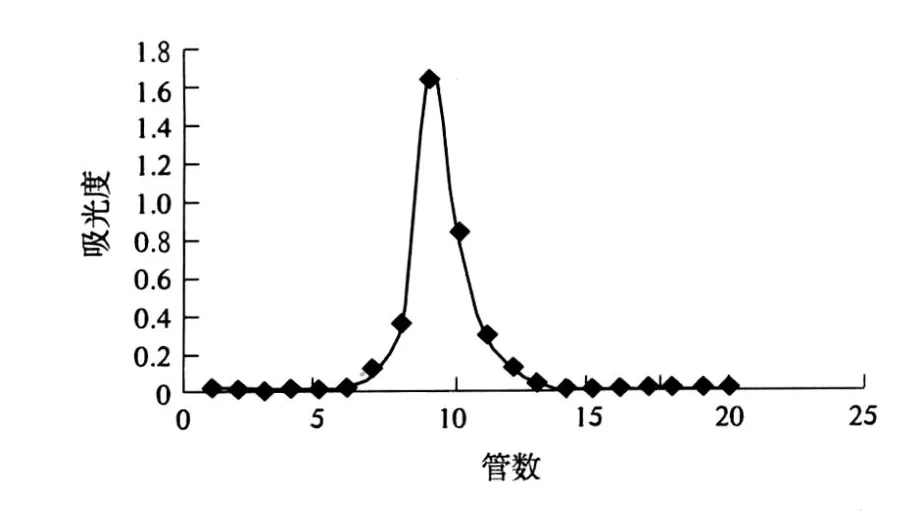
图2 红薯叶多糖在 Sephadex G-100的柱层析图
从图 2可以看到,Sephadex G-100柱层析图中出现单一峰,且峰形对称,说明精制多糖 I BL(I)为均一组分.
由标准葡聚糖的相对分子质量对数和洗脱体积求得标准曲线的回归方程为 Y=7.218 7-1.441 5X,R2=0.992 9,样品的洗脱体积为 59.20 mL,Vt/Ve=1.94,由此计算 I BL(I)的相对分子质量为 2.63×104.相对分子质量的测定结果见图3.
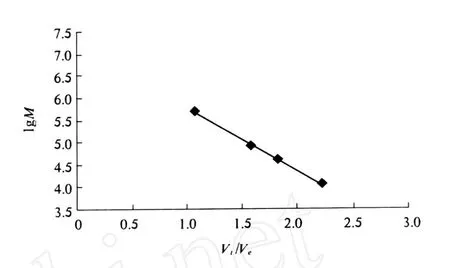
图3 标准相对分子质量葡聚糖的标准曲线
2.4 红薯叶多糖 IBL(I)的单糖组成分析
2.4.1 薄层层析
分离纯化后,红薯叶多糖 I BL(I)经水解,进行薄层层析,结果见图 4.

图4 薄层层析图
由图 4可以看出,多糖水解液的 Rf值和葡萄糖、木糖、甘露糖、半乳糖的 Rf值接近,未能完全分开,但可以初步认为红薯叶多糖 I BL(I)的单糖组成可能由这 4种糖组成.其单糖确切组成由 GC进一步分析验证.
2.4.2 GC分析
标准单糖混合物水解的衍生物和多糖 I BL(I)水解衍生物的气相色谱图如图 5、图 6所示,气相色谱保留时间数据见表2.根据标准品和样品的保留时间确定单糖种类,各峰面积比计算物质的量比.结果表明 I BL(I)的单糖组成为木糖、甘露糖、葡萄糖,其物质的量的比为 0.47︰0.35︰0.18.
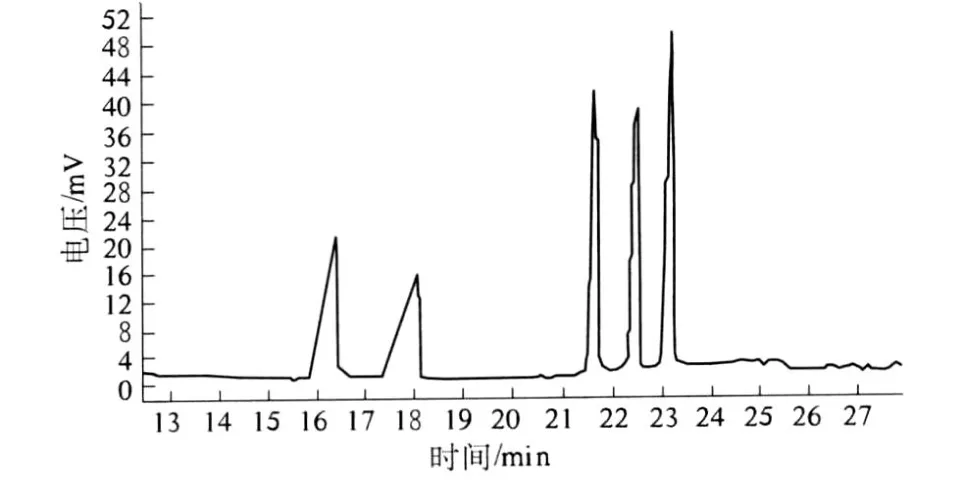
图5 标准单糖混合衍生物气相色谱图
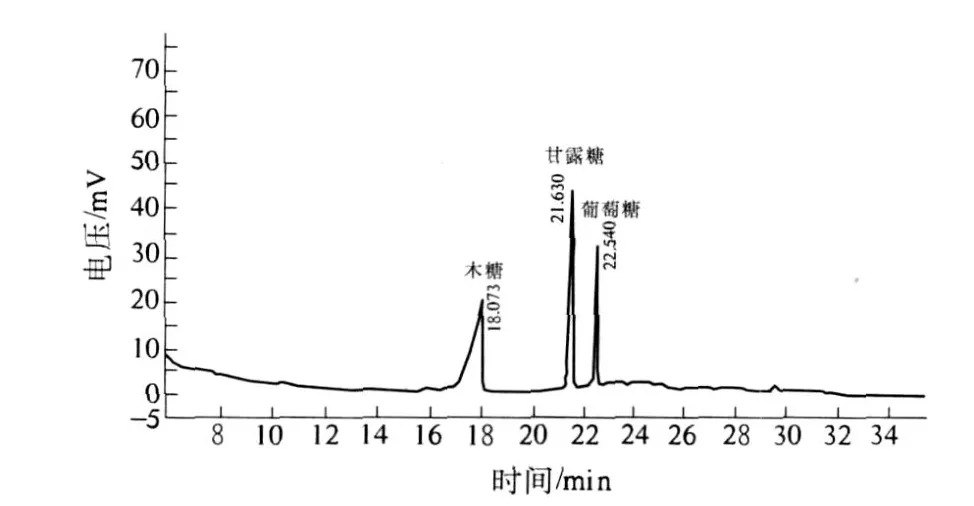
图6 红薯叶多糖衍生物气相色谱图
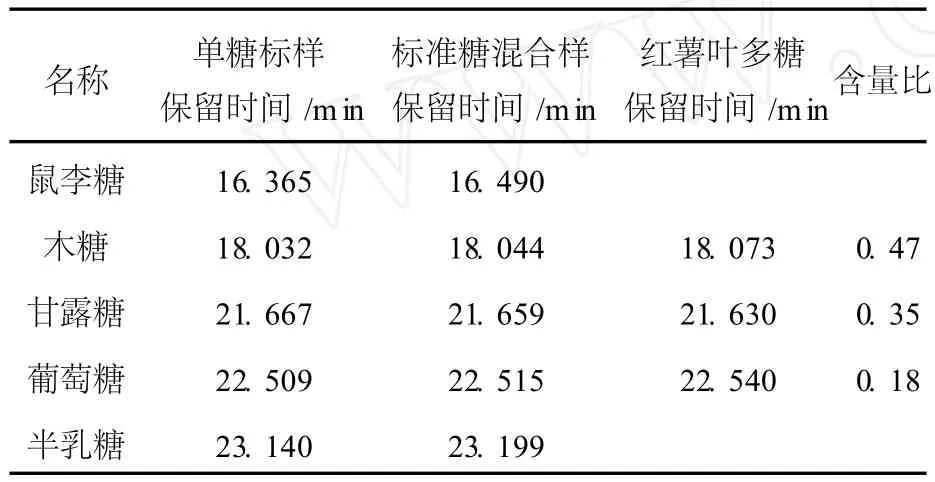
表2 标准糖与红薯叶多糖水解衍生物的保留时间
2.5 光谱分析结果
紫外光谱图显示在 260 nm和 280 nm处无吸收,表明 I BL(I)不含核酸、多肽和蛋白质.I BL(I)的红外光谱具有多糖典型的特征吸收峰[7],各吸收峰的归属如表3所示.
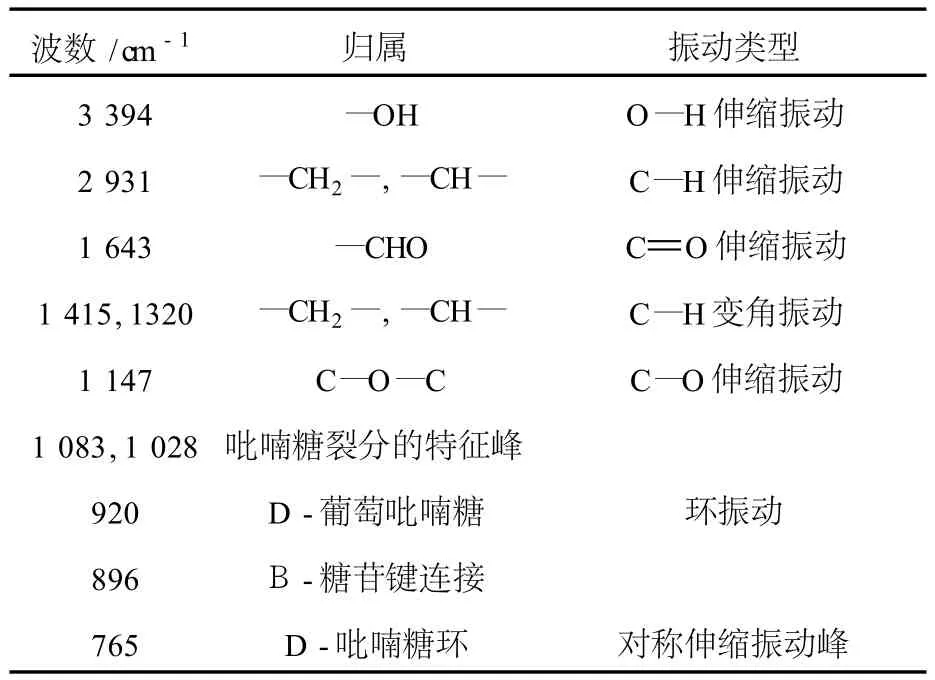
表3 I BL(I)的红外光谱数据
从表3可以看到,红薯叶多糖 I BL(I)为吡喃糖,896 cm-1是β-糖苷键的特征吸收峰,在 840 cm-1处没有吸收峰可以确定不含有α-糖苷键[9].920 cm-1是 D-葡萄糖的振动吸收峰,765 cm-1的吸收峰表明存在甘露糖苷,这与前面的成分分析的结果一致.因此,通过 IR光谱可以确定从红薯叶中提取的水溶性多糖 I BL(I)属于β-吡喃糖化合物.
3 讨论
采用水煮醇沉法提取的红薯叶多糖经正丁醇-三氯乙酸脱蛋白、有机溶剂脱色、透析除小分子化合物,Sephadex G-100葡聚糖凝胶柱色谱等技术进行纯化分离得到精制红薯叶多糖 I BL(I),葡聚糖凝胶柱分析为均一组分.凝胶过滤法测定红薯叶多糖的相对分子质量为 2.63×104.利用薄层层析和气相色谱确定 I BL(I)的单糖组成为木糖、甘露糖和葡萄糖,其物质的量的比为 0.47︰0.35︰0.18.紫外光谱表明 I BL(I)不含核酸和蛋白质,红外光谱分析显示 I BL(I)具有典型的多糖的特征吸收峰,属于β-吡喃糖化合物.
红薯叶多糖经过 Sephadex G-100就可以分离出中性水溶性多糖组分 I BL(I).红薯叶多糖的黏性比较大,过 Sephadex G-100葡聚糖凝胶柱的上样量不宜大.
多糖水解的难易与单糖组成、水解试剂、水解温度等因素有关.在气相色谱分析中,需要将糖转化为其衍生物.乙酰衍生物容易汽化,可以提高仪器的分辨率和精确度.在薄层色谱分析中,以 2 mol/L硫酸水解,BaCO3(s)中和,水解条件最好,斑点完整清晰.
多糖是生物大分子,结构分为一级、二级、三级和四级结构,其生物活性与其相对分子质量、黏度、糖链结构密切相关.本试验对精制的红薯叶多糖仅进行了初步的结构分析,糖的绝对构型、连接方式、多糖的结构与药效的关系等问题,还有待进一步的深入研究.
[1] 王宪昌,呼晓姝,王建中,等.甘薯茎蔓多糖提取技术研究[J].河北农业大学学报,2005,28(2):51-54.
[2] 李松,吴青华,陈畅,等.多糖抗肿瘤活性的最新研究进展 [J].中国生化药物杂志,2007,28(3):213-215.
[3] 黎盛蓉,林平尔.西蒙Ⅰ号治疗血小板减少症50例近期疗效观察[J].临床血液学杂志,1992,5(1):8-10.
[4] 林金源.甘薯叶水萃取物之抗突变性[J].食品科学 (台湾),1993(3):301-310.
[5] 彭珊珊,龙洁梅,苏丽莹.番石榴叶、番薯叶中多糖的提取和测定 [J].食品科技,2006(6):106-108.
[6] 于立芹,刘捷,卢奎,等.红薯叶多糖提取工艺的优化[J].河南工业大学学报:自然科学版,2008,29(1):37-42.
[7] Yu R,Wang L,Zhang H,et al. Isolation,purification and identification of polysaccharides from cultured Cordyceps militaris[J].Fitoterapia,2004,75(7/8):662-666.
[8] Pitkanen E.Mannose,mannitol,fructose and 1,5-anhydroglucitol concentrations measured by gas chromatography/mass spectrometry in blood plasma of diabetic patients[J].Clinica Chimica Acta,1996,251:91-103.
[9] 夏朝红,戴齐,房韦,等.几种多糖的红外光谱研究 [J].武汉理工大学学报,2007,29(1):45-47.
SEPARATI ON,PUR IFICATI ON AND STRUCTURAL I DENTIFICATI ON OF POLYSACCHAR I DE FROMIPOMOEA BATATAS LAMLEAVES
L I U Jie,ZHANG Ti-xiang,YU Li-qin,LU Kui,L I Ya-ping
(School of Chem istry and Chem ical Engineering,Henan University of Technology,Zhengzhou450001,China)
We studied the separation,purification,monosaccharide composition and structure of water-soluble polysaccharides extracted fromIpom oea batatas Lamleaves so as to provide reference for the development of Ipom oea batatas Lamleaves.The method comprised the following steps:removing proteins by usingn-butanol and trichloroacetic acid with the volume ratio of 20︰1;removing small-molecule i mpurities by dialysis;separating refined polysaccharide I BL(I)by Sephadex G-100 gel column chromatography;and deter mining the composition and the structure of the polysaccharide I BL(I)by gel filtration,thin-layer chromatography,gas chromatography,ultraviolet spectroscopy,infrared spectroscopy and so on.The results show that the polysaccharide I BL(I)has a homogeneous componentwith the relative molecularweight of 2.63×104,and contains xylose,glucose and mannose with the molar ratio of 0.47︰0.35︰0.18;and polysaccharide I BL(I)has a typical characteristic absorption peak,which identifies that the polysaccharide I BL(I)contains aβ-glucosidal bond.
Ipom oea batatas Lamleaf;polysaccharide;separation and purification;monosaccharide composition;structure
TS201.2
B
1673-2383(2010)05-0046-05
2010-04-20
河南工业大学博士科研基金项目;河南省重大科技攻关项目(0422031200)
刘捷 (1970-),女,河北雄县人,博士,副教授,研究方向为天然产物化学.
