山竹多酚的分离制备及清除自由基活性研究
2010-09-29熊何健吴国宏王莉芳乔小瑞
熊何健,吴国宏,王莉芳,乔小瑞
(集美大学生物工程学院,福建厦门 361021)
山竹多酚的分离制备及清除自由基活性研究
熊何健,吴国宏,王莉芳,乔小瑞
(集美大学生物工程学院,福建厦门 361021)
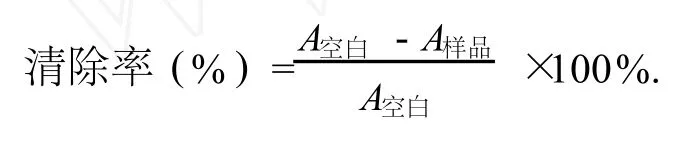
通过响应面法试验设计,优化山竹外果皮中多酚类物质的提取工艺,并对其清除自由基活性进行了研究.多酚浸提的最佳工艺参数为:乙醇溶液体积分数 60%、液料比18︰1、浸提时间 66 min,在此条件下,多酚浸出率为 11.38%.提取液经 XDA—7大孔树脂柱层析纯化,得山竹多酚,样品多酚含量为 87.19%,其清除 DPPH、羟基自由、超氧阴离子自由基 IC50值分别为:4.67 mg/L、41.4 mg/L和 27.0 mg/L.
山竹;多酚;制备;自由基
0 引言
山竹 (Garcinia m angostanaL)又名山竹子、莽吉柿、凤果,为藤黄科藤黄属的一种种间杂交的异源多倍体果树,原产于马来群岛,是一种典型的热带水果[1],主要分布于泰国、越南、马来西亚、印度尼西亚、菲律宾等东南亚国家,我国台湾、福建、广东和云南也有引种[2].山竹果实可食部分占29%~45%,含有蛋白质、脂肪、多种维生素及丰富的矿物质元素,其中柠檬酸含量 0.63%、维生素 C为 12 mg/kg、可溶性固形物 16.8%,有机酸0.63%[1].山竹外果皮呈黑紫红色,切片晒干后可作药用,一直作为泰国传统医药,用于腹痛、腹泻、痢疾、感染性创伤、化脓、慢性溃疡、白带、淋病等疾病的治疗[3].
山竹前期研究多集中在山竹的栽培[4-5]、营养成分、无机元素、风味成分的分析[3,6]及山竹果壳中红色素的利用等方面[7,8].近年来的研究表明,占单果鲜重 52%~68%的山竹外果皮中,含有氧杂蒽酮、单宁酸和原花青素等一系列多酚类化合物,具有抗氧化、抑制肿瘤等诸多生理活性[9-11],有较高的开发利用价值.作者以山竹外果皮为原料,多酚为目标组分,通过单因素试验和响应面分析法等建立山竹外果皮中多酚类物质的分离制备工艺,并对其清除自由基活性进行检测,为山竹多酚的工业化生产与应用提供依据.
1 材料与方法
1.1 材料和试剂
山竹:购于厦门集美,收集外果皮,干燥,0℃以下储藏备用.
没食子酸、DPPH、福林-酚试剂:sigma公司;羟自由基、超氧阴离子自由基检测试剂盒:南京建成生物工程研究所;XDA—7大孔树脂:西安蓝晓科技有限公司;其他试剂均为分析纯.
1.2 方法
1.2.1 工艺流程
山竹外果皮→粉碎→溶剂浸提→浸提液真空浓缩→浓缩液→树脂吸附→有机溶液洗脱→洗脱液真空浓缩→冷冻干燥→山竹多酚.
1.2.2 提取条件的选择
干燥山竹外果皮粉碎,过 40目筛.各取 2.00 g山竹皮粉末,乙醇溶液超声波浸提,超声频率 40 kHz,超声功率 100 W收集浸提液,测定浸提液中多酚含量,计算多酚浸出率,比较不同浸提条件对多酚浸出效果的影响.

1.2.3 大孔吸附树脂纯化
山竹外果皮粉末经溶剂浸提后,浸提液真空浓缩回收溶剂,浓缩液上 XDA—7大孔树脂柱(200 mm ×28 mm)吸附,吸附速率 2 BV/h,吸附完成后用 2 BV蒸馏水洗脱,然后用 60%乙醇溶液常温洗脱,洗脱速率 4 BV/h,收集洗脱液,真空浓缩,冷冻干燥.
1.2.4 多酚含量的测定[12]
福林 -酚试剂分光光度法,样品中多酚含量以没食子酸计.以没食子酸质量浓度为横坐标,吸光度值为纵坐标,绘制标准曲线,所得回归方程为:Y=0.009 4X+0.003 7(R2=0.999 7).
1.2.5 样品清除自由基活性测定
清除 DPPH活性:分光光度法[13].
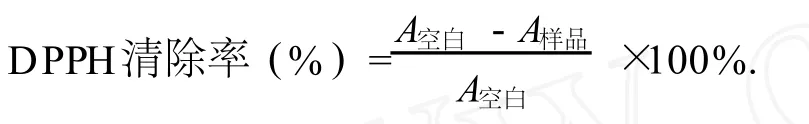
清除O2-·、·OH自由基活性:按照检测试剂盒检测方法测定.
2 结果与分析
2.1 浸提液体积分数对多酚浸出率的影响
分别用 0、20%、40%、60%、80%乙醇溶液作为浸提液超声浸提山竹外果皮,分析浸提液体积分数对多酚浸出率的影响,结果见图 1.
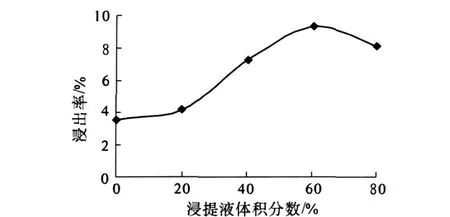
图1 浸提液体积分数对多酚浸出率的影响
由图 1可知,随着乙醇体积分数的增加多酚提取率不断提高,当乙醇体积分数达到 60%左右时提取率达到最大值,浸提液体积分数进一步提高,多酚提取率反而降低,这与山竹外果皮中多酚类物质的构成与极性有关.
2.2 浸提时间对多酚浸出率的影响
分别采用不同浸提时间 (30 min、45 min、60 min、75 min、90 min)对原料进行超声波浸提处理,分析浸提时间对山竹壳多酚提取率的影响,结果见图 2.
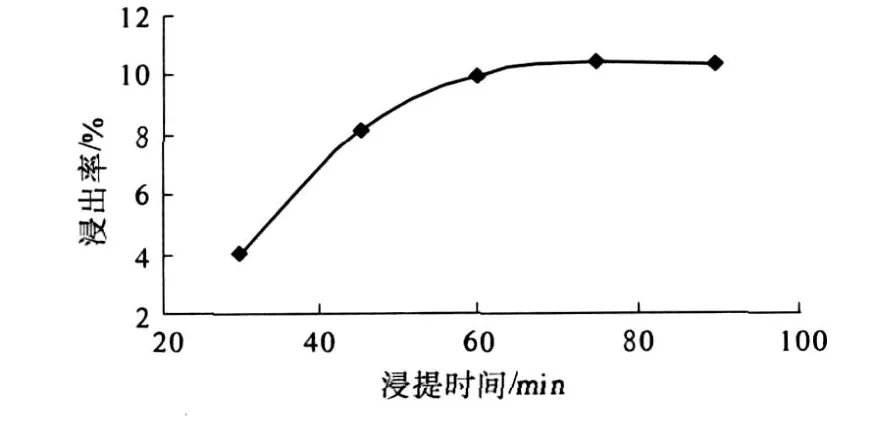
图2 浸提时间对山竹壳多酚浸出率的影响
由图 2可知,60 min时多酚类物质基本达到浸出平衡,继续延长时间,多酚浸出率增加缓慢,同时,浸提时间过长,山竹壳中的杂质成分溶解也随之增加,将会影响多酚的纯化.
2.3 液料比对多酚浸出率的影响
分别采用液料比 9︰1、12︰1、15︰1、18︰1、21︰1、24︰1对原料进行超声波浸提处理,分析浸提液料比对山竹壳多酚提取率的影响,结果见图 3.
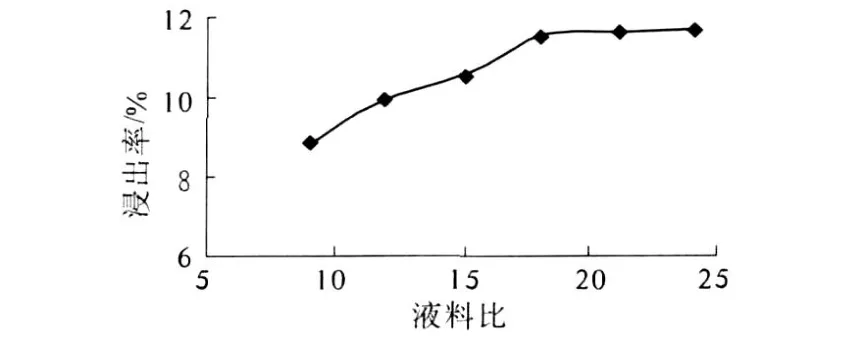
图3 液料比对多酚浸出率的影响
由图 3可知,液料比达到 18︰1时,原料中的多酚物质已基本溶出,继续增加溶剂的用量,浸出率趋于稳定,生产中过大的料液比也会造成后续浓缩时能耗增加和溶剂的浪费.
2.4 浸提条件的响应面法优化
在单因素试验的基础上,采用响应面分析法(Response Surface Analysis,简称 RSA),并根据Box-Benhnken中心组合原理,设计 3因素 3水平的响应面分析试验,对浸提条件进行优化.
2.4.1 分析因素的选取以及响应面试验结果
以液料比 X1(15︰1、18︰1、21︰1)、浸提时间X2(45 min、60 min、75 min)和浸提液体积分数 X3(50%、60%、70%)3个因素为自变量,以多酚浸出率 Y为响应值进行试验,试验结果见表1.
2.4.2 试验模型的建立和最优化分析
利用 Design Expert 7.0软件对表1试验数据进行多元回归拟合,获得响应值多酚浸出率 Y对自变量液料比 X1、浸提时间 X2和浸提液体积分数 X3的二次多项回归模型方程为:
Y= -19.67+1.9933X1+0.25533X2+0.15950X3-5.6111E-003X1X2+3.9167E-003 X1X3+5.5E-004X2X3-0.0507X21-1.4056E-003X22-2.31250E-003X23.
回归方程中各变量对响应值影响的显著性由F检验判定,P值越小,则相应变量的显著程度越高,回归分析结果列于表2.
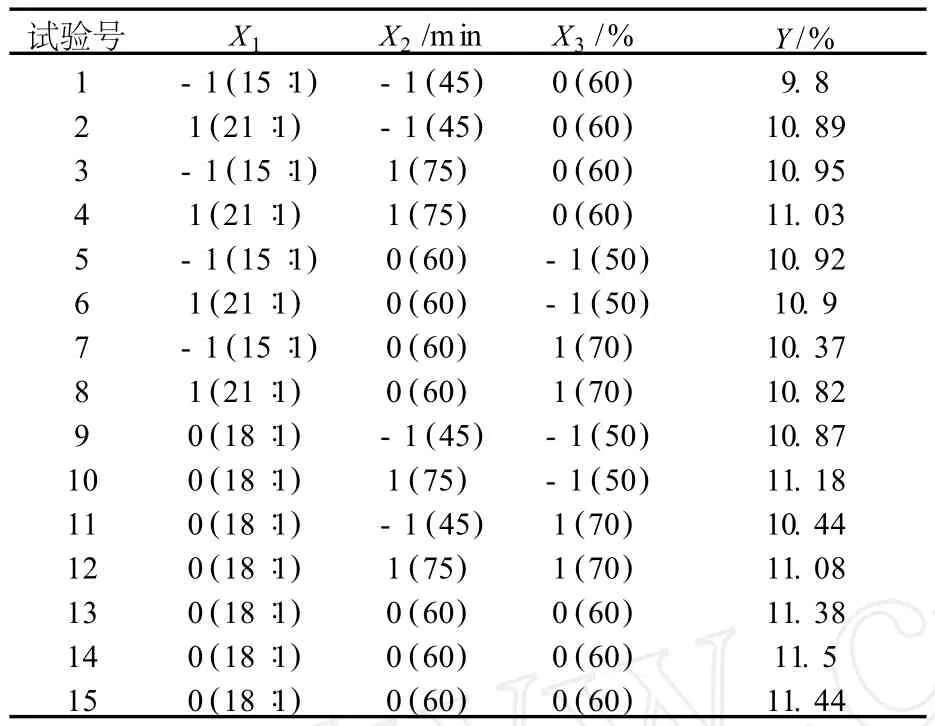
表1 响应面分析试验结果
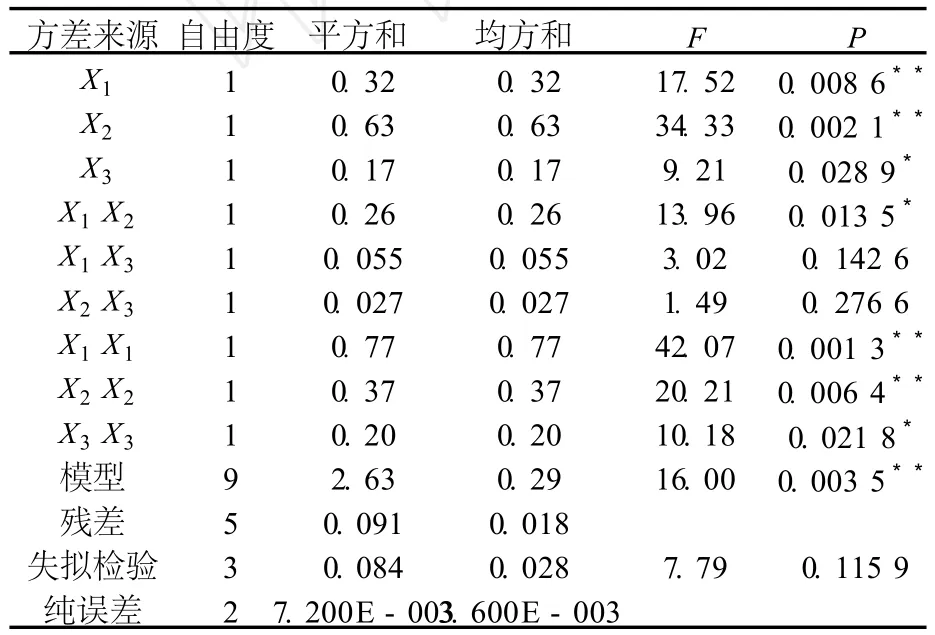
表2 回归模型方差分析表
由表2可知,3个试验因子中对响应值影响的主次顺序为 X2>X1>X3,即浸提时间 >液料比 >浸提液浓度,对响应值的影响达到极显著水平,X3、X1X2、X23对响应值的影响也达到显著水平,表明试验因子对响应值不是简单的线性关系,二次项和交互项对响应值都有很大关系.
模型 P=0.003 5,表明该二次多项回归模型高度显著.失拟检验 P=0.115 9>0.05,不显著,无失拟因素存在,模型充分拟合试验数据,R2=0.966 4,说明预测值和实测值之间具有高度的相关性,因此可用此模型对试验进行分析和预测.
响应指标对应于因素 X1、X2、X3水平构成的一个三维空间图,可以直观地反映各因素对响应值的影响,从因素交互作用的等高线及响应面图(图 4、图 5、图 6)可以分析出它们之间的相互作用.由图 4~图 6可知,在所选范围内存在极值.运用 SAS软件确定模型因素的最佳水平,理论最优条件为乙醇体积分数 57.76%,液料比18.26︰1,浸提时间 65.69 min,模型预测的最大浸出率11.52%.考虑实际操作的局限性,将理论值修正为乙醇体积分数 60%,液料比 18︰1,浸提时间66 min,在此条件下进行浸提试验,多酚浸出率为 11.38% ±0.05%(n=3),与理论值的误差为1.48%,表明模型能较好地预测实际浸出率.
利用响应面优化得到的最佳浸提条件浸提山竹外果皮原料,浸提液浓缩,经 XDA-7大孔吸附树脂纯化,洗脱液浓缩、冻干,得山竹多酚,多酚含量为87.19%.
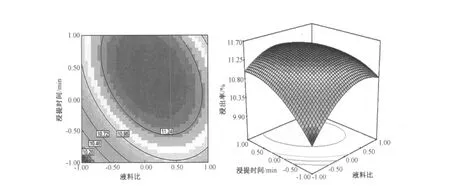
图4 液料比和浸提时间对多酚浸出率影响的等高线图和响应面图(X3=60%)

2.5 山竹多酚清除自由基活性
1,1-二苯基 -2-三硝基苯肼 (DPPH)是一种稳定的以氮为中心的脂质自由基,DPPH清除活性通常作为天然抗氧化剂初期筛选的检测指标[14-15].超氧阴离子自由基 (·)、羟自由基(·OH)是生物体内两种重要的氧自由基,·是多种自由基中间体的母体,·OH的氧化活性极强,能与活细胞中任何生物大分子发生反应,引起脂质过氧化、DNA损失和多糖的降解等,对机体危害极大,对·和·OH的清除能力是抗氧化物质活性检测的重要指标[16-18].
配制一定浓度经柱层析纯化的山竹果皮多酚样品的水溶液,检测其清除 DPPH、羟自由基和超氧阴离子自由基活性,结果见图 7、图 8和图 9.
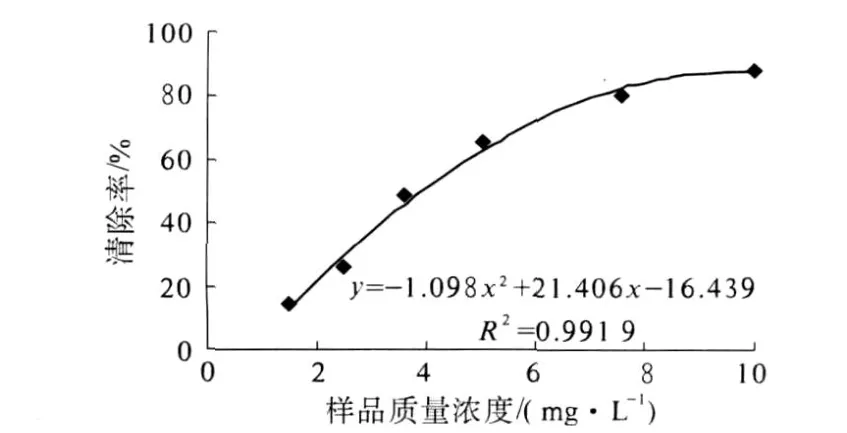
图7 山竹多酚清除 DPPH自由基活性
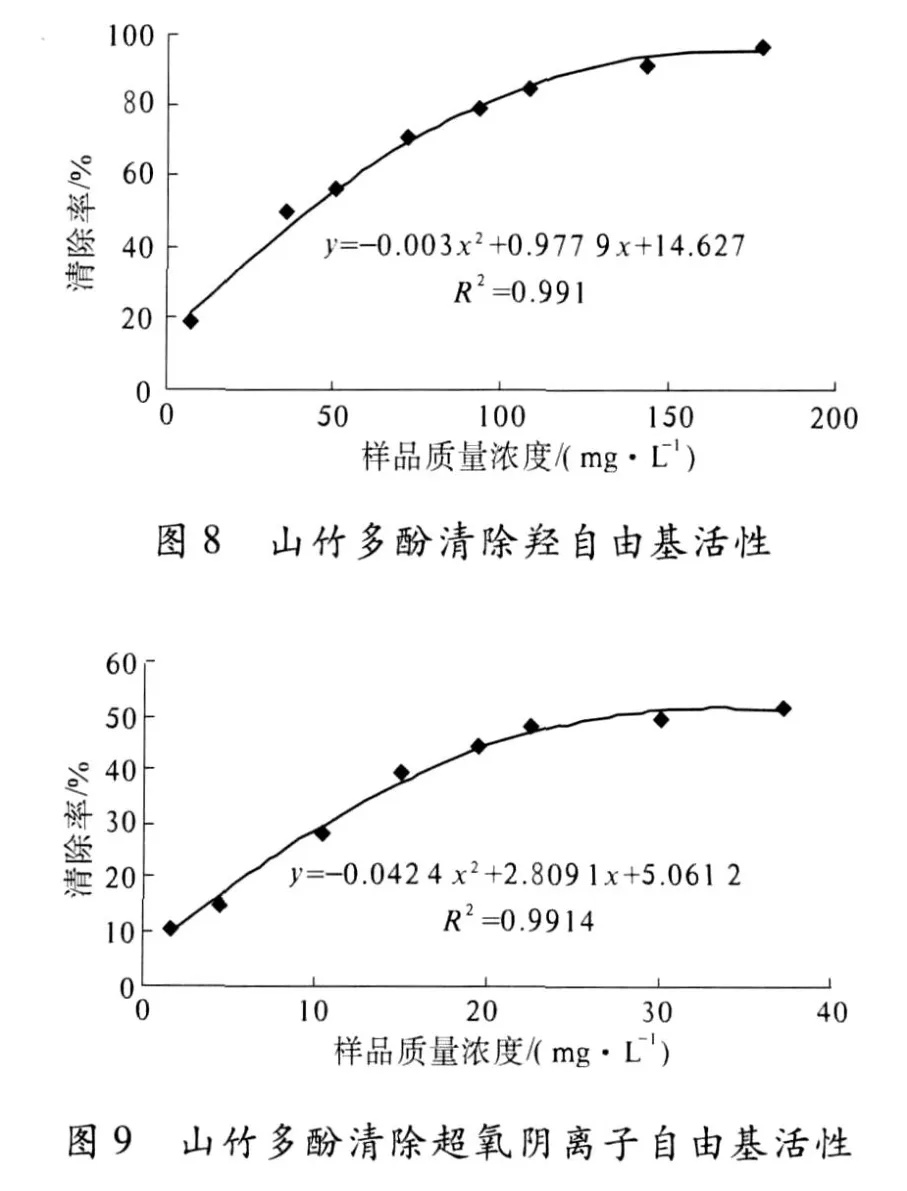
山竹多酚表现出良好的自由基清除活性,且随质量浓度的增加清除作用增强,存在明显的量效关系.根据自由基清除曲线的趋势线方程,计算山竹多酚清除自由基 IC50值,结果见表3.

表3 山竹多酚清除自由基 IC50值
3 结论
利用响应面法对山竹外果皮中多酚类物质浸提的关键因子进行了优化,建立了浸出率与液料比、浸提时间和浸提液体积分数的二次多项式回归方程,对 3因素及其交互作用进行了分析,得出多酚浸提的优化条件为乙醇溶液体积分数 60%、液料比18︰1、浸提时间 66 min,在此条件下进行浸提试验,多酚浸出率为 11.38%.
多酚浸提液经大孔吸附树脂纯化处理后,冷冻干燥得山竹多酚产品,多酚含量为 87.19%.产品具有较强的清除自由基活性,对 DPPH、羟基自由、超氧阴离子自由基清除活性 IC50值分别为4.67 mg/L、41.4 mg/L和 27.0 mg/L.
[1] 刘世彪,彭小列,田儒玉.世界热带五大名
果树[J].生物学通报,2003,3(3):11-13.
[2] 刘全儒,于明.几种热带果实的食用部[J].生物学通报,2003,38(1):10.
[3] 刘彦波,刘金平,赵岩,等.山竹果皮及果蒂无机元素成分的分析[J].特产研究,2006(4):60-62.
[4] 余其杰.山竹子的栽培[J].热带作物科技,1990,4:27-30.
[5] Rukayah A,Zabedah M.Studies on early growth ofmangosteen(Garcinia mangostanaL)[J].Acta Horticulturae,1992,292:93-100.
[6] 辛广,张平,张雪梅.山竹果皮与果肉挥发性成分分析 [J].食品科学,2005(8):291-293.
[7] 范润珍,彭少伟,林宏图.山竹壳色素的提取及其稳定性研究 [J].食品科学,2006(10):358-361.
[8] 胥秀英,王阿丽,郑一敏,等.山竹果壳中红色素的提取及其应用研究[J].食品科学,2006(3):173-174.
[9] Jung H,Su B,KellerW,et al.Antioxidant xanthones from the pericarp of Garcinia mangostana(Mangosteen)[J].J Agric Food Chem,2006,54(6):2077-2082.
[10]Nakatani K,NakahataN,Arakawa T,et al.Inhibition of cyclooxygenase and prostaglandin E2 synthesis by gammamangostin,a xanthone derivative in mangosteen,in C6 rat glioma cells[J].Biochem pharmacol,2002,63(1):73-79.
[11]于立梅,赵谋明,崔春,等.山竹壳中原花青素提取分级及抗氧化活性的研究[J].食品与机械,2007,23(4):60-64.
[12]凌关庭.抗氧化食品与健康 [M].北京:化学工业出版社,2004:342-343.
[13]熊何健,郑建华,吴国宏,等.荔枝多酚的分离制备及清除 DPPH活性[J].食品科学,2006,27(7):86-88.
[14]Molyneux P.The use of the stable free radical diphenylpicrylhydrazyl(DPPH)For estimating antioxidant activity[J].Songklanakarin J Sci Technol,2004,26(2):211-219.
[15]何云核,胡丰林,陆瑞利,等.中国亚热带常见园林植物清除 DPPH自由基活性研究[J].园艺学报,2003,30(5):563-567.
[16]张昊,任发政.羟基和超氧自由基的检测研究进展[J].光谱学与光谱分析,2009,29(4):1093-1099.
[17]吴娜,沈谦,蔡光明.巴马火麻仁木脂素酰胺类提取物的鉴定及清除自由基活性的研究[J].化学学报,2009,67(7):700-704.
[18]熊何健,庞杰,谢主兴.太子参提取物体外抗氧化活性研究[J].南开大学学报:自然科学版,2009,42(6):37-41.
PREPARATI ON OF POLYPHENOLS FROMGARCIN IA MANGOSTANA PER ICARP AND FREE RAD ICAL SCAVENGI NG ACTI V ITY
XI ONG He-jian,WU Guo-hong,WANG Li-fang,Q I AO Xiao-rui
(B ioengineering College,Jim ei University,X iam en361021,China)
The article adopted the response surface methodology(RS M)to optimize the preparation process of polyphenols fromGarcinia m angostanapericarp,and studied the free radical scavenging activity of polyphenols.The results showed that the optimal extraction conditions of polyphenols were as follows:ethanol 60%(V/V),liquid to material ratio 18︰1,and extraction time 66 minutes.Under the optimal conditions,the extraction rate of polyphenolswas 11.38%.The extractwas purified by XDA-7 macroporous resin column to obtain theGarcinia m angostanapolyphenolswith the content of 87.19%.The IC50values of the polyphenols in scavenging free radicals,such asDPPH,hydroxyl free radical,and superoxide anion free radicalwere 4.67 mg/L,41.4 mg/L and 27.0 mg/L respectively.
Garcinia m angostana;polyphenols;preparation;free radical
TS201.1
B
1673-2383(2010)05-0025-05
2010-06-01
集美大学创新团队基金项目(2006A002)
熊何健 (1968-),男,江西东乡人,副研究员,研究方向为食品化学与营养.
