纳米羟基磷灰石的精氨酸表面修饰及其与基因的结合性能
2010-09-29赵颜忠朱晒红黄艳艳李志友周科朝
赵颜忠,朱晒红,谭 娟,黄艳艳,李志友,周科朝
(1. 中南大学 粉末冶金国家重点实验室,长沙 410083;2. 中南大学 湘雅三医院,长沙 410013;3. 中南大学 医用材料与器械研究中心,长沙 410013)
纳米羟基磷灰石的精氨酸表面修饰及其与基因的结合性能
赵颜忠1,2,3,朱晒红2,3,谭 娟2,黄艳艳2,李志友1,周科朝1,3
(1. 中南大学 粉末冶金国家重点实验室,长沙 410083;2. 中南大学 湘雅三医院,长沙 410013;3. 中南大学 医用材料与器械研究中心,长沙 410013)
采用水热合成法制备经精氨酸表面修饰的羟基磷灰石纳米颗粒(Arg-nHAP)。利用透射电镜(TEM)、Zeta电位分析仪、傅立叶红外光谱仪和X射线衍射(XRD)对Arg-nHAP的形貌、结构、晶粒粒径和Zeta电位进行表征,并将其与质粒DNA(pEGFP-N1)进行凝胶电泳实验,研究Arg-nHAP对基因的结合和保护性能。结果表明:制备的Arg-nHAP粒径较均匀,约为50 nm~80 nm,分散性良好;在pH=7.4时,纳米颗粒的表面净电荷均值为30.89 mV,可与带负电荷的质粒DNA通过静电结合快速形成纳米颗粒−质粒DNA复合物,对结合的DNA起到明显的保护作用;经精氨酸表面修饰的Arg-nHAP可成为一种有效的基因结合载体。
羟基磷灰石;精氨酸;水热合成;基因载体
Abstract:An arginine modifying nano-hydroxyapatite (nHAP) was synthesized by hydrothermal synthesis. The morphology, structure, crystallite size and Zeta potential of the Arg-nHAP were characterized by X-ray diffractometry(XRD), transmission electron microscopy(TEM), Fourier transform infrared (FTIR) and Zeta potential analyzer. The binding and protecting properties of Arg-nHAP to DNA were tested by electrophoresis experiment. The results show that the Arg-nHAP is very fine and well distributes, the mean diameter of the nanoparticles is 50−80 nm and its Zeta potential is about 30.89 mV at pH of 7.4. Arg-nHAP/DNA nanocomplexes can be formed rapidly by electrostatic interaction of nanoparticles with DNA having negative electrons. The nHAP modified with arginine can effectively bind and protect DNA and may be used as a potential gene carrier.
Key words:hydroxyapatite; arginine; hydrothermal synthesis; gene carrier
目前,基因治疗仍未能取得实质性突破,主要是因为缺乏高效安全的基因载体。因为病毒载体存在安全性问题,美国FDA已停止了病毒载体的临床应用审批[1]。发展安全、无/低毒、无免疫原性及易于组装的新型基因载体材料已成为国际医学界关注的焦点。非病毒载体系统虽然无病毒毒性和免疫原性等,但传递效率不如病毒载体系统。脂质体和阳离子多聚物等有机物是目前基因治疗研究普遍采用的非病毒载体材料,但脂质体体内转染的不稳定性和阳离子多聚物(如聚乙烯亚胺和壳聚糖)存在细胞毒性或转染率较低等问题,阻碍了其临床应用[2−3]。纳米生物技术的发展为基因传递系统提供了新的材料和方法,目前研究较多的纳米载体主要有硅氧化物[4]和铁氧化物[5]等,但也存在转染率较低和细胞毒性,以及体内不易排解等问题[6]。纳米羟基磷灰石(Nanohydroxyapatite,nHAP)与人体硬组织的无机成分相似,具有天然的生物相容性,与普通的羟基磷灰石材料相比,具有更佳的理化性质和生物学性能,如溶解度较高、表面能较大和生物活性更强[7-8]。尤其重要的是,纳米羟基磷灰石颗粒本身具有抑制癌细胞生长的作用[9]。羟基磷灰石还是一种高效的吸附材料,能够结合核酸和蛋白质[10−11]。研究发现[12],纳米羟基磷灰石颗粒(nHAP)可作为基因载体,转染绿色荧光蛋白报告基因的转染率可达到同等条件下脂质体的50%。FRAYSSINET等[13]应用纳米羟基磷灰石颗粒和DNA共沉淀成功转染LacZ报告基因入胞,进一步证明了纳米羟基磷灰石的基因转染能力。TAN等[14]研究发现,经鱼精蛋白修饰后,纳米羟基磷灰石基因转染率可进一步提高。孙虹等[15]用纳米羟基磷灰石颗粒转染 NT-3基因,发现不仅可转染到体外培养的小鼠耳蜗神经元,而且能够转染到活体豚鼠的耳蜗神经元内,这证明了纳米羟基磷灰石载体在体外和体内均具有结合、保护和释放基因的能力。上述研究表明,纳米羟基磷灰石颗粒可能是一种高效安全的基因载体材料。但是,需要进一步提高这种载体材料的基因转染率。
本实验选取精氨酸(Arginine)作为纳米羟基磷灰石颗粒修饰物,一方面,由于亲水性的精氨酸带有胍基基团−(CH2)3NHC(NH2)+,等电点为 10.76,在实验条件下,反应液pH值将一直小于精氨酸的等电点,因而在整个反应过程中精氨酸带正电荷。另一方面,由于精氨酸和胍基官能团被发现能有效穿透细胞膜[16],可在DNA转运到细胞内的过程发挥着非常重要的作用,暗示富精氨酸短肽能有效地提高基因转染效率, 但富精氨酸短肽介导基因转染的机理依然不大清楚, 明显有别于受体介导的内吞机制[17]。本文作者旨在探讨精氨酸修饰的水热合成颗粒(Arg-nHAP)的形貌与表面结构,及其与基因的结合能力。
1 实验
1.1 实验材料
本研究采用的实验材料主要如下:硝酸钙Ca(NO3)2·4H2O(AR,中国医药集团上海化学试剂公司),磷酸铵(NH4)3PO4·3H2O(AR,中国医药集团上海化学试剂公司),精氨酸(Arginine,Sigma公司),脱氧核糖核酸酶Ⅰ(Invitrogen公司),pEGFP-N1质粒(武汉市晶赛生物工程技术有限公司),以及自行配制的磷酸缓冲盐溶液(PBS)和HEPES缓冲盐溶液(HBS)。
1.2 Arg-nHAP粉体的水热合成
分别制取硝酸钙 Ca(NO3)2·4H2O、磷酸氢二氨(NH4)2HPO4)的水溶液。精氨酸预先加入到磷酸盐溶液中,充分搅拌后滴加硝酸钙溶液,Ca与P的摩尔比为1.67。反应温度为 60 ℃,采用氨水或尿素调节溶液pH值。待钙、磷溶液搅拌混匀后,再将溶液转入到水热釜中,在设定的水热温度下持续反应。待水热溶液反应完全,取其中的沉淀经去离子水和无水乙醇洗涤、过滤,真空干燥,获得羟基磷灰石粉末。
1.3 Arg-nHAP颗粒的表征
采用扫描电镜(SEM,JSM−6360LV, JEOL Japan)分析Arg-nHAP纳米粒晶体形貌和粉体粒度,采用X射线衍射(XRD)对 Arg-nHAP进行物相分析(Rigaku D-Max/2550VB+, Tokyo, Japan,Cu Kα辐射,λ=1.54178Å,40 kV,30 mA),扫描角度和速度采用25˚~55˚,2.4(˚)/min或5˚~75˚,5(˚)/min,傅立叶红外光谱仪为Nicolet Nexus−470,KBr制片。
1.4 Arg-nHAP混悬液的制备
取精氨酸修饰后的Arg-nHAP粉末0.5 g, 放入离心管, 加去离子水20 mL,浓度为25 g/L, 用超声波分散60 min (Ultrasonic Hemogenizer 24710,USA ) , 静置观察2 h,羟基磷灰石纳米颗粒混悬液无分层, 呈乳状。将纳米颗粒混悬液置入50 mL 玻璃瓶, 高压灭菌后备用。取1 mL 纳米颗粒混悬液样本,超声处理8 min后,用透射电镜(TEM,Tecnai G2 20ST,FEI Co.)观察纳米混悬液颗粒粒度和分散状态。
1.5 Arg-nHAP的Zeta电位测定
pH=7.4时,采用英国 Malvern Instrument公司Zetasizer3000 HS纳米粒度及电位分析仪测定 nHAP及经精氨酸修饰的 Arg-nHAP的电泳迁移率(Electrophoretic mobility,EPM),从而计算出Zeta电位。nHAP及精氨酸修饰的Arg-nHAP各8例,每例样本测试重复3次,取平均值。
1.6 Arg-nHAP与质粒DNA的结合实验
在不同pH值下,将Arg-nHAP与pEGFP-N1质粒DNA按质量比 30:1混合,同时在 pH=7.4时,将Arg-nHAP与pEGFP-N1质粒分别按Arg-nHAP与DNA质量比0:1、10:1、30:1、50:1、70:l和90:1在离心管内混合,其中DNA的浓度恒定为0.1 g/L,室温静置20 min,轻摇混匀后于4 ℃时静置30 min,12 000 r/min离心10 min,离心后取上清液10 μL,0.7%琼脂糖凝胶电泳(80 V)45 min,EB染色10 min,采用凝胶成像系统观测。
1.7 Arg-nHAP的DNA抗核酸酶保护实验
Arg-nHAP与DNA按照上述最佳条件结合形成复合体后,将其放入5%小牛血清和5%胎牛血清(血清中存在大量可降解DNA的成分)中重悬,于37 ℃培育8 h;或者将Arg-nHAP-DNA复合体与每微克DNA中含1 mU的DNaseⅠ混合,在37 ℃培育1 h。同时也将寡质粒DNA作对照。以速度为10 000 r/min离心10 min,离心后取沉淀用洗脱液(20 mmol/L Tris.Cl,pH 7.4,1 mmol/L EDTA,100 mmol/L NaCl;50 %的乙醇,室温保存)洗脱,离心后取上清液,琼脂糖凝胶电泳检测;对照寡质粒DNA组直接用琼脂糖凝胶电泳检测。
2 结果与讨论
2.1 Arg-nHAP颗粒的形貌
图1所示为水热合成HAP颗粒的TEM像。由图1可看出,未经修饰的颗粒样品呈短柱状,同一颗粒的横截面尺寸均匀,约为50~100 nm。在长度方向上,颗粒间尺寸差异较大,约为50~200 nm。加入精氨酸后,颗粒尺寸减小,各方向的尺寸差异变小,呈粒状,粒径约为50~80 nm。在水热条件下合成HAP的过程中,由于精氨酸在结晶析出HAP晶粒表面的吸附存在晶面的选择性,影响了HAP晶粒长大的行为。热力学平衡条件下 HAP晶体的择优生长方向为[001]。在水热介质中精氨酸带正电性的胍基基团−(CH2)3NHC(NH2)+可与 HAP(001)面裸露的负电性羟基(—OH)发生静电作用,导致精氨酸更倾向于吸附在HAP的(001)面,因此,精氨酸的吸附更大程度地阻碍了溶液合成产物在HAP(001)面的析出,使得HAP各晶体方向的生长速度差异减小,晶体各方向的尺寸差异同时降低。另一方面,由于各个晶面不同程度地吸附一定数量的精氨酸,HAP晶体生长受阻,要求更多的新颗粒形核析出,以降低溶液的过饱和度。高形核密度有利于获得更细小的HAP颗粒。
2.2 Arg-nHAP颗粒的表征

图1 水热合成HAP颗粒的TEM像Fig.1 TEM images of HAP crystal synthesized by hydrothermal method: (a) Without amino acid; (b) With arginine
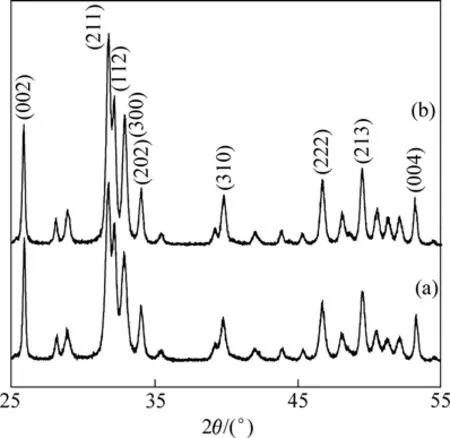
图2 160 ℃时水热法合成nHAP的XRD谱Fig.2 XRD patterns of nHAP particles synthesized by hydrothermal method at 160 ℃: (a) Without extraneous additives; (b) With arginine
图2所示为两组样品的XRD谱。从图2可以看出:所制备的nHAP样品的XRD谱相差不大,特征峰尖锐明显,表明所制备的样品的结晶程度比较高,晶形完整。但主要特征峰相对强度存在细微差异,相对于(002)峰,Arg-nHAP样品的(300)峰的强度增大;Arg-nHAP样品的(002)峰与(211)峰的比值降低,主要特征峰的相对强度与HAP标准粉末卡片JCPDs 9−432的对应性提高。这证实图1所显示的Arg-nHAP样品各方向尺寸倾向于一致、粉末颗粒粒状特征加强的实验现象。
图3所示为水热合成的nHAP傅立叶红外光谱。由图3可看出,两组样品的红外光谱的波形相似,谱中主要峰的位置相同。较强的峰线出现在 565.25、604.21、1 035.78、3 441.75 cm−1等位置,并在1 106.57、1 420.30、1 631.24和3 570.12 cm−1等位置出现强度较弱或位置较宽的峰线。理论上 PO43−的 4种振动方式对应峰的位置分别如下:ν1峰在960 cm−1附近,ν2峰位于470至440 cm−1区域,ν3位于1 190至976 cm−1区域,ν4峰位于600至560 cm−1区域。因此,565.25、604.21和1 035.78 cm−1的强峰以及1 106.57 cm−1的弱峰是nHAP中PO43−根产生的。晶格中的水分子特征峰出现在 3 550~3 200 cm−1区域,因此,3 441.75和3 570.12 cm−1位置的峰是晶格水和磷灰石羟基(OH−)的反映。1 631.24 cm−1处特征峰是H2O的振动峰,表明粉末样品表面吸附少量的水分。氨基(-NH2)的特征峰出现在 1 400~1 420 cm−1区间,1 420.30 cm−1峰可能是少量来自于原料磷酸氢二氨的铵根(NH4+)、氨基酸的残留物吸附在HAP的反映。对于加入精氨酸的样品,该峰强度有所增强(见图(b)),说明存在氨基酸残留物。
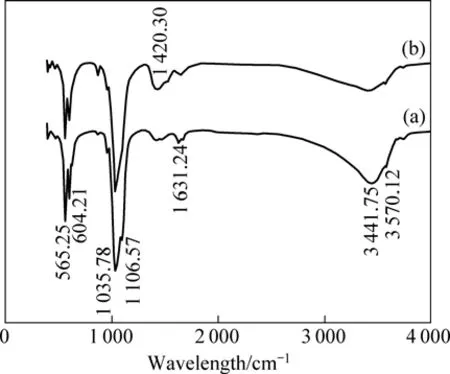
图3 水热合成HAP的傅立叶红外光谱Fig.3 FTIR spectra of nHAP prepared by hydrothermal synthesis: (a) Without amino acid; (b) With arginine
2.3 Arg-nHAP颗粒的Zeta电位
图4所示为pH值为7.4时Arg-nHAP的Zeta电位图。由图4可看出,在弱碱性的条件下(pH=7.4),Arg-nHAP的Zeta电位为(30.9±8.2) mV,而未修饰的nHAP的Zeta电位为(−12.5±6.5) mV。这说明合成过程中精氨酸的加入使得nHAP颗粒表面的带电状态发生根本性的转变,由常规nHAP的负Zeta电位值变为Arg-nHAP的正值。这一变化是因为Arg-nHAP颗粒表面吸附了氨基酸或氨基酸残留物。在随后的研究中,将设法从 Arg-nHAP合成的水溶液介质中提取该物质,并进行标定,进而探讨精氨酸影响HAP的水热结晶行为和表面带电状态的深层次机理。
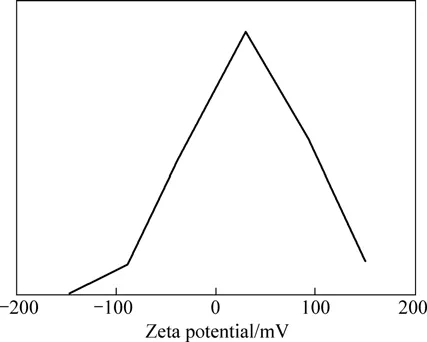
图4 pH值为7.4时Arg-nHAP的Zeta电位曲线Fig.4 Zeta potential curve of Arg-nHAP at pH of 7.4
2.4 Arg-nHAP与质粒DNA的结合性能
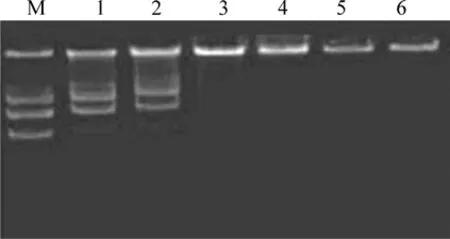
图5 Arg-nHAP/DNA复合物的凝胶电泳照片Fig.5 Electrophoresis photos of Arg-nHAP/DNA composite(M: Marker; 1: Positive control; 2: Mass ratio of Arg-nHAP to DNA 10:1; 3: Mass ratio of Arg-nHAP to DNA 30:1; 4: Mass ratio of Arg-nHAP to DNA 50:1; 5: Mass ratio of Arg-nHAP to DNA 70:1; 6: Negative control
图5所示为Arg-nHAP与DNA(pEGFP-N1质粒)的复合物琼脂糖凝胶电泳图。检测发现,当Arg-nHAP与pEGFP-N1质粒质量比分别为30:1、50:1和70:1时,其反应上清液在琼脂糖胶电泳图中未发现DNA条带,表明所有的DNA已完全与Arg-nHAP结合,且30 μg Arg-nHAP至少结合1 μg DNA。采用紫外分光光度计测定的260 nm吸光值也证明了同样的结果。
DNA与Arg-nHAP结合后形成Arg-nHAP/DNA复合物,其密度比DNA的大。因此,可通过比较离心前后液体中的 DNA浓度来判断 DNA是否与Arg-nHAP有效结合。本研究中的DNA结合实验显示,Arg-nHAP与DNA质量比为10:1时仅结合极少量的DNA,质量比大于30:1的体系中Arg-nHAP几乎结合了全部的DNA。
2.5 Arg-nHAP对DNA抗核酸酶的保护性能
血清中存在可降解DNA的成分,将寡质粒DNA与血清在37 ℃时温育8 h后,发现DNA已被完全降解;而DNA在与Arg-nHAP结合后形成了复合体,与5%胎牛血清在37 ℃时温育8 h后,产物琼脂糖胶电泳结果显示DNA条带大小正常,没有脱尾现象(见图 6)。DNase Ⅰ消化实验也证明这一结果。表明Arg-nHAP与DNA结合后,能有效保护DNA,使之不被血清中核酸酶降解。
随Arg-nHAP与DNA质量比的增大,载体保护DNA抗核酸酶的能力相应增加,质量比为30:1时,DNA电泳条带未见被血清或DNase Ⅰ消化的片段。在负载和保护基因的机制方面,Arg-nHAP颗粒与多价阳离子聚合物是一致的。荷正电的Arg-nHAP载体与荷负电的DNA通过静电吸引方式结合,浓缩DNA缩小整个载体/DNA复合物体积,从而达到有效结合并保护DNA免遭核酸酶的破坏。

图6 Arg-nHAP对DNA保护的凝胶电泳照片Fig.6 Electrophoresis photos showing protection of Arg-nHAP to DNA (M: Marker; 1: pDNA mixed with Arg-nHAP in Dulbecco MEM (DMEM) supplemented with 5% fetal bovine serum; 2: Single pDNA in 5% bovine serum with Dulbecco MEM (DMEM); 3: Single pDNA in 5% fetal bovine serum with Dulbecco MEM (DMEM); 4: Single pDNA in fetal bovine serum)
3 结论
1) 在水热合成过程中,添加精氨酸有利于获得尺寸均匀、形貌倾向于粒状的纳米羟基磷灰石颗粒。
2) 精氨酸表面修饰改变nHAP表面电荷的电性,其Zeta电位由未修饰的(−12.5±6.5) mV变为修饰后的(30.9±8.2) mV。
3) 每30质量单位的Arg-nHAP可负载至少1个质量单位的质粒DNA,负载的DNA可抵御核酸酶的溶解。
REFERENCES
[1] KO Y T, KALE A, HARTNER W C, TORCHILIN V P.Self-assembling micelle-like nanoparticles based on phospholipid-polyethyleneimine conjugates for systemic gene delivery[J]. Journal of Controlled Release, 2009, 133 (2): 132.
[2] MANGESH C D, MARK R P. Synergistic effect of ultrasound and PEI on DNA transfection in vitro[J]. J Control Release, 2007,118(1): 126−135.
[3] 杨亚萍, 樊明文. 壳聚糖介导基因转染效率影响因素的研究进展[J]. 国际口腔医学杂志, 2008, 35(5): 540−542.YANG Ya- ping, FAN Ming-wen. Development in the study of influential factor s associated with gene transfection efficiency mediated by chitosan[J]. International Journal of Stomatology,2008, 35(5): 540−542.
[4] TORNEY F, TREWYN B G, LIN V S, WANG K. Mesoporous silica nanoparticles deliver DNA and chemicals into plants[J].Nat Nanotechnol, 2007, 2(5): 295−300.
[5] JIN S, LEACH J C, YE K. Nanoparticle-mediated gene delivery[J]. Methods Mol Biol, 2009, 544: 547−557.
[6] RUAN J M, LIU W D, HUANG K L, YANG J K, WEN Z B, LU H B. Nano-technology applied for early diagnose and therapy of malignant tumor[J]. Journal of Central South University of Technology, 2002, 33(8): 160−165.
[7] LEGEROS R Z. Properties of osteoconductive biomaterials:calciumphosphates[J]. Clinical Orthopaedics and Related Research, 2002, 395: 81−98.
[8] AOKI H, AOKI H, KUTSUNO T. An in vivo study on the reaction of hydroxyapatite-sol injected into blood[J]. Journal of Materials Science: Materials in Medicine, 2000, 11: 67−72.
[9] LIU Z S, TANG S L, AI Z L. Effects of hydroxyapatite nanoparticles on proliferation and apoptosis of human hepatoma BEL-7402 cells[J]. World Journal of Gastroenterology, 2003,9(9): 1968−1971.
[10] MATSUMOTO T, OKAZAKI M, INOUE M. Hydroxyapatiteparticles as a controlled release carrier of protein[J]. Biomateials,2004, 25(17): 3807−3812.
[11] BOONSONGRIT Y, ABE H, SATO K, NAITO M,YOSHIMURA M, ICHIKAWA H, FUKUMORI Y, Controlled release of bovine serum albumin from hydroxyapatite microspheres for protein delivery system[J]. Mater Sci Eng B,2008, 148: 162−165.
[12] ZHU Shai-hong, HUANG Bai-yun, ZHOU Ke-chao, HUANG Su-ping, LIU Fang, LI Yi-ming, XUE Zhi-gang, LONG Zhi-gao.Hydroxyapatite nanoparticles as a novel gene carrier[J]. Journal of Nanoparticle Research, 2004, 6(2): 307−311.
[13] FRAYSSINET P. Bone cell transfection in tissue culture using hydroxyapatite microparticles[J]. Journal of Biomedical Materials Research A, 2006, 79(2): 225−228.
[14] TAN K, CHEANG P, HO I A W, LAM P Y P, HUI K M.Nanosized bioceramic particles could function as efficient gene delivery vehicles with target specificity for the spleen[J]. Gene Therapy, 2007, 14: 828−835.
[15] 孙 虹, 蒋 明, 朱晒红.用羟基磷灰石纳米粒作内耳基因治疗新载体的体内外研究[J]. 中华耳鼻咽喉头颈外科杂志,2008, 43(1): 51−57.SUN Hong, JIANG Ming, ZHU Shai-hong. In vitro and in vivo studies on hydroxyapatite nanoparticles as a novel vector for inner ear gene therapy[J]. Chinese Journal of Otorhinolaryngology Head and Neck Surgery, 2008, 43(1):51−57.
[16] BROOKS H, LEBLEU B, VIVES E. Tat peptide-mediated cellular delivery: Back to basics[J]. Advanced Drug Delivery Reviews, 2005, 57(4): 559−577.
[17] UMEZAWA N, GELMAN M A, HAIGIS M C, RAINES RT,Gellman S H. Translocation of a beta-peptide across cell membranes[J]. Journal of the American Chemical Society, 2002,124(3): 368−369.
(编辑 龙怀中)
Arginine modification and gene binding property of hydroxyapatite nanoparticles
ZHAO Yan-zhong1,2,3, ZHU Shai-hong1,2, TAN Juan2, HUANG Yan-yan2, LI Zhi-you1, ZHOU Ke-chao1,3
(1. State Key Laboratory of Powder Metallurgy, Central South University, Changsha 410083, China;2. The Third Xiangya Hospital, Central South University, Changsha 410013, China;3. Research Center for Medical Material and Instruments, Central South University, Changsha 410013, China)
TB 39
A
1004-0609(2010)06-1203-06
长沙市科技计划资助项目(K0905035-11)
2010-01-05;
2010-04-20
周科朝,教授,博士;电话:0731-88830464;E-mail: zhoukechao@mail.csu.edu.cn
