超高效液相色谱-串联质谱法检测蜂蜜中氯霉素残留
2010-09-26冯雷张学忠牛之瑞祝红昆李波
冯雷,张学忠,牛之瑞,祝红昆,李波
(云南省产品质量监督检验研究院,云南昆明650223)
超高效液相色谱-串联质谱法检测蜂蜜中氯霉素残留
冯雷,张学忠,牛之瑞,祝红昆,李波
(云南省产品质量监督检验研究院,云南昆明650223)
研究一种针对蜂蜜中氯霉素残留量的液质联用分析方法。采用水溶解蜂蜜,用乙酸乙酯萃取蜂蜜水溶液中的氯霉素,氮吹至干后用水溶解样品残渣,然后用HLB小柱进行固相萃取,对样品中的氯霉素进行净化前处理。以乙腈-水作为流动相,C18色谱柱对蜂蜜的氯霉素进行分离,然后用电喷雾质谱负离子多反应监测模式[ESI(-)-MRM]对氯霉素进行检测,缩短了色谱分离时间,提高了检测灵敏度和分析结果可靠性,具有准确、快速以及高灵敏度和高选择性的特点,能够适应大规模样品的快速分析要求。
氯霉素;蜂蜜;超高效液相色谱-串联质谱联用;分析
氯霉素属胺苯醇类广谱抗生素,由Ehrlich等在1947年首次从微生物代谢产物中分离得到,目前用人工方法合成,已广泛用于动物各种传染性疾病的治疗[1]。氯霉素对人体有严重的副作用,它能抑制人体骨髓造血功能而引起再生障碍性贫血症和粒状白细胞缺乏症等疾病[2],因此动物性食品中的氯霉素残留对人类的健康构成了潜在的危害。美国仅允许氯霉素用于非食用动物,规定在动物性食品中不得检出氯霉素,欧盟(EEC)规定在鸡蛋和乳牛中禁止使用氯霉素,在鸡肉、肝、肾中的氯霉素残留量不得超过0.01 mg/kg[2-3]。我国由于检测技术与国外先进检测机构存在一定差距,因此常常遇到出口食品氯霉素超标问题,每年出口损失高达数10亿美元[2]。因此研究一种高效、灵敏的氯霉素残留量检测方法势在必行,对我国的进出口贸易以及人民的食品安全意义重大。
氯霉素残留量的测定方法有酶联免疫法[4]、气相色谱法[5]、气质联用法[6]、液相色谱法[7]和液质联用法[8-10]等多种方法。酶联免疫法具有快速简便的特点,但仅适用于样品的快速筛查,在定性及定量的准确度方面存在一定的局限性。气相色谱法和气质联用法均需要对氯霉素样品进行衍生化才能进行分析,其前处理繁琐且耗时较长。液相色谱方法的灵敏度较差,选择性不好,容易出现假阳性结果。液质联用方法则是一种高灵敏度、高选择性的检测方法,特别是液相色谱-串联质谱系统通过多反应监测模式则可进一步提高检测的灵敏度和选择性,大大降低了检测限和假阳性检测结果的出现几率。
本研究开发了一种超高效液相色谱-串联质谱联用系统分析蜂蜜中的氯霉素方法,采用超高效液相色谱作为分离手段,有效地节省了分析时间和流动相的消耗量,采用串联质谱对氯霉素进行检测,降低了假阳性检测结果的出现机率,提高了检测的准确性和检测灵敏度,本方法运用到实际样品的检测中结果令人满意。
1 材料与方法
1.1 试剂与材料
氯霉素标样:美国Sigma公司;乙腈、甲醇、乙酸乙酯:色谱纯,美国Fisher公司;18.2 MΩ超纯水:赛多利斯超纯水机生产;蜂蜜样品:云南白塔蜂业有限公司提供。
1.2 仪器及工作条件
1.2.1 主要仪器及设备
GL-12B高速离心机:上海安亭科学仪器厂;NEVAP氮吹仪:美国Organomation公司;CPA225D电子天平:德国Sartorius公司;ACQUITY超高效液相色谱(色谱柱为 ACQUITY UPLC BEH C18 1.7μm 2.1×100 mm):美国Waters公司;API-3200串联质谱仪、质谱工作站为Analyst质谱工作站:美国AB公司。
1.2.2 色谱条件
流动相A为水溶液,流动相B为乙腈,流动相梯度见表1,流动相流速为0.4mL/min,柱温30℃,进样量 5μL。
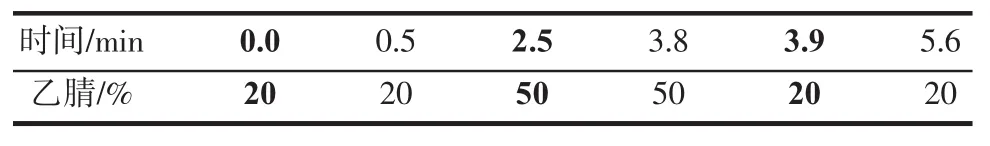
表1 氯霉素的梯度洗脱程序Table 1 Gradient of mobile phase
1.2.3 串联质谱条件
UPLC/MS/MS接口为电喷雾接口(ESI)负离子模式,离子监测模式为多反应监测模式(MRM),喷雾电压(IS)-4 000 V,喷雾气(GS1)、辅助气(GS2)、气帘气(CUR)、碰撞气(CAD)均为高纯氮气,喷雾气气压为60 psi(1 psi=6.895 kPa),辅助气气压为65 psi,气帘气气压为20 psi,碰撞气气压为5 psi,辅助喷雾气温度为600℃,去簇电压(DP)为-32.0 V,入口电压(EP)为-8.0 V,其他参考条件参见表2。

表2 氯霉素定性离子对、定量离子对、采集时间、碰撞能量和碰撞室出口电压Table 2 Transitions for confirmation and quantification,time,CE,CXP
1.3 标准溶液的配制
准确称取10 mg氯霉素标准样品于烧杯中,用甲醇溶解定容至100mL,得到100μg/mL的标准溶液,稀释100倍后得到1 000 ng/mL的标准储备液。用流动相(水∶乙腈=8∶2)逐级稀释得到标准工作溶液。标准溶液需避光保存在-18℃的冰箱中,标准储备液可稳定保存6个月,标准工作溶液可稳定保存1个月。
1.4 样品前处理
称取蜂蜜样品 5 g(精确至 0.01 g),置于 50mL 聚丙烯离心管中,加入10mL水于漩涡振荡器上振荡1min使蜂蜜完全溶解。准确加入15mL乙酸乙酯,在振荡器上振荡10 min,准确吸取上层乙酸乙酯10mL转入比色管中,在氮吹仪上55℃氮吹至干,加入5mL水溶解残渣。将上述5mL水溶液全部转入经5mL甲醇和5mL水活化过后的HLB固相萃取柱,以3mL/min的流速通过固相萃取柱后,用10mL水分2次清洗比色管并过柱,然后再用 5mL 乙腈+水(1∶7)淋洗 HLB 小柱,弃去全部淋洗液,在负压下对HLB小柱减压抽干10min,最后用5mL乙酸乙酯洗脱,收集洗脱液于10mL比色管中,于 50℃用氮吹仪吹干,用乙腈+水(2∶8)定容至1mL,经0.22μm有机滤膜过滤后即可进样。
2 结果与分析
2.1 质谱条件的选择
氯霉素分子式为C11H12Cl2N2O5,在电喷雾源(ESI)中易失去一个氢原子而带负电荷,因此选择ESI负离子模式对其进行检测。氯霉素一级质谱图见图1。
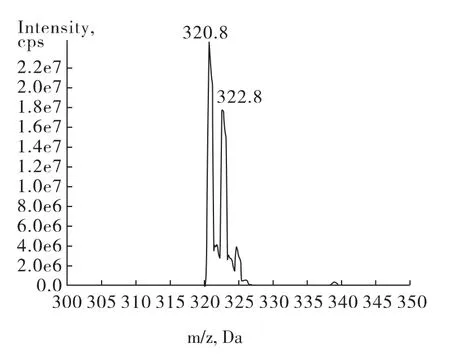
图1 氯霉素一级质谱图Fig.1 The mass spectrum of chloramphenicol
其分子中含有氯元素,因此同位素准分子离子峰分别为m/z320.8和m/z322.8。对320.8的准分子离子进行二级质谱扫描,发现其碎片主要有121.0、151.9、175.9、194.0和257.0,见图2。本方法选取子离子151.9、175.9和257.0进行多反应监测(MRM),以320.8/151.9作为定量离子对,其他2个离子对作为定性离子对。经优化的质谱条件参数见1.2.3。
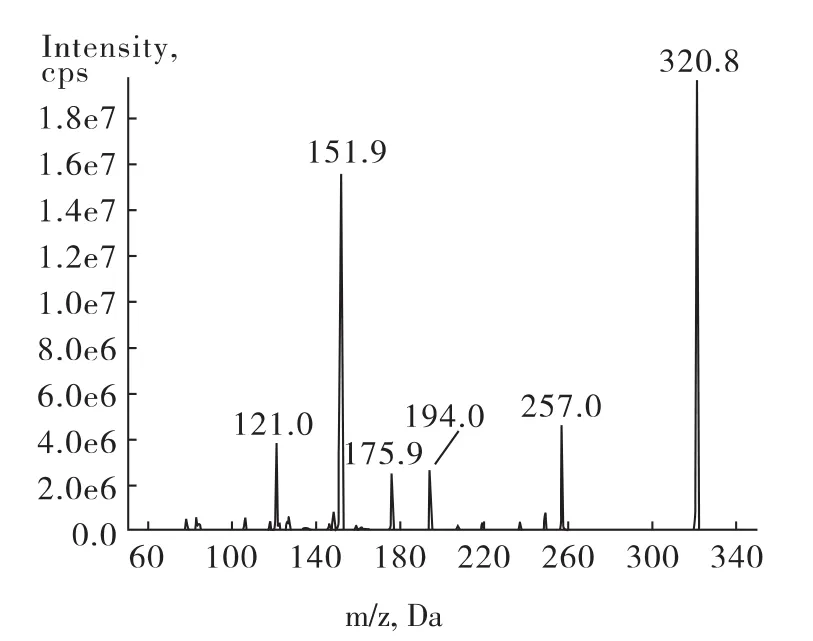
图2 氯霉素二级质谱图Fig.2 The MS2 spectrum of chloramphenicol
2.2 色谱条件优化
试验中比较了不同流动相对分离度、峰形、灵敏度等的影响。发现对于水相来说,水相的酸碱度对于氯霉素分离影响不大,对质谱监测也无明显影响。而有机相用乙腈比用甲醇时的氯霉素峰形更好,而且使用乙腈作为有机流动相更有利于ESI源中溶剂去除。因此试验中采用了水-乙腈的流动相体系。
2.3 定量回归方程及相关系数
配制氯霉素浓度分别为 0.1、0.2、1.0、5.0、10.0、50.0 ng/mL的标准工作溶液,依次进样后以定量离子对的峰面积为Y轴,浓度为X轴,进行线性回归得到氯霉素的定量方程为Y=4 020X-19.1,相关系数r=0.999 8。说明采用外标标准曲线法对样品中的氯霉素进行定量具有较好的线性响应范围。
2.4 方法精密度、回收率及检出限
试验以未检出氯霉素的蜂蜜作为空白样品,采用空白样品加标进行回收率的测定,分别进行了0.1、0.5、5.0 μg/kg 3个水平的空白加标样品进行回收率试验,每个水平做5次平行试验,得到平均回收率及相对标准偏差见表3。
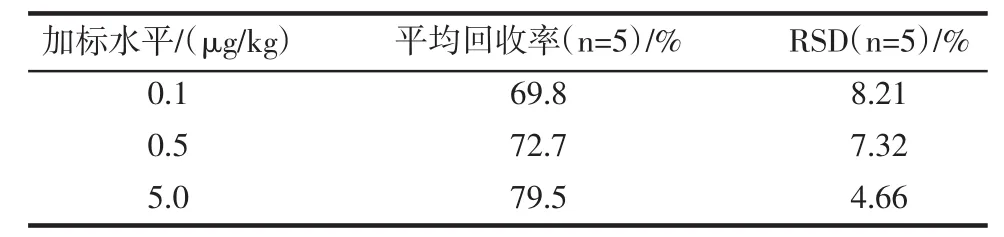
表3 方法精密度和回收率(n=5)Tabble 3 The recovery and precision of method(n=5)
以本方法进样0.1 ng/mL的标准溶液时,定量离子对的信噪比为30.7(图3),若以信噪比(S/N)等于3时计算氯霉素检出限为0.01 ng/mL,根据取样量以及定容体积可计算出本方法运用于实际蜂蜜样品时的检出限为0.002 5 μg/kg。说明此方法回收率、精密度基本令人满意,并且具有很高的灵敏度。
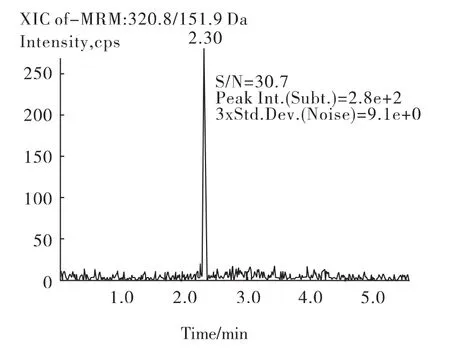
图3 氯霉素标样(0.1 ng/mL)定量离子色谱图Fig.3 The mass chromatography of chloramphenicol standard(0.1 ng/mL)
2.5 样品检测结果
按照本文所述方法对实际样品进行分析,图4为蜂蜜样品中氯霉素的定量离子色谱图,从图4中可以看出,样品中的氯霉素很好地被分离,基本无干扰峰,且分析时间很短,只需6 min即可完成一次分析。说明本方法运用到实际样品的检测中可以得到较好的分离分析结果。
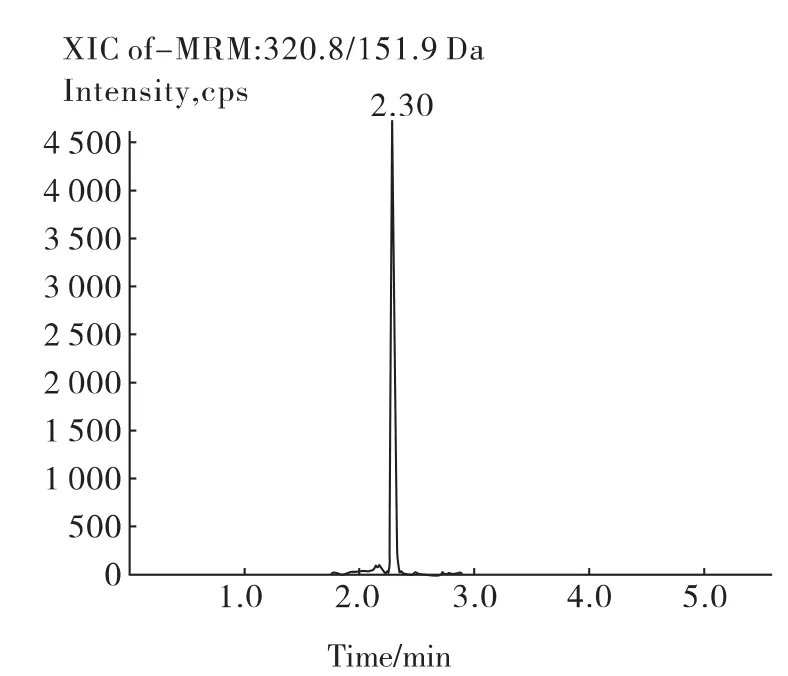
图4 蜂蜜样品定量离子色谱图Fig.4 The mass chromatography of honey sample
3 结论
本方法采用固相萃取技术对蜂蜜样品进行前处理,超高效液相色谱-串联质联用方法检测蜂蜜的氯霉素残留量。本方法6 min完成一个样品分析,分析速度快。多反应监测(MRM)技术的应用,使方法具有了很高的选择性和灵敏度。本方法具有准确、快速、高灵敏度和高选择性的特点,能够适应大规模样品的快速分析要求。
[1]张龙.兽医药物化学[M].北京:中国农业出版社,1999:280-282
[2]徐理奇,卢春香.动物食品中氯霉素类药物的残留状况及检测方法比较[J].饲料工业,2008,29(15):15,41-42
[3]蒋定国,杨大进.动物性食品中氯霉素残留检测技术的研究概况[J].中国食品卫生杂志,2002,14(2):44-47
[4]何佳琪,段振娟,张燕,等.氯霉素残留ELISA检测方法[J].中国兽医杂志,2008,44(2):88-89
[5]钟惠英,杨佳锋,徐开达.气相色谱法定量分析水产品中的氯霉素(CAP)残留量[J].中国卫生检验杂志,2006,16(2):183-185
[6]魏林阳,徐金晶,吴红军.水产品中氯霉素残留的气质联用法检测[J].光谱实验室,2007,24(2):201-205
[7]何方奕,李铁纯,李学程.固相萃取—高效液相色谱法测定肌肉中氯霉素的残留[J].食品科学,2006,27(12):629-630
[8]刘艳琴,王皓,殷晓燕,等.高效液相色谱—电喷雾离子阱质谱测定乳品中氯霉素、甲砜霉素和氟甲砜霉素残留的[J].食品科学2008,29(4):344-346
[9]周萍,胡福良,巩珊,等.液液萃取法结合高效液相色谱-串联质谱测定蜂王浆中的氯霉素残留量[J].食品科学,2008,29(5):341-343
[10]李丹妮,严凤,张文刚,等.超高效液相色谱—串联质谱法对奶粉中氯霉素残留的检测[J].分析测试学报,2008,27(11):161-163
Determination of Chloramphenicol Residues in Honey by UPLC-MS/MS
FENG Lei,ZHANG Xue-zhong,NIU Zhi-rui,ZHU Hong-kun,LI Bo
(Yunnan Institute of Product Quality Supervision and Inspection,Kunming 650223,Yunnan,China)
This thesis concerns about a new analytical approach development of chloramphenicol in honey.Solid-Phase Extraction was used as pretreatment method.After separated by Ultra Performance Liquid Chromatography with acetronitrile-water as mobile phase,than detected the Chloramphenicol residues by MS/MS in the ESI(-)-MRM mode.The pretreatment is efficient.The analytical approach has highly sensitivity and highly selective,the precision is acceptable.So,this new analytical approach has referable value.
chloramphenicol;honey;UPLC-MS/MS;analysis
云南省科技平台项目(2009DA022)
冯雷(1979—),男(汉),工程师,硕士,研究方向:食品中农兽药残留、非法添加剂的检测。
2010-07-13
