浒苔脂肪酸前处理方法优化及GC/MS分析
2010-09-24尹琳琳杨佰娟韩笑天王能飞王小如杨东方
尹琳琳, 杨佰娟, 郑 立, 韩笑天, 王能飞, 王小如, 杨东方
(1. 上海海洋大学 水产与生命学院, 上海 200090; 2. 国家海洋局第一海洋研究所 海洋生态研究中心, 山东青岛 266061; 3. 中国科学院海洋研究所 海洋生态与环境科学重点实验室, 山东 青岛 266071)
浒苔脂肪酸前处理方法优化及GC/MS分析
尹琳琳1,2, 杨佰娟2, 郑 立2, 韩笑天3, 王能飞2, 王小如2, 杨东方1
(1. 上海海洋大学 水产与生命学院, 上海 200090; 2. 国家海洋局第一海洋研究所 海洋生态研究中心, 山东青岛 266061; 3. 中国科学院海洋研究所 海洋生态与环境科学重点实验室, 山东 青岛 266071)
针对绿潮藻的快速化学溯源及资源化利用, 以浒苔为对象, 对其脂肪酸测定过程进行了研究;同时, 通过对浒苔脂肪酸的皂化和甲酯化试剂、水浴温度和水浴时间等反应条件的优化, 建立了绿潮藻脂肪酸前处理新方法。该方法的精密度在 0.38%~3.25%之间, 重现性在 0.65%~5.80%之间; 采用该方法测定福建、江苏和青岛的浒苔脂肪酸含量分别为0.10~5.69 mg/g、0.16~8.59 mg/g、0.10~4.76 mg/g。此方法可适用于浒苔等绿潮藻脂肪酸的实际测定。
绿潮; 脂肪酸; 皂化; 甲酯化
海洋藻类富含人体必需氨基酸、多聚不饱和脂肪酸等多种营养元素, 一直以来被作为人类的食物和营养来源[1~3]。随着人们对健康和营养水平需求的提高, 从海藻中摄取多不饱和脂肪酸已日益受到关注[4,5]。因此掌握和优化脂肪酸分离提取方法很有必要。目前, 藻类脂肪酸的研究多集中于脂肪酸的组成[6~10]、分类[11,12]和色谱分析条件比较[13], 有关脂肪酸前处理过程的研究甚少[14]。脂肪酸前处理方法不统一, 使得测定结果无可比性, 准确性更无从得知。
文献报道脂肪酸前处理的皂化过程中使用的皂化溶剂主要有氢氧化钠甲醇溶液(NaOH-CH3OH)[15,16]和氢氧化钾甲醇溶液(KOH-CH3OH)[17]; 皂化时间长短不同, 在10 min到2 h之间[9,10,15,16]; 皂化过程中的水浴温度也不尽相同(55~75 ℃)[10,15~18]。同样脂肪酸甲酯化过程也不统一, 常用的甲酯化溶剂是盐酸甲醇溶液(HCl-CH3OH)[10,15~17]和三氟化硼甲醇溶液(BF3-CH3OH)[19,20]; 甲酯化时间最短只需 10 min[18],最长的时间可达1 h[16,17]; 甲酯化水浴温度差异很大,在 60~75 ℃之间[9,10,15~18]。
针对藻类脂肪酸前处理没有统一方法的情况,在前人研究基础上, 以浒苔为研究对象, 比较浒苔脂肪酸前处理过程中试剂、时间、温度等影响因素,得出最佳的脂肪酸前处理方法, 并考察该方法的稳定性和重现性。
1 材料和方法
1.1 实验材料
试验所用的新鲜浒苔, 经鉴定为浒苔属浒苔(Enteromorpha prolifera), 2009年上半年采自福建、江苏和青岛海域。样品用干净海水洗去表面杂质和附着物, 于60 ℃烘箱中烘干, −20 ℃冰箱中封口备用。
1.2 仪器、试剂
7890N GC/5975N MS型气相色谱-质谱仪(美国Agilent公司); 电热恒温水浴锅(上海跃进医疗器械厂)。
无水硫酸钠: 600 ℃烘烧 4 h, 冷却后置于干燥器中; 氯仿、甲醇、正己烷均为色谱纯; 氢氧化钠、氢氧化钾、盐酸、硼酸乙醚为分析纯;
脂肪酸标样: 37种脂肪酸混合标准品和19碳酸(上海泉岛公司)。
1.3 实验方法
1.3.1 脂肪酸前处理方法
实验分为皂化条件优化和甲酯化条件优化两部分。皂化条件优化中包括试剂、水浴时间和温度 3个因素。皂化试剂选用文献中常见的 NaOH-CH3OH溶液、KOH-CH3OH溶液; 水浴时间选用15、30、60和120 min; 水浴温度选取60、65、70、75 ℃。甲酯化优化中同样包括试剂、水浴时间和温度3个因素。酯 化试 剂 选用 两 种, 即 HCl−CH3OH 溶液 和BF3-CH3OH 溶液; 酯化时间选用 10、20、30、60 min。酯化过程选取与皂化过程相同的温度梯度。
取适量脂肪酸样品置于 20 mL试管中, 加入 5 mL皂化试剂, 一定水浴温度下反应一段时间, 冷却至室温, 再加入 4 mL甲酯化试剂, 混匀, 水浴一定时间。加1 mL正己烷溶液, 静置分层, 取上清液作GC/MS分析试样。每个优化实验进行三次平行实验,取平均值进行数据分析和作图。
1.3.2 脂肪酸色谱条件
GC 条件: 毛细管色谱柱 HP-5MS(30 m×250µm×0.25 µm); 进样口温度 260 ℃; 升温程序, 起始温度为50 ℃, 保持1 min, 以20℃/min升至190 ℃,再以 4 ℃/min升至 240 ℃, 然后以 10℃/min升至280 ℃, 维持2 min。载气为高纯度氦气; 不分流; 进样量 1 µL。
MS条件: EI离子源, 电子能量70 eV; 离子源温度 230 ℃; 四极杆温度 150℃; 传输线温度 300 ℃;溶剂延时3 min; 扫描范围35~400 amu; 扫描方式为全扫描(Scan)方式。
1.4 标准曲线的绘制
内标溶液: 准确称取15.00 mg19碳酸于10 mL容量瓶中, 用正己烷稀释至刻度。
标准溶液: 将混合标准溶液用正己烷稀释至100倍。
1.5 样品的测定和计算
标准溶液的测定: 取标准溶液1 µL注入气相色谱仪, 得到标准溶液的谱图, 经计算得到各脂肪酸的校正因子。
样品的测定: 取1 µL待测样品注入气相色谱仪进行测定, 根据标准溶液的谱图进行定性, 根据校正因子进行定量。
游离脂肪酸含量的计算: 根据被测物和内标物的质量及在色谱图上相应的峰面积比, 由校正因子按下式求游离脂肪酸的含量:
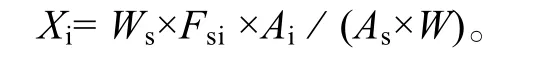
其中, Xi为样品脂肪酸i的含量; Ws为样品中加入内标物的质量; As为内标物的峰面积; Ai为脂肪酸i的峰面积; W 为样品藻粉质量; Fsi为相对校正因子,计算公式如下:
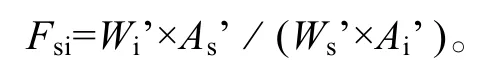
其中, Wi’为标准品脂肪酸i的质量; As’为标准品中内标物的峰面积; Ws’为标准品中内标物的质量;Ai’为标准品中脂肪酸i的峰面积。
2 结果与讨论
2.1 浒苔脂肪酸前处理优化
2.1.1 皂化试剂对浒苔脂肪酸浓度的影响
皂化试剂是浒苔脂肪酸前处理过程中影响因素之一。本实验在前人文献基础上, 选用 NaOHCH3OH溶液、KOH-CH3OH溶液作为皂化试剂。实验结果表明, 两种皂化试剂制备的脂肪酸浓度相差不大, 说明皂化试剂对脂肪酸浓度影响较小。结合文献与实际, 选用KOH-CH3OH溶液作为皂化试剂。
2.1.2 皂化时间对浒苔脂肪酸浓度的影响
在皂化试剂KOH-CH3OH溶液5 mL、皂化温度60 ℃、甲酯化试剂HCl-CH3OH溶液4 mL、甲酯化时间20 min、甲酯化温度60 ℃的条件下考察水浴时间对浒苔脂肪酸浓度的影响结果如图1所示。
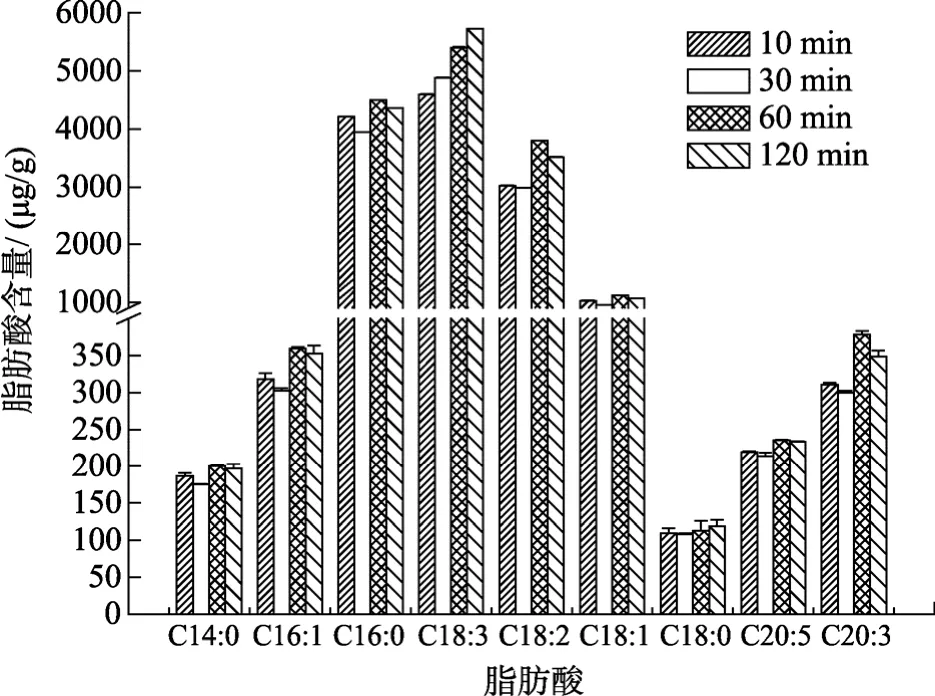
图1 不同皂化时间的脂肪酸浓度Fig. 1 The concentrations of fatty acids at different saponification times
从图 1中可以看出, 大多数脂肪酸含量随皂化时间的增加出现先增后降的趋势, 皂化时间小于60 min时, 脂肪酸浓度随时间的增加而增加, 当皂化时间超过 60 min, 脂肪酸的含量随时间的延长呈现下降的趋势。说明皂化时间对皂化效率有重要影响, 时间短可能导致样品皂化不完全, 过长一方面造成时间的浪费, 另一方面, 皂化时间过长可能会引起脂肪酸的损失。故选用60 min作为皂化时间。
2.1.3 皂化温度对浒苔脂肪酸浓度的影响
保持皂化试剂KOH-CH3OH溶液5 mL、皂化时间60 min、甲酯化试剂HCl-CH3OH溶液4 mL、甲酯化时间20 min、甲酯化温度60 ℃的条件不变, 考察水浴温度对浒苔脂肪酸浓度的影响作用, 结果如图2所示。
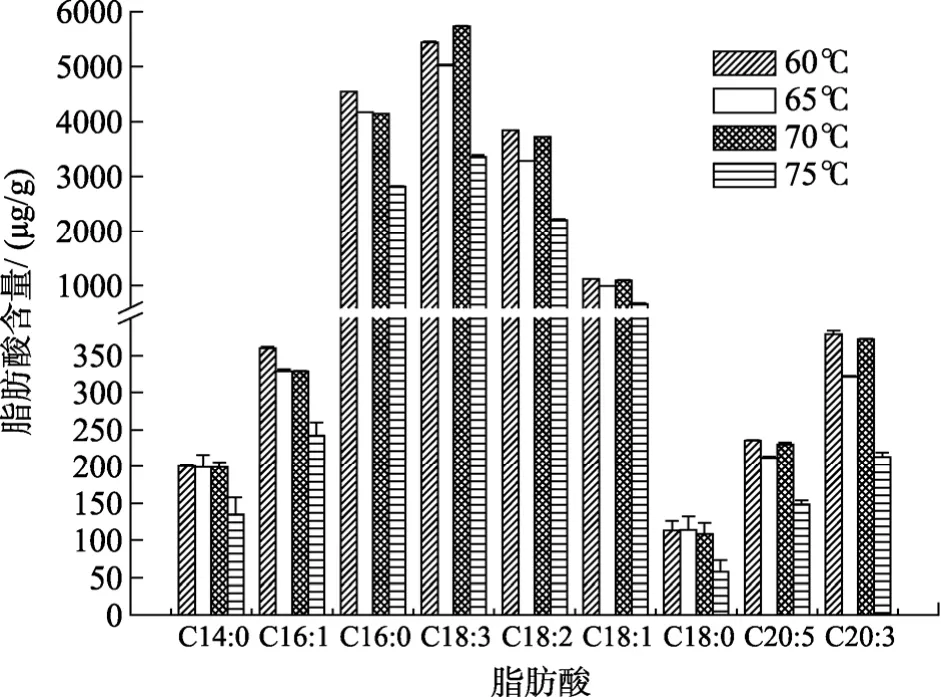
图2 不同皂化温度的脂肪酸浓度Fig. 2 The concentrations of fatty acids at different saponification temperatures
由图2可知, 除C18:3外, 绝大多数脂肪酸的含量在水浴温度为60 ℃时最高, 其次是70 ℃和65 ℃,75 ℃时脂肪酸的含量最低。此外, 从不同反应条件的实验反应过程上看, 水浴温度过高会引起溶剂不同程度的蒸发, 可能导致有效成分的损失。综合以上因素, 水浴温度采用 60 ℃为宜。
2.1.4 甲酯化试剂对浒苔脂肪酸浓度的影响
脂肪酸甲酯化溶剂大多为酸性甲醇溶液, 根据文献报道, 本实验选取最常用的HCl-CH3OH溶液和BF3-CH3OH溶液, 比较它们对脂肪酸浓度的影响,实验结果如图3所示。

图3 不同甲酯化试剂的脂肪酸浓度Fig. 3 The concentrations of fatty acids by different methyl esterification reagents
从图3中可以看出, 除C18:0外, HCl-CH3OH溶液甲酯化所得脂肪酸浓度显著高于经BF3-CH3OH溶液甲酯化所得脂肪酸的浓度。且BF3-CH3OH溶液作为甲酯化试剂的重现性较差。原因主要是, 其一, 工业用BF3-CH3OH溶液成品的沸点为59 ℃, 实验水浴温度大于其沸点, 温度过高, 可能影响甲酯化试剂的作用, 从而影响浒苔脂肪酸浓度。其二, BF3溶剂对光非常敏感需要避光保存, 在实验过程中很难满足这个条件。综合以上因素, 确定HCl-CH3OH溶液为甲酯化试剂。
2.1.5 甲酯化时间对浒苔脂肪酸浓度的影响
在皂化试剂KOH-CH3OH溶液5 mL、皂化温度60 ℃、皂化时间 60 min、甲酯化试剂 HCl-CH3OH溶液 4 mL、甲酯化温度 60 ℃的条件下, 考察甲酯化时间对产物中脂肪酸浓度的影响, 结果见图4。
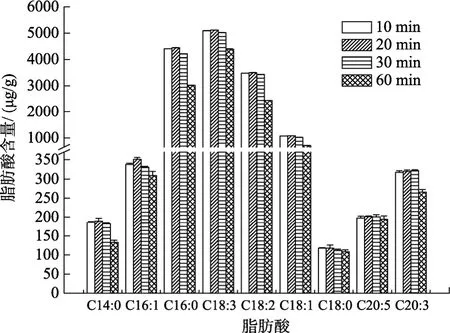
图4 不同甲酯化时间的浒苔脂肪酸浓度Fig. 4 The concentrations of fatty acids at different methyl esterification times
由图 4可知, 甲酯化时间从 10 min增加到 20 min时, 浒苔脂肪酸的浓度逐渐增大, 甲酯化时间为20 min时, 产物的浓度达到最大值。随后增加甲酯化时间, 脂肪酸浓度不增加反而减少。这说明甲酯化时间过短, 甲酯化过程不完全, 时间太长可能引起脂肪酸的损失, 因此, 较短的甲酯化时间更有利于甲酯化反应的进行。故选择20 min作为甲酯化时间。
2.1.6 甲酯化温度对浒苔脂肪酸浓度的影响
保持皂化试剂KOH-CH3OH溶液5 mL、皂化温度60 ℃、皂化时间60 min、甲酯化试剂HCl-CH3OH溶液4 mL、甲酯化时间20 min的条件不变, 考察了温度对浒苔脂肪酸甲酯化过程的作用影响, 结果见图 5。

图5 不同甲酯化温度的脂肪酸浓度Fig. 5 The concentrations of fatty acids at different methyl esterification temperatures
由图5可知, 随着甲酯化温度的增加, 大部分脂肪酸浓度成降低趋势。随着甲酯化水浴温度增加, 甲酯化试剂有不同程度的损失, 温度越高损失越大,这说明, 温度的增加不利于脂肪酸甲酯化过程。因此,甲酯化温度为60 ℃最佳。
2.2 脂肪酸前处理方法精密度、重现性
2.2.1 精密度实验
取浒苔样品1份, 在优化条件下制备供试液, 采用1.3.2所述色谱条件, 连续进样5次, 结果9种脂肪酸相对保留时间和相对峰面积的相对标准偏差(RSD)分别在 0~0.19%和 0.38%~3.25%的范围内,说明该方法精密度良好。
2.2.2 重现性实验
取同一批号浒苔样品 5份, 按优化条件下制备供试液, 分别测定脂肪酸。结果9种脂肪酸相对保留时间和相对峰面积相对标准偏差(RSD)分别为 0~0.31%和 0.65%~5.8%。表明该方法的重现性良好,符合测定的要求。
2.3 浒苔脂肪酸GC/MS分析
根据上述脂肪酸前处理方法, 对福建霞浦、江苏和青岛 3个海区的浒苔检测, 得出浒苔脂肪酸的总离子色谱图, 经质谱分析后, 由NIST5.0标准图谱库进行检索, 确定脂肪酸中的各个组分, 并用内标进行定量, 结果见表1。
由表1可知, 福建、江苏、青岛的浒苔脂肪酸种类相同, 均检出9种脂肪酸。福建霞浦浒苔样品脂肪酸各组分的含量在0.10~5.69 mg/g之间, 江苏浒苔脂肪酸范围是 0.16~8.59 mg/g, 青岛为 0.10~4.76 mg/g。其中, C16:0、C18:1、C18:2、C18:3四种脂肪酸在3个海区浒苔中的含量均最高, 可以看出浒苔脂肪酸以C16和C18为主。此外, 分析结果发现浒苔样品含有多种多不饱和脂肪酸(PUFA), 据现有文献报道[21], PUFA对抗肿瘤、免疫活性调节等方面发挥重要的作用。
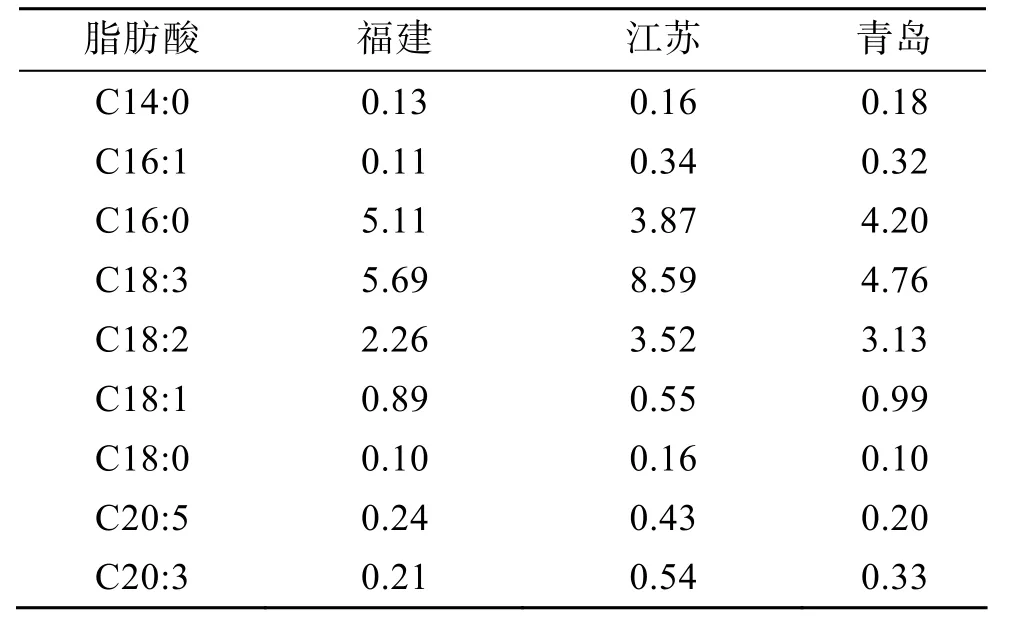
表1 浒苔脂肪酸组成及其含量(mg/g)Tab. 1 Compositions and contents of fatty acids in enteromorpha prolifera (mg/g)
3 结论
以脂肪酸的浓度作为评价指标, 采用单因素分析优化浒苔脂肪酸的前处理方法, 结合实际, 确定浒苔脂肪酸前处理的最佳条件为, 以 KOH-CH3OH溶液为皂化试剂, 60 ℃水浴环境下皂化60 min; 以HCl-CH3OH溶液为甲酯化试剂, 60 ℃水浴甲酯化20 min。
通过对福建, 江苏及青岛浒苔的实际样品分析,发现3种不同海域的浒苔组分相同, 均检出9种脂肪酸, 且各种脂肪酸的含量较为相似。此外, 3个海区浒苔脂肪酸均含有多种 PUFA, 参考其重要作用, 可进行进一步实验研究。
[1] 杨佰娟, 郑立, 陈军辉, 等. 黄渤海漂移浒苔(Enteromorpha prolifera)脂肪酸组成及聚类分析的研究[J]. 海洋与湖沼, 2009, 40(5): 627-632.
[2] 张乐, 蒲新明, 梁彦娟, 等. 必需脂肪酸在海洋食物链中的作用[J]. 海洋科学, 2009, 33(4): 66-71.
[3] 朱路英, 张学成, 宋晓金, 等. n-3 多不饱和脂肪酸DHA、EPA研究进展[J]. 海洋科学, 2007, 31(11): 78-85.
[4] 乔方利, 马德毅, 朱明远, 等. 2008年黄海浒苔爆发的基本状况与科学应对措施[J]. 海洋科学进展, 2008,26(3): 409-410.
[5] 迟玉森. 新型海洋食品[M]. 北京: 中国轻工业出版社, 1999. 121-123.
[6] Fleurence J. Seaweed proteins: biochemical, nutritional aspects and potential uses[J]. Trends Food Sci Technol,1999, 10: 25-28.
[7] Wong K H, Peter C K. Nutritional evaluation of some subtropical red and green seaweeds Part I –proximate composition, amino acid profiles and some physicochemical properties[J]. Food Chem, 2000, 71:475-482.
[8] 蒋霞敏, 郑亦周. 14种微藻总脂含量和脂肪酸组成研究[J]. 水生生物学报, 2003, 27(3): 243-246.
[9] 陈昱, 刘广发, 周韬, 等. 7种(13株)杜氏藻的总脂含量和脂肪酸组成[J]. 台湾海峡, 2007, 26(4): 516-521.
[10] 李宪璀, 范晓, 韩丽君, 等. 中国黄、渤海常见大型海藻的脂肪酸组成[J].海洋与湖沼, 2002, 33(2):215-224.
[11] 徐继林, 严小军. 脂类分析在海洋微藻化学分类学上的研究进展[J]. 海洋通报, 2004, 23(2): 65-72.
[12] 许河峰. 基于脂肪酸组成的海洋微藻化学计量学分类研究[J]. 海洋通报, 2003, 22(3): 69-72.
[13] 邓青, 张晓梅. 气相色谱/质谱联用分析测定螺旋藻脂肪酸组成[J]. 云南名族学院学报(自然科学版),2003, 12(1): 37-38.
[14] 范维燕, 林家永, 邢邯.稻谷脂肪酸值测定条件优化与比较的研究[J]. 粮食储藏, 2008, 37(6): 35-38.
[15] 廖启斌, 李文权, 陈清花, 等. 海洋微藻脂肪酸的气相色谱分析[J]. 海洋通报, 2000, 19(6): 66-71.
[16] 徐继林, 严小军, 周成旭, 等. 19种(株)海洋微藻脂肪酸组成及充气产生的影响[J]. 宁波大学学报(理工版), 2006, 19(2): 180-185.
[17] 徐继林, 严小军, 朱艺峰, 等.一种饵料微藻的脂肪酸甾醇分析及化学分类的探讨[J]. 海洋学报, 2005,27(4): 121-126.
[18] 徐年军, 张学成. 温度、光照、pH值对后棘藻生长及脂肪酸含量的影响[J].青岛海洋大学学报, 2001, 31(1):541-547.
[19] 叶新荣, 朱桂海. 海水悬浮物质中脂肪酸的毛细管气相色谱测定[J]. 海洋与湖沼, 1992, 23(6): 666-676.
[20] 马夏军, 洪爱华, 梁智渊, 等.中国南海总状蕨藻中脂肪酸和甾醇 GC-MS分析[J]. 广东化工, 2005, 4:19-21.
[21] 许河峰. 30种海洋绿藻的脂肪酸分类与评价[J]. 海洋科学, 2003, 27(8): 77-80.
Received: Dec, 10, 2009
Key words:green tide; fatty acids; saponification; methyl esterification
Abstract:For quick chemical traceability and resource utilization, a new pre-treatment method was developed for determination of fatty acids of enteromorpha prolifera. Operational parameters including reagents, time, and temperature for the saponification and methyl esterification which are expected to impact on the recoveries of analytes were optimized. The result indicated high precision (0.38%~3.25%) and the low relative deviation (0.65%~5.8%) of this new method. Moreover, by this method, fatty acids contents of enteromorpha prolifera at Fujian, Jiangsu, and Qingdao were determined to be 0.10~5.69, 0.16~8.59, and 0.10~4.76 mg/g, respectively. This method is appropriate for routine operations.
(本文编辑: 康亦兼)
Optimization and analyzation of fatty acids pre-treatment of enteromorpha prolifera by GC/MS
YIN Lin-lin1,2, YANG Bai-juan2, ZHENG Li2, HAN Xiao-tian3, WANG Neng-fei2,WANG Xiao-ru2, YANG Dong-fang1
(1. College of Aqua-life Science and Technology, Shanghai Fisheries University, Shanghai 200090, China; 2.Research Center for Marine Ecology, The First Institute of Oceanography, SOA, QingDao 266061, China;3.Institute of Oceanology, Chinese Academy of Science, Key Lab of Marine Ecology and Environmental Science, Qingdao 266071, China)
P731.21
A
1000-3096(2010)11-0046-05
2009-12-10;
2010-04-20
海洋公益性行业科研专项项目(200805039); 国家自然科学基金项目(20602009, 40776098); 青岛市科技计划项目(08-1-3-10-JCH);国家海洋局第一海洋研究所基本科研业务费专项资金项目(2008G47,2008T32).
尹琳琳(1985-), 女, 山东济南人, 硕士研究生, 主要从事海洋生物化学研究, 电话: 0532-88966705, E-mail: linyinyl@126.com; 郑立, 通信作者, 电话: 0532-88961802; E-mail:zhengli@fio.org.cn
