Cu2+和Cd2+对斑马鱼胚胎早期发育的联合毒性
2010-09-23张亚辉刘征涛王一喆闫振广杨霓云
张亚辉,刘征涛,王一喆,闫振广,王 宏,杨霓云
中国环境科学研究院,国家环境保护化学品生态效应与风险评估重点实验室,北京 100012
Cu2+和Cd2+对斑马鱼胚胎早期发育的联合毒性
张亚辉,刘征涛*,王一喆,闫振广,王 宏,杨霓云
中国环境科学研究院,国家环境保护化学品生态效应与风险评估重点实验室,北京 100012
采用斑马鱼胚胎早期发育技术,测定Cu2+和Cd2+2种重金属对胚胎发育的毒性效应.以24 h致死和72 h胚胎孵化抑制为毒性终点,2种重金属的剂量-效应曲线可用Weibull函数或Logit函数有效描述,由最佳拟合函数计算得出半数致死浓度(LC50)或半数效应浓度(EC50)为毒性效应的评价标准,2个毒性终点的重金属毒性大小顺序均为Cu2+>Cd2+.应用浓度加和(CA)与独立作用(IA)2种模型,对72 h孵化抑制率的无观测效应浓度(NOEC)配比混合物的联合毒性作用进行了预测,通过混合物试验观测数据的95%置信区间与CA模型和IA模型预测的剂量-效应曲线进行比较分析表明,2种模型都可以有效预测斑马鱼胚胎孵化的联合毒性.
重金属;联合毒性;斑马鱼胚胎;浓度加和;独立作用
Abstract:The toxicities of two heavy metals Cu2+and Cd2+to embryo development were determined using the zebrafish embryo early development toxicity technique.The dose-response curves of the two heavy metals could be effectively characterized by the Logit and Weibull functions on the two toxicity endpoints of 24 h lethal rate and 72 h hatch inhibition rate.The median lethal concentration (LC50)and the median effect concentration(EC50)calculated by the best-fitted functions were used as the toxicity evaluation criteria. The toxicity order of the two heavy metals on the two observed toxicity endpoints according to the value of either LC50or EC50both showed that Cu2+>Cd2+.The joint toxicity was predicted using themixture ratio of the non-observed effect concentration(NOEC)of 72 h hatch inhibition rate by two models of concentration addition(CA)and independent action(IA),then compared with the 95% confidence intervals of the mixture experimental data.The results indicated that the two models could both predict joint toxicity of zebrafish embryo hatching effectively.
Keywords:heavy metal;joint toxicity;zebrafish embryo;concentration addition;independent action
重金属污染已成为我国水环境污染日益突出的问题之一,在诸多河流[1-2]及河口海岸[3-4]环境水体中都可检测到多种重金属超出相应的水质标准限值.由于水生生物一般都暴露于多种重金属组成的混合物中,即使单一重金属低于相应的水质基准或标准限值,多种重金属共存也可能对水生生物产生显著的联合毒性作用[5].SPEHAR 等[6]报道了As5+,Cd2+,Cr5+,Cu2+,Hg2+和 Pb2+6种重金属在美国水质基准水平(1986年)下对虹鳟鱼和呆头鱼以及大型蚤的联合毒性效应,结果表明,在基准最大浓度(CMC)下重金属混合物对虹鳟鱼和大型蚤造成几乎100%的致死毒性,基准连续浓度(CCC)的混合暴露则显著抑制了大型蚤的繁殖和呆头鱼的生长.ENSERINK等[7]报道了As5+,Cd2+,Cr5+,Cu2+,Hg2+,Pb2+,Ni2+和 Zn2+8种重金属在荷兰水质基准安全限值下造成96%大型蚤和50%鲑鱼幼体死亡的联合毒性,该试验结果促使荷兰重新修订水质基准.OTITOLOJU等[8]采集 Lagos湖的底栖生物,调查了 Cu2+,Zn2+,Pb2+,Cd2+和 Hg2+5种重金属的联合毒性作用,建议制订重金属的环境实际安全限值或水质基准考虑联合毒性作用特别是重金属混合物的协同作用.COOPER等[9]报道了Cu2+,Pb2+和Zn2+在美国水质基准CCC和加拿大水质基准下,对 2 种 蚤 类 (Ceriodaphniadubia和Daphnia carinata)产生了显著的急性联合毒性和慢性联合毒性.因此,为有效地评价环境水体中重金属的环境风险,制订对水生生物更加“安全”的环境阈值,需要考虑重金属混合物的联合毒性作用.
鱼类胚胎用于环境污染物的风险评价,对大多数污染物来说比成鱼急性毒性试验灵敏度更高[10].为保护鱼类的整个生命周期,对重金属的鱼类早期发育的联合毒性进行研究,将有利于制订更严格的水质基准或标准来保护水生态系统.斑马鱼胚胎在整个早期发育阶段受精卵透明性很好,可对约20种效应指标进行观察分析[11],与成鱼致死率这个单一指示终点相比,更有利于揭示污染物的毒性作用机制.因此,斑马鱼胚胎试验广泛用于各种污染物[12-15]的毒性调查中.迄今为止,关于重金属对斑马鱼胚胎试验单一毒性的研究已有诸多报道[16-18],但仅有少数研究对重金属的斑马鱼胚胎联合毒性进行了探讨[19].重金属对斑马鱼胚胎的联合毒性研究多集中在较高浓度(如EC50或LC50)下的联合毒性作用,关于重金属在低浓度〔如无观测效应浓度(NOEC)〕下的联合毒性鲜见报道.
通过研究重金属Cu2+和 Cd2+对斑马鱼胚胎在不同发育时期的毒性效应,获得敏感的毒性观察终点——72 h胚胎孵化抑制率,研究了该敏感毒性终点下无观测效应浓度(NOEC)配比重金属混合物对斑马鱼孵化的联合毒性作用.笔者以混合物试验观测数据的95%置信区间与浓度加和(Concentration Addition,CA)及独立作用(Independent Action,IA)2个模型预测的剂量-效应曲线进行比较分析,获得基于试验观测数据置信区间的低浓度下重金属混合物对斑马鱼胚胎早期发育的联合毒性作用,为环境水体中Cu2+和Cd2+的生态风险评价与水质基准和标准的制订提供科学依据.
1 试验部分
1.1 试剂
CuSO4·5H2O,CdCl2·2.5H2O,CaCl2·2H2O,MgSO4·7H2O,KCl和NaHCO3等试剂均为分析纯,用去离子水配制成储备液备用.按照 ISO 7346-3标准稀释水的比例加入一定体积的无机盐储备液,用充分曝气的去离子水稀释成试验溶液,充分震荡后,放入(26±1)℃培养箱中过夜备用.
1.2 试验方法
采用实验室长期稳定培养的斑马鱼,鱼龄为4~12 m,雌雄比为1∶2,水温为(26±1)℃,光照黑暗比为14 h∶10 h.饲养用水为经过充分曝气的标准稀释水(ISO 7346-3),pH为 7.5±0.2,硬度(以CaCO3计)为175 mg/L左右.每日喂食2次新鲜孵化的活卤虫,1次虾片.晚上关灯后或早上开灯前放入玻璃制鱼卵收集器,鱼卵收集器用2 mm绿色塑料网覆盖在玻璃盒之上,插上绿色塑料仿真水草吸引鱼在收集器上产卵,开灯30 min后开始收集鱼卵,用标准稀释水快速冲洗2~3次,去除残留物后,用立体显微镜挑出分裂正常的受精卵,在1 h内暴露于染毒溶液中开始试验.
选用24孔细胞培养板进行试验,根据预试验结果,每个重金属或混合物设置10~12个浓度,各浓度设置3个平行.每个培养板的第1列4个孔加入2 m L标准稀释水作为空白对照,其余20个孔加入2 m L重金属溶液或其混合物的同一浓度的染毒溶液,然后放入1枚正常发育的受精卵,用胶带密封盖子和培养板以避免溶液蒸发,置于(26±1)℃的培养箱中.
1.3 数据处理与统计
参照文献[16,20]记录的染毒过程中胚胎发育的Cu2+和Cd2+具有代表性的毒性终点,选择24 h致死率和72 h孵化抑制率对剂量 -效应关系进行分析,采用Logit函数和 Weibull函数进行非线性最小二乘拟合,选择拟合相关系数(R)越高或均方根误差(RMSE)越低的函数为最佳拟合函数;同时采用文献[21]中的方法,应用Matlab程序计算单一污染物及混合物的试验观测数据的95%置信区间,所得数据用 Origin 7.5绘图.无观测效应浓度(NOEC)由Dunnett检验[22]确定.
1.4 斑马鱼早期发育联合毒性的预测模型
采用混合物联合毒性分析中广泛应用的2个模型——浓度加和(CA)模型与独立作用(IA)模型,针对Cu2+和Cd2+混合物对斑马鱼胚胎孵化的联合毒性进行预测.其中CA模型用于预测具有相同或相似作用机制的化学物质的联合毒性作用[23-24],计算公式:
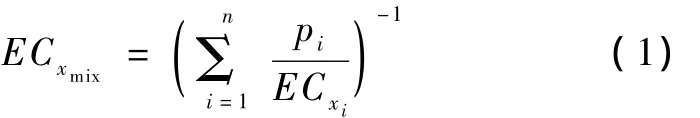
式中,ECxi为混合物中i组分单独产生x%效应时的浓度;ECxmix为产生效应x%的混合物浓度;pi为i组分的浓度占混合物浓度的百分比;n为混合物组分数.
IA模型一般用来预测相异毒性作用机制的化学物质组成的混合物毒性[25],计算公式:

式中,E(cmix)为混合物总浓度(cmix)产生的总效应;E(ci)为混合物中i组分浓度(ci)单独产生的效应.
2 结果与讨论
2.1 Cu2+和Cd2+对斑马鱼胚胎发育的剂量-效应关系分析
重金属Cu2+和Cd2+对斑马鱼胚胎发育的2个毒性终点24 h致死率和72 h孵化抑制的剂量-效应数据点、拟合曲线及观测数据的95%置信上限和下限曲线分别绘于图1(Cu2+)和图2(Cd2+).从图1,2可以看出,2种重金属的24 h致死率和72 h孵化抑制率与毒物浓度间呈“S”状.观测的剂量-效应数据分别用Logit函数和Weibull函数进行非线性拟合,拟合函数及其参数和相关统计量〔相关系数(R)和均方根误差(RMSE)〕列于表1.从表1看出,非线性拟合的R值均大于0.96,RMSE均小于0.1,2个函数都可以很好地描述 Cu2+和 Cd2+对斑马鱼胚胎的24 h致死率和72 h孵化抑制率之间的剂量-效应关系.根据最佳非线性函数的选择原则,以及 Cu2+和 Cd2+对斑马鱼胚胎 24 h致死率与Cd2+的72 h胚胎孵化抑制率的剂量-效应关系,选择Weibull函数为最佳拟合函数,Cu2+的72 h胚胎孵化抑制率选择Logit为最佳函数.另外,用Matlab程序计算得到观测数据的95%置信区间的上限和下限[21],可有效表征试验数据点的变化范围.

图1 Cu2+对胚胎24 h致死率和72 h孵化抑制率的剂量-效应关系Fig.1 The dose-response relationship of Cu2+of 24 h lethal rate(a)and 72 h hatch inhibition rate(b)
利用表1中最佳拟合函数的 2个参数 α和 β值,可以计算出Cu2+和Cd2+对24 h胚胎致死和72 h孵化抑制的致死浓度或效应浓度,24 h半数致死浓度(LC50)和72 h半数效应浓度(EC50)及95%的置信区间见表1.随着重金属浓度的增大,斑马鱼胚胎24 h致死率和72 h孵化抑制率均呈增大趋势.以24 hLC50或72 hEC50数值为毒性效应的评判标准,2个毒性终点的毒性大小顺序均为 Cu2+>Cd2+.其中2种重金属的24 hLC50相差1个数量级,从 4.99 μmol/L(Cu2+)到 94.56 μmol/L (Cd2+),而72 h孵化抑制率的EC50相差3个数量级,从 0.41 μmol/L(Cu2+)到 29.28 μmol/L (Cd2+).2种重金属的72 h孵化抑制率的EC50值都比24 hLC50值小,因此,2种重金属对斑马鱼胚胎的敏感指标为72 h孵化抑制率.2种重金属在72 h孵化抑制率的无观测效应浓度(NOEC)数值大小顺序与72 h孵化抑制率一致,从0.20μmol/L(Cu2+)到18.00μmol/L(Cd2+),相差3个数量级.

图2 Cd2+对胚胎24 h致死率和72 h孵化抑制率的剂量-效应关系Fig.2 The dose-response relationship of Cd2+of 24 h lethal rate(a)and 72 h hatch inhibition rate(b)
JOHNSON等[16]用Plumouth城市自来水为参照溶液〔Cu2+的背景值为(10.70±0.98)μg/L〕,研究了 Cu2+对斑马鱼胚胎发育的形态和功能的影响.胚胎发育24 hLC50约为327μg/L,与该文报道的24 hLC50(317μg/L)基本一致.另外,JOHNSON等[16]报道了50μg/L Cu2+可对斑马鱼胚胎孵化产生抑制作用,这与表1中的结果相差较大,可能与 Cu2+染毒溶液中标准稀释水中离子浓度有关,具体原因尚待进一步研究.
CHENG等[20]从细胞和分子水平上研究了Cd2+对斑马鱼胚胎的致死效应和各种致畸效应,28 h的LC50为168μmol/L,致死效应和致畸效应产生的EC50为138μmol/L.其中LC50值为该文中24 hLC50的1.78倍,其原因可能是因为文献[20]报道的是28 h胚胎的致死效应,比该文中胚胎暴露的时间长;另外,最重要的是胚胎染毒开始的时间不同,该文采取受精1 h内的胚胎染毒,而文献[20]在胚胎正常发育5 h后才开始染毒.此外,胚胎暴露于污染物中的发育阶段不同,胚胎灵敏度也会有所变化. GELLERT等[26]在研究斑马鱼胚胎对不同浓度废水的敏感性时发现,在斑马鱼胚胎发育早期阶段,卵膜对外界污染的通透性会随着胚胎的生长逐渐降低,特别是前4 h.端正花等[27]考察了0 h和8 h染毒2种不同方式下己烯雌酚对斑马鱼胚胎的亚致死效应,其中48 h心率变缓和72 h孵化抑制的EC50值分别从0.24 mg/L(0 h染毒)增至0.46 mg/L(8 h染毒),从0.14 mg/L(0 h染毒)增至0.33 mg/L(8 h染毒),表明染毒开始时间不同对斑马鱼胚胎早期发育毒性会产生很大影响.
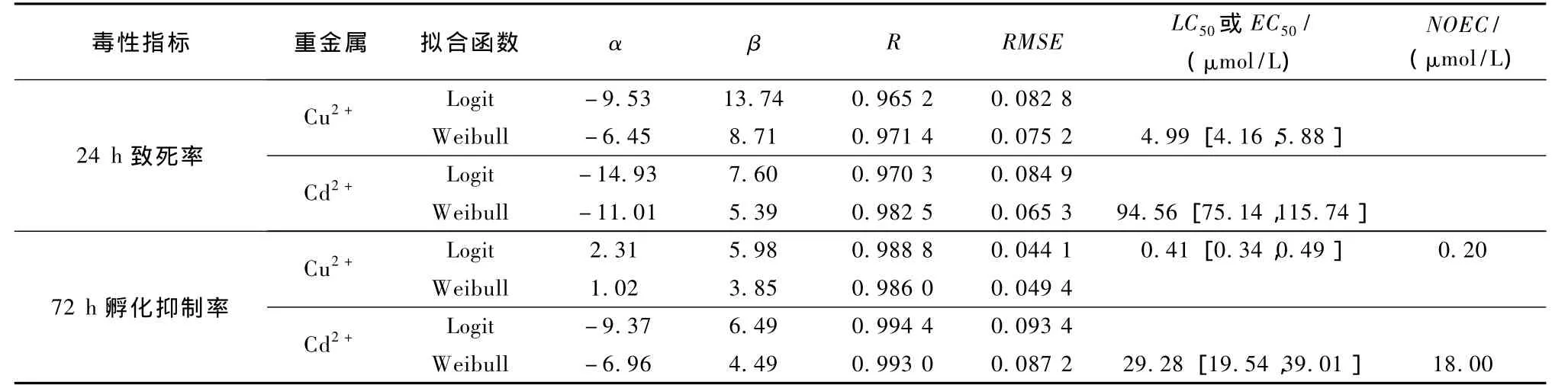
表1 Cu2+和Cd2+对胚胎24 h致死率和72 h孵化抑制率的剂量-效应曲线的拟合函数及相关统计量Table 1 The dose-response functions of Cu2+and Cd2+and some statistics of 24 h lethal rate and 72 h hatch inhibition rate
2种重金属对瓯江彩鲤[28](C.carpiovar.color)和泽蛙蝌蚪[29]的急性毒性研究中,不同时间毒性顺序均表现为Cu2+>Cd2+,这与该文报道的毒性顺序一致.但对不同受试生物(如对淡水发光菌青海弧菌Q67[30])的发光抑制,毒性大小顺序为 Cd2+>Cu2+.不同受试生物可能由于自身生理机能不同对重金属的敏感性存在很大差异.此外,不同生物发育阶段、试验条件以及重金属离子的形态等都可能对重金属的毒性产生较大影响[31].
斑马鱼胚胎及仔鱼暴露于重金属 Cu2+和 Cd2+溶液中产生的各种畸形如图3所示.与48 h正常发育胚胎〔见图3(a)〕相比,0.6μmol/L Cu2+暴露组胚胎出现了心包囊肿〔见图3(c)〕和尾部弯曲〔见图3(e)〕,Cd2+(18μmol/L)染毒组也产生了心包囊肿〔同图3(e)〕.与72 h正常孵化的仔鱼〔见图3 (b)〕相比,0.2μmol/L Cu2+暴露组胚胎出现了心包囊肿〔见图3(d)〕,8μmol/L Cd2+出现了心包囊肿和尾部弯曲〔见图3(f)〕.2种重金属造成的胚胎畸形与文献[16]报道的斑马鱼胚胎和仔鱼产生心包囊肿、尾部弯曲等畸形情况相同.

图3 正常发育和非正常发育斑马鱼胚胎和仔鱼Fig.3 Normal and abnormal zebrafish embryo and larva fish
2.2 Cu2+和Cd2+混合物的联合毒性
选择Cu2+和 Cd2+敏感的毒性终点——72 h胚胎孵化抑制,考察在该毒性终点下NOEC配比混合物对斑马鱼胚胎孵化抑制的联合毒性,运用浓度加和(CA)和独立作用(IA)2个模型预测联合毒性,并与混合物试验观测数值的95%置信区间进行比较分析,获得 Cu2+和 Cd2+对斑马鱼胚胎孵化的联合毒性.2种重金属NOEC配比混合物的总剂量-效应曲线以及观测数据的95%置信区间,与CA和IA 2个模型的预测曲线见图4(a).从图4可以看出,CA和IA 2个模型预测的剂量-效应曲线都分布在混合物观测数据的95%置信区间内,CA模型预测的联合毒性效应要比IA模型预测结果高,2个模型在高浓度和低浓度范围预测较为接近.在30% ~65%效应水平中,IA预测曲线与95%置信下限曲线几乎重合.CA模型预测的混合物毒性效应在测定浓度范围内产生比较精确的结果,2种重金属NOEC配比混合物在72 h胚胎孵化抑制效应产生了明显的加和特征.从混合物观测数据的95%置信区间来看,2个模型都可对NOEC配比混合物的联合孵化抑制率进行预测.从整体上来看,CA模型对NOEC配比混合物的斑马鱼胚胎72 h孵化抑制效应预测结果要比 IA模型预测结果准确,IA模型倾向于低估混合物的联合毒性效应.
为了预测Cu2+和Cd2+在各自NOEC下对斑马鱼胚胎的联合毒性,选择混合物总浓度cmix等于2种重金属NOEC总和这一点〔见图4(a)中箭头标出的点〕,比较分析了单一重金属污染物的毒性效应与观测的联合毒性效应以及CA和IA 2个模型预测的联合毒性效应.图4(b)为混合物毒性(Obs)与2种重金属(Cu2+,Cd2+)以及CA模型预测效应(CA)和IA模型预测效应(IA)的对比.在72 h孵化抑制率的NOEC下,Cu2+(0.20μmol/L)和 Cd2+(18.0 μmol/L)分别产生了13.36%和23.52%的孵化抑制效应,2种重金属在该浓度下的混合物浓度为18.20μmol/L,对斑马鱼胚胎孵化产生了38.75%的联合抑制毒性.CA模型和IA模型在该浓度下的预测效应分别为56.50%和33.74%,与混合物试验观测毒性(Obs)相对偏差分别为45.82%(绝对值)和12.94%.CA模型对混合物的联合孵化抑制率的预测结果偏高,观测的混合物效应与IA预测结果较为接近.但是,从图4(a)可以看出,混合物的4次平行试验的观测数据均分布在剂量-效应曲线的95%置信区间内,因此,CA和IA 2个模型都可对混合物产生的孵化联合抑制毒性进行预测.
6种有机磷杀虫剂对青海弧菌Q67的联合毒性研究发现,CA模型和IA模型对混合物的毒性效应预测结果相近,2个模型都能够对有机磷杀虫剂的联合发光毒性进行有效预测[24];JUNGHANS等[32]研究了 8种磺酰脲除草剂对绿藻(Scenedesmus vacuolatus)的联合毒性,结果发现,CA对除草剂混合物毒性产生比较精确的预测,但 CA模型预测的剂量-效应曲线与IA模型的预测结果相差较小.在对2种重金属混合物的联合孵化抑制毒性研究中,2个模型预测的剂量-效应曲线存在一定的差别,但都分布在混合物试验观测数据的95%置信区间内,因此也认为,CA模型和 IA模型都能对重金属 Cu2+和Cd2+的斑马鱼胚胎孵化的联合毒性进行预测.
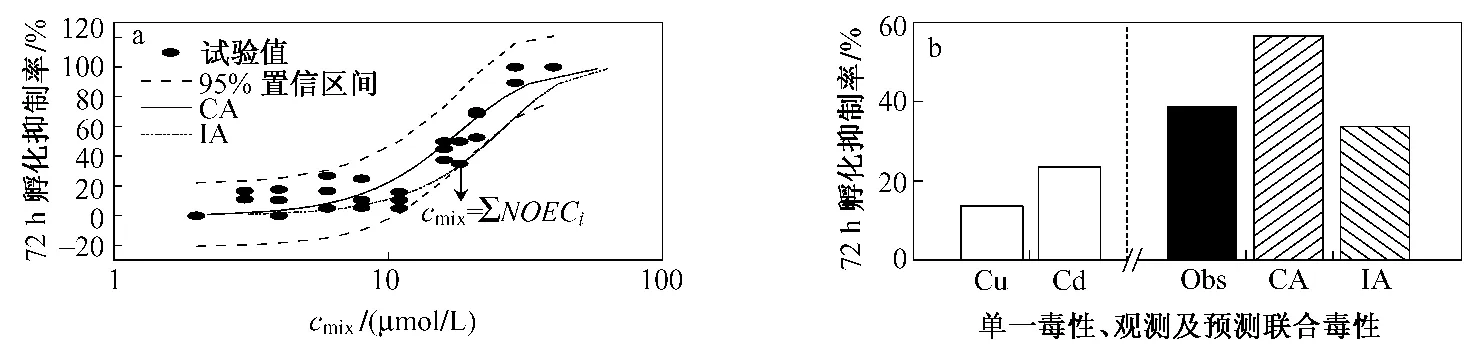
图4 72 h孵化抑制率NOEC配比混合物对斑马鱼胚胎孵化抑制的剂量-效应曲线与混合物的联合毒性(Obs)与单一重金属毒性,CA模型预测毒性和IA模型预测毒性比较Fig.4 The dose-response relationship of the m ixture in the ratio of NOEC on 72 h hatch inhibition rate(a)and comparison of the joint toxicity(Obs)and single toxicity of the heavy metals with CA prediction(CA)and IA prediction(IA)(b)
3 结论
a.重金属Cu2+和Cd2+对斑马鱼胚胎具有明显的毒性作用,以LC50或EC50为毒性效应评价标准,所观察的24 h致死和72 h孵化抑制2个毒性终点,毒性大小顺序均为 Cu2+>Cd2+,其中72 h孵化抑制表现为较敏感的毒性终点.
b.应用浓度加和(CA)与独立作用(IA)2个模型对72 h孵化抑制NOEC配比的重金属混合物进行的预测发现,CA模型预测的联合效应大于 IA模型,在观测数据的95%置信区间范围内,2个模型都可有效预测 2种重金属混合物的联合孵化抑制毒性.
致谢:斑马鱼的养殖和胚胎毒性试验得到南开大学朱琳教授和端正花老师的大力帮助和指导,在此表示衷心的感谢.
[1]池俏俏,朱广伟.太湖梅梁湾水体悬浮颗粒物中重金属的含量[J].环境化学,2005,24(5):582-585.
[2]王李鸿,角媛梅,明庆忠,等.云南省沘江流域水体重金属污染评价[J].环境科学研究,2009,22(5):595-600.
[3]孟伟,刘征涛,范薇.渤海主要河口污染特征研究[J].环境科学研究,2004,17(6):66-69.
[4]傅瑞标,何青.长江口南槽重金属的分布特征[J].中国环境科学,2000,20(4):357-360.
[5]BIESINGER K E,CHRISTENSEN G M,FIANDT J T.Effects of metal salt mixtures on Daphnia magna reproduction[J]. Ecotoxicol Environ Saf,1986,11(1):9-14.
[6]SPEHAR R L,FIANDT J T.Acute and chronic effects of water quality criteria-based metal mixtures on three aquatic species[J].Environ Toxicol Chem,1986,5(10):917-931.
[7]ENSERINK E L,MAAS-DIEPEVEEN JL,VAN LEEUWEN C J. Combined effects of metals:an ecotoxicological evaluation[J]. Water Res,1991,25(6):679-687.
[8]OTITOLOJU A.Relevance of joint action toxicity evaluations in setting realistic environmental safe limits of heavy metals[J].J Environ Manage,2003,67(2):121-128.
[9]COOPER N L,BIDWELL J R,KUMAR A.Toxicity of copper,lead,and zinc mixtures to Ceriodaphnia dubia and Daphnia carinata[J].Ecotoxicol Environ Saf,2009,72(5):1523-1528.
[10]NAGEL R.DarT:the embryo testwith the zebrafish Danio rerio:a generalmodel in ecotoxicology and toxicology[J].Altex,2002,19 (S1):38-48.
[11]朱琳,史淑洁.斑马鱼胚胎发育技术在毒性评价中的应用[J].应用生态学报,2002,13(2):252-254.
[12]DAVE G,XIU R.Toxicity of mercury,copper,nickel,lead,and cobalt to embryos and larvae of zebrafish,Brachydanio rerio[J]. Arch Environ Con Tox,1991,21(1):126-134.
[13]HALLARE A,NAGEL K,K¨OHLER H R,et al.Comparative embryotoxicity and proteotoxicity of three carrier solvents to zebrafish(Danio rerio)embryos[J].Ecotoxicol Environ Saf,2006,63(3):378-388.
[14]OSTERAUER R,K¨OHLER H R.Temperature-dependent effects of the pesticides thiacloprid and diazinon on the embryonic development of zebrafish(Danio rerio)[J].Aquat Toxicol,2008,86(4):485-494.
[15]ZHU X S,ZHU L,DUAN Z H,et al.Comparative toxicity of severalmetal oxide nanoparticle aqueous suspensions to Zebrafish (Danio rerio)early developmental stage[J].J Environ Sci Health Part A,2008,43(3):278-284.
[16]JOHNSON A,CAREW E,SLOMAN K A.The effects of copper on the morphological and functional development of zebrafish embryos[J].Aquat Toxicol,2007,84(4):431-438.
[17]DAVE G,DAMAGAARD B,GRANDE M.Ring test of an embryo-larval toxicity test with zebrafish(Brachydanio rerio) using chromium and zinc as toxicants[J].Environ Toxicol Chem,1987,6(1):61-71.
[18]陈中智,朱琳,姚琨,等.Ca2+与Pb2+相互作用对斑马鱼胚胎毒性效应的影响[J].环境科学,2009,30(4):1205-1209.
[19]邓铁柱,苏丽敏,袁星,等.乙草胺与 Cu,Zn对发光菌和斑马鱼胚胎的联合毒性效应[J].环境化学,2007,26(6):741-744.
[20]CHENG S H,WAI A W K,SO C H,et al.Cellular and molecular basis of cadm ium-induced deformities in zebrafish embryos[J].Environ Toxicol Chem,2000,19(12):3024-3031.
[21]朱祥伟,刘树深,葛会林,等.剂量 -效应关系两种置信区间的比较[J].中国环境科学,2009,29(2):113-117.
[22]DUNNETT C W.New tables for multiple comparisons with a control[J].Biometrics,1964,20(3):482-491.
[23]ARRHENIUS,GR¨ONVALL F,SCHOLZE M,et al.Predictability of the mixture toxicity of 12 similarly acting congeneric inhibitors of photosystem Ⅱ in marine periphyton and epipsammon communities[J].Aquat Toxicol,2004,68(4):351-367.
[24]ZHANG Y H,LIU S S,SONG X Q,et al.Prediction for the mixture toxicity of six organophosphorus pesticides to the lum inescent bacterium Q67[J].Ecotoxicol Environ Saf,2008:71 (3):880-888.
[25]BACKHAUS T,ARRHENIUS A,BLANCK H.Toxicity of a mixture of dissimilarly acting substances to natural algal communities:predictive power and limitations of independent action and concentration addition[J].Environ Sci Technol,2004,38(23):6363-6370.
[26]GELLERT G,HEINRICHSDORFF J.Effect of age on the susceptibility of zebrafish eggs to industrial wastewater[J].Water Res,2001,35(15):3754-3757.
[27]端正花,朱琳,宫知远.己烯雌酚在斑马鱼胚胎中的生物蓄积及毒性机制研究[J].环境科学,2009,30(2):522-526.
[28]刘晓旭,施蔡雷,贾秀英.Cu2+,Cd2+对瓯江彩鲤(C.carpio var.color)的急性毒性研究[J].杭州师范大学学报:自然科学版,2009,8(4):304-307.
[29]杨再福,陈立侨,陈华友.重金属铜、镉对蝌蚪毒性的研究[J].中国生态农业学报,2003,11(1):102-103.
[30]邓辅财,刘树深,刘海玲,等.部分重金属化合物对淡水发光菌的毒性研究[J].生态毒理学报,2007,2(4):402-408.
[31]何斌,何利君,杜军,等.4种重金属离子对淡水石斑胚胎及仔鱼急性毒性的研究[J].水利渔业,2006,26(4):94-95.
[32]JUNGHANS M,BACKHAUS T,FAUST M,et al.Toxicity of sulfonylurea herbicides to the green alga Scenedesmus vacuolatus: predictability of combination effects[J].B Environ Contam Tox,2003,71(3):585-593.
Joint Toxicity o f Cu2+and Cd2+to Early Deve lopm ent o f Zebra fish Em bryos
ZHANG Ya-hui,LIU Zheng-tao,WANG Yi-zhe,YAN Zhen-guang,WANG Hong,YANG Ni-yun
Key Laboratory of Ecological Effect and Risk Assessment of Chemicals,M inistry of Environmental Protection,Chinese Research Academy of Environmental Sciences,Beijing 100012,China
X131.2
A
1001-6929(2010)11-1415-06
2010-05-25
2010-08-20
国家水体污染控制与治理科技重大专项(2008ZX0526-003)
张亚辉(1979-),女,河南宝丰人,助理研究员,博士,zhangyahui@craes.org.cn.
*责任作者,刘征涛(1965-),男,江苏江阴人,研究员,博士,主要从事环境污染生态学及毒理学研究,liuzt@craes.org.cn
