侧脑室注射重组人血管生长素对脑缺血再灌注大鼠的影响
2010-09-20张伟赫郭淮莲唐文雄唐春花高旭光
张伟赫, 郭淮莲, 程 敏, 唐文雄, 唐春花, 高旭光
缺血性脑血管病是影响人类健康和生命的三大疾病之一,以其高发病率、高致残率和高死亡率为特征,目前缺血性脑血管病的治疗效果尚不能令人满意。随着对生理及病理性血管生成机制探索的不断深入,以及多种血管生成因子的分离、纯化,血管新生与脑缺血治疗之间的关系逐渐引起人们的关注。血管生长素(Angiogenin,ANG)是一种血管生成因子,是 RNase超家族中的一员,具有促血管生成的功能,其结构是由 123个氨基酸残基组成的分泌型单链碱性蛋白,相对分子量约为 14000Da,主要在肝脏中合成,分布于正常血浆及实体肿瘤组织中[1],Fett等人 1985年从人类结肠癌 HT-99细胞中将其分离出来[2]。ANG对心肌缺血和肢体缺血的保护作用已见报道[3,4],但其对脑缺血的保护作用报道较少。我们对大鼠脑缺血后再灌注脑内 ANG的表达水平进行了研究,结果发现大鼠缺血后 6h,缺血大脑半球大脑中动脉供血区(皮层及基底节)ANG表达明显增强,缺血 18h及 24h上述区域 ANG的表达更进一步增加[5],提示 ANG参与脑缺血后血管的重建,预示着 ANG可能对脑缺血有一定的治疗作用。本研究观察了侧脑室注射重组人 ANG对脑缺血再灌注大鼠体重、脑组织病理学、缺血后凋亡细胞数量与微血管数量变化的影响。
1 材料与方法
1.1 实验动物 Sprague-Dawley雄性成年大鼠 18只,由北京大学医学部实验动物部提供,体重为 255±5g,随机分为 4组,分别为:(1)ANG治疗组(n=5):1μg ANG溶于牛血清白蛋白 30μl中,10μl/d,共 3d;(2)牛血清白蛋白(BSA)对照组(n=5):0.01μg/μl,10μl/d,共 3d;(3)MCAO对照组(n=5):建立 MCAO模型,不进行任何治疗;(4)假手术组(n=3):仅作颈部切口,不建立 MCAO模型。本实验的研究草案获得北京大学人民医院实验动物伦理审查委员会的批准。
1.2 试剂与仪器 重组人 Angiogenin(Rh-ANG)购于美国 R&D公司;牛血清白蛋白(bovine serum albumin,BSA)购于美国 Amresco公司;TUNEL凋亡试剂盒购于日本 MBL公司;vWF抗体(兔抗大鼠)购于英国 abcom公司;羊抗兔二抗购于北京中山金桥生物有限公司。Leica DM RXA显微镜观察并照相。
1.3 MCAO模型的建立 采用改良的 Longa线栓法将大鼠制成左侧 MCAO模型[6]。将实验大鼠用 10%水合氯醛(0.33ml/kg)经腹腔注射麻醉,剃毛并固定于立体定位仪上,碘伏消毒后在枕部切开一长约 2cm的切口,依据 Paxinos-Watson图谱[7],以前囟为中心后移 0.8mm,左移 1.5mm,即大鼠左侧侧脑室的体表标志,钻一直径为 2mm的孔备用,缝合切口。钻孔完毕后立即将大鼠仰卧于手术台上固定四肢,经碘伏消毒后沿大鼠颈前部中线切开皮肤,分离、暴露左侧颈总动脉,颈内、外动脉,结扎并离断颈外动脉,将尼龙线栓(事先将头端用打火机烧成球状)从离断的颈外动脉近端经颈内动脉插入大脑中动脉,遇阻时停止(平均入线长度为 1.8~2.0cm),固定线栓,关闭切口。90min后进行神经功能缺损评分,判断 MCAO模型是否建立成功,将大鼠经乙醚吸入麻醉后拔出尼龙线栓。
1.4 侧脑室注射 Angiogenin 将上述脑缺血再灌注成功的大鼠于拔出线栓后立即经 10%水合氯醛再次麻醉后,重新固定于立体定向仪上,打开枕部切口,应用微量注射器以颅骨表面为基准垂直进针 4.5mm,分别将浓度为 0.033μg/μl的 ANG或浓度为 0.01μg/μl的 BSA注入大鼠左侧侧脑室中(注射时间 5min,注射剂量均为 10μl),停留 5min后移出注射器针头,缝合切口,消毒,肌内注射青霉素预防感染,每日注射一次,共 3d。
1.5 大鼠体重的动态观察 大鼠手术前后均给予充足的饲料和水分,称量大鼠初始体重(0d),并在手术后的第 1天(1d)、第 2天(2d)以及第 3天(3d)对各组大鼠体重进行动态观察。
1.6 HE染色观察组织病理形态 将各组大鼠在术后 3d时处死,4%多聚甲醛经左心室灌流固定,断头取脑,包埋,将每个标本以初见侧脑室为起点行冠状切片,取 5张片子,片厚 5μm,进行 HE染色,观察缺血中心区与缺血周边区的组织病理学改变。
1.7 凋亡细胞的观察 依据 MBL公司提供的使用说明书,对 5μm厚冠状位连续切片进行TUNEL染色,切片均取自初见侧脑室起点后的第 6~10张,染色后凋亡阳性细胞在荧光显微镜下呈现绿色荧光,每张切片在脑缺血区域或对照组相对应的区域选取 5个凋亡细胞数量最多的区域(皮层区3个,基底节区 2个),在高倍视野下计数每个区域的凋亡细胞数,取平均值进行比较。
1.8 vWF因子免疫组织化学染色 大鼠在术后 3d时经 4%多聚甲醛固定,断头取脑,OCT包埋,冰冻切片机上行冠状位切片后经 PBS水化 30min,去离子水孵育 15min,以去除过氧化物酶,于 37℃温箱内经胰酶消化 15m in,封闭液封闭 10min,滴加抗vWF一抗 4℃冰箱孵育过夜,滴加二抗,PBS冲洗,DAB显色,高倍显微镜下观察,依照计数凋亡细胞的方法,每张切片均在脑缺血区域或对照组相对应的区域选取 5个热区,血管内皮细胞被染成棕色,按照 Weider方法[8]进行血管计数,即单个孤立内皮细胞或多个内皮细胞紧密排列的细胞丛均计数为 1个血管,若有管腔,管腔直径 <20μm方被计数。
1.9 统计学分析 各组内数据用均数 ±标准差表示,应用 SPSS13.0软件包进行分析处理,各组间差异显著性的比较采用方差分析(ANOVA)、t检验,设定 P<0.05为差异具有显著性。
2 结 果
2.1 大鼠体重的变化 分别在术前(0d)、术后第 1天(1d)、第 2天(2d)以及第 3天(3d)对每只大鼠称量体重,结果发现,BSA组和 MCAO组大鼠体重在术后第 1天和第 2天有所下降,第 3天又呈上升趋势,两组大鼠体重下降(手术前体重 ~第 3天体重)的平均值分别为 8.8±10.9g和 7.4±11.9g。ANG组的大鼠体重在 4d内持续下降,其中下降最为明显的一只大鼠的体重由 260g降至178g,该治疗组大鼠体重平均下降 50.6±23.2g,与BSA组和 MCAO组相比差异有显著性(P<0.05)。假手术组大鼠体重在 4d内逐日升高,4d体重升高的均值为 20.5±3.5g(见表1)。
2.2 组织病理学结果 HE染色发现假手术组大鼠脑组织形态结构正常;MCAO组和 BSA组缺血侧脑组织皮层神经元正常排列结构消失,神经元体积增大,呈灶片状神经元变性坏死,间质水肿明显,大量胶质细胞增生;与之相比,ANG组大鼠缺血侧脑组织神经元变性坏死及间质水肿程度减轻,皮层神经元正常排列结构尚存,胶质细胞增生不明显(见图1)。
2.3 TUNEL染色观察凋亡细胞数量 假手术组大鼠脑组织中未观察到凋亡细胞;MCAO对照组和 BSA对照组可见大量凋亡阳性细胞,分别为34.7±19.8个/200倍和 30.8±15.2个 /200倍,与之相比 ANG治疗组凋亡细胞数明显减少,为 18.4±15.1个/200倍,与两对照组相比差异有显著性意义,P<0.05(见图2)。
2.4 vWF免疫组织化学染色 假手术组的微血管计数为每高倍视野 11.1±4.2个;MCAO对照组和 BSA对照组分别为 15.5±7.1个和 19.8±8.8个;ANG治疗组为 33.8±16.8个,与各对照组相比差异有显著性意义,P<0.05(见图3)。
表1 各组大鼠的体重变化(±s)

表1 各组大鼠的体重变化(±s)
时间 假手术组(n=3) ANG组(n=5) BSA组(n=5) MCAO组(n=5)0d 1d 2d 3d 255.7±5.1 264.3±3.1 272.0±2.6 278.3±1.5 255.8±5.1 238.0±6.4 221.2±17.4 205.2±22.5 256.4±4.4 249.6±5.6 243.2±6.3 247.6±12.4 255.4±2.5 248.6±2.3 246.6±6.4 248.0±10.4
3 讨 论
目前已知参与血管新生的因子有 20余种,ANG便是其中的一员。利用血管新生治疗脑缺血至今已有近 20年的历程,参与血管新生的血管内皮生长因子(vascu lar endothelial grow th factor,VEGF)和成纤维细胞生长因子(fibroblast growth factor,FGF)对脑缺血的治疗效果已见报道[9~11]。我们经腹腔注射ANG(15ng/100g体重)治疗大鼠脑缺血,结果表明对脑缺血再灌注大鼠缺血半暗带区凋亡细胞数量无显著影响[12]。阴性结果可能与给药途径和给药剂量有关。本研究利用侧脑室注射给药,并将 ANG给药总剂量增加为 1μg。侧脑室注射属于局部注射,其优点在于用量小,吸收迅速,药物可直接通过室管膜进入脑组织中,从而对脑组织内血管再生起到易化作用,及时地挽救缺血半暗带濒死神经元。此外,我们还设立了 3个对照组,其中 BSA对照组的设立是因为它是 ANG的溶剂,旨在了解 BSA本身是否对大鼠脑缺血存在影响。假手术组的设立是为了观察手术本身对大鼠的影响。
我们还对各组大鼠缺血后体重的变化进行了动态观察,结果显示,MCAO组和 BSA组大鼠的体重在术后 2d内有所下降,可能与手术过程损毁了颈外动脉的分支翼颚动脉有关,翼颚动脉是供应大鼠咀嚼肌的血管,加之手术本身对大鼠是一种创伤,均会在短期内影响大鼠的进食,但在第 3天,体重又有上升的趋势,考虑与侧枝循环的建立以及手术创伤的恢复有关。与之不同是,应用 ANG治疗的大鼠体重呈持续下降,与对照组相比差异有显著性意义。提示ANG对脑缺血大鼠有降低体重的作用。推测 ANG引起大鼠体重下降的原因为:(1)抑制蛋白合成与促进网织红细胞 RNA降解[13];(2)导致 28S rRNA和18S rRNA或 tRNA的断裂[13,14]。
本研究在大鼠脑缺血再灌注 3d后对各组大鼠的缺血侧皮层区进行了组织形态学观察,发现MCAO组和 BSA组缺血侧脑组织皮层神经元正常排列结构消失,神经元体积增大,呈灶片状神经元变性坏死,间质水肿明显,大量胶质细胞增生;与之相比,ANG组大鼠缺血侧脑组织神经元变性坏死及间质水肿程度减轻,皮层神经元正常排列结构尚存,胶质细胞增生不明显。
为了观察各组大鼠凋亡阳性细胞数和微血管计数,切片时对每只大鼠均选取自初见侧脑室后第 6~15张脑片,并人为地将大鼠大脑中动脉供血区分为5个亚区:皮层区 3个和基底节区 2个,荧光显微镜和普通显微镜下分别在每个亚区找出凋亡阳性细胞数和微血管数最多的区域(热区)进行计数,使各组大鼠间有较好的可比性。
小结:侧脑室注射 ANG能够减轻脑缺血大鼠脑内间质水肿和神经元变性坏死,减少凋亡细胞数目,促进血管新生。ANG可降低脑缺血大鼠的体重。
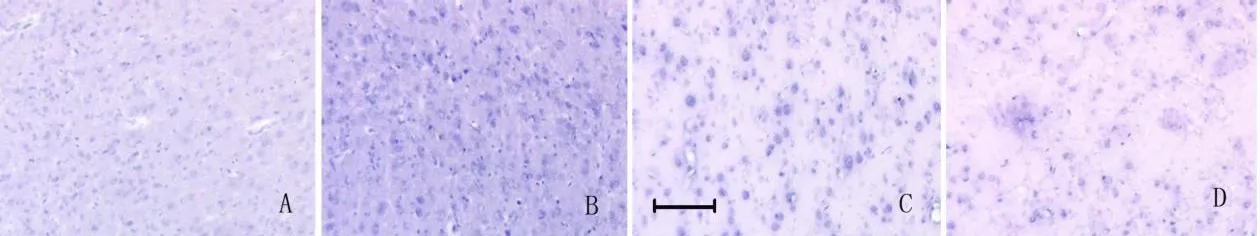
图1 脑缺血再灌注 3d后各组大鼠缺血侧脑组织 HE染色(皮层区),标尺 =50μm

图2 脑缺血再灌注 3d后各组大鼠脑内TUNEL染色(皮层区)×200
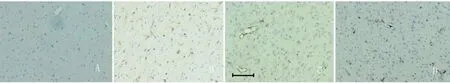
图3 脑缺血再灌注 3d后各组大鼠缺血侧脑组织 vWF免疫组织化学染色(皮层区)标尺 =50μm
[1]Weiner H,Weiner LH,Swain JL.Tissue distribution and developmental expression of messenger RNA encoding angiogenin[J].Science,1987,237:280-282.
[2]Fett JW,Strydom DJ,Lobb RR,etal.Isolation and characterization of angiogenin,an angiogenic protein from human carcinoma[J].Biochemistry,1985,24:5480-5486.
[3]Li ZG.Studies on transplantation of bone marrow stromal cell transferred by angiogenin gene in ischemic myocardium[J].China Med Abstracts,2003,19:43-46.
[4]Bao JM,Cao GS,Jing ZP,etal.Experimental study on treatment of limb ischemia in a rabbit model by angiogenin[J].Chin J Exper Surg,2001,3:218-220.
[5]程 敏,郭淮莲,黄 丽,等.脑缺血再灌注大鼠脑内 angiogenin的动态变化[J].中风与神经疾病杂志,2007,24(3):269-270.
[6]Longa EZ,Weinstein PR,Carlsons S,etal.Reversiblem iddle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20:84-91.
[7]Paxinos G,Watson C.The rat brain in stereotaxic coordinates[M].2nd ed.North Ryde,Australia:Academ ic Press,1986.22.
[8]Weidner N,Semple JP,Welch WR,etal.Tumor angiogenesis andmetastasis-correlation in invasive breast carcinoma[J].N Engl JMed,1991,324:1-8.
[9]Harrigan MR,Ennis SR,Sullivan SE,etal.Effects of intraventricular infusion of vacular endothelial growth factor on cerebral blood flow,edema,and infarct volume[J].Acta Neurochi(Wein),2003,145:49-53.
[10]Wang YM,Galvan V,Gorostiza O,etal.Vascular endothelial growth factor improves recovery of sensorimotor and cognitive deficits after focal cerebral ischemia in the rat[J].Brain Res,2006,1115:186-193.
[11]Berry D,Ren JM,Kwan CP,etal.Dimeric fibroblast growth factor-2 enhances functional recovery after focal cerebral ischemia[J].Restor Neurol Neurosci,2005,23:251-256.
[12]赵亚峰,郭淮莲,程 敏.血管生长素对大鼠脑缺血再灌注细胞凋亡的影响[J].重庆医科大学学报,2008,33:20-22.
[13]St Clair DK,Rybak SM,Riordan JF,etal.Angiogenin abolishes cellfree protein synthesisby specific ribonucleolytic inactivation of ribosomes[J].Proc Nat Acad Sci,1987,84:8330-8334.
[14]Shapiro R,Riordan JF,Vallee BF.Characteristic ribonucleolytic activity of human angiogenin[J].Biochem istry,1986,25:3527-3532.
