盐酸纳曲酮多囊脂质体的处方及制备工艺研究
2010-09-20孙丽君全东琴冯端浩
孙丽君,王 涛,全东琴,冯端浩
(1. 军事医学科学院毒物药物研究所,北京 100850;2. 解放军309医院药剂科,北京 100091)
盐酸纳曲酮多囊脂质体的处方及制备工艺研究
孙丽君1,王 涛1,全东琴1,冯端浩2
(1. 军事医学科学院毒物药物研究所,北京 100850;2. 解放军309医院药剂科,北京 100091)
目的:制备盐酸纳曲酮多囊脂质体(DepoNTX),并考察其理化性质。方法:采用复乳法制备DepoNTX;RP-HPLC法测定含量、包封率;以包封率为指标,单因素及正交试验筛选、优化工艺和处方;光学显微镜下观察多囊脂质体形态、用库尔特计数仪测定其粒径和粒度分布。结果:制备的最佳条件是卵磷脂/胆固醇为1∶1(摩尔比),形成复乳的振荡时间为10 s,L-赖氨酸的浓度为40 mmol·L-1,初乳和第二水相的体积比为1∶2.5。粒径范围为5 ~ 50 μm,平均粒径为12.4 μm,包封率为44.5%。结论:制备的DepoNTX包封率较高,粒子表面呈光滑球形,内部具有非同心的多囊泡结构。
纳曲酮;多囊脂质体;包封率;制备工艺
纳曲酮(naltrexone, NTX)是一种μ-阿片受体纯拮抗剂,被美国FDA批准作为阿片类(吗啡、海洛因)药物滥用和酒精依赖的治疗药物[1-3],由军事医学科学院毒物药物研究所在国内首先仿制。盐酸纳曲酮片口服疗效确切,但吸收曲线波动大,首过效应严重,健康人体口服绝对生物利用度仅为5% ~ 20%,患者顺应性差[4]。因此,研究盐酸纳曲酮非口服缓释制剂越来越受到关注。国外已有该药的口服缓释制剂、纳曲酮混悬液肌内注射剂、纳曲酮混悬液皮下注射剂、纳曲酮微球注射剂的研究报道[5-7]。多囊脂质体(multivesicular liposomes, MVLs)是Kim等[8]于1983年首先研制的一种新型脂质体,其内部具有数百个多面体的水性腔体,各腔体由连续的网络状的磷脂膜分隔而成,某个腔室破裂时,不致影响脂质体的整体结构,因此具有明显的缓释作用。MVLs一般采用局部注射给药方式,适合水溶性小分子和蛋白多肽类药物,且注射途径广泛,可用于敏感部位注射入眼部、硬膜外或关节等[9]。目前国外已有硫酸吗啡、阿糖胞苷两种产品上市和多个专利注册和研究报道[9-12]。
本文通过优化盐酸纳曲酮多囊脂质体(DepoNTX)的处方和制备工艺,以期为该制剂的进一步研究提供参考。
1 仪器与试药
UV-3010分光光度计(日本HITACHI公司);L-7420/UV-3010高效液相色谱仪(日本HITACHI公司);F-33 pH/mV/℃计(北京屹源电子仪器科技公司);台式高速离心机(Z200A,德国Hermle公司);光学显微镜(日本Olympus公司);GL-901涡旋振荡机(其林贝尔仪器制造公司);JY92-11D超声波细胞破碎机(南京新辰生物科技有限公司)。
盐酸纳曲酮原料药(军事医学科学院毒物药物研究所药化室,纯度 > 99%,批号050426);卵磷脂(PC含量90%,BASF公司);胆固醇(北京生化试剂公司);L-赖氨酸(北京试剂公司);三油酸甘油酯(北京试剂公司);其他试剂均为分析纯。
2 方法与结果
2.1 DepoNTX的制备
采用W/O/W型复乳溶剂挥发法制备DepoNTX。精密称10 mg盐酸纳曲酮,溶于内水相(4%葡萄糖的醋酸水溶液),加入等体积的氯仿溶液(含卵磷脂、胆固醇、二棕榈酰磷脂酰甘油和三磷酸甘油酯),探头超声4 min(功率200 W),形成W/O型初乳。加入一定体积的外水相(含4%葡萄糖和40 mmol·L-1L-赖氨酸的水溶液)形成W/O/W型复乳,通入氮气,挥去有机溶剂,即得DepoNTX混悬液。
2.2 包封率测定
2.2.1 色谱条件 色谱柱:SB-C18(150 mm×4.6 mm, 5 μm, Zorbax);流动相:水-甲醇-乙腈-三乙胺(85∶10∶5∶0.16,磷酸调pH至4.00);检测波长:235 nm;流速:1.0 mL·min-1;进样量:20 μL。
2.2.2 标准曲线的绘制 精密量取浓度为520.60 μg·mL-1的贮备液0.5,1.0,2.0,2.5,3.0,4.0,5.0 mL置于25 mL容量瓶中,流动相稀释至刻度,摇匀,分别取20 μL,注入色谱仪。以峰面积均值A对进样浓度B(μg·mL-1)进行线性回归,得到标准曲线。其回归方程为:A = 16 197.4B +15 485.36(r = 0.999 9)。盐酸纳曲酮在10 ~ 100 μg·mL-1范围内,峰面积与浓度线性关系良好。
2.2.3 精密度 配制高、中、低(100,50,10 μg·mL-1)三个浓度的盐酸纳曲酮溶液,分别于0,2,4,6,8 h及1,2,3,4,5 d内测定,计算其日内、日间精密度。日内、日间精密度RSD值分别为1.35%,1.91%,0.91%(n = 5)和1.57%,1.32%,1.05%(n = 5)。仪器精密度良好。
2.2.4 回收率 取空白多囊脂质体样品,分别加入盐酸纳曲酮对照品溶液(低、中、高3个浓度),用适量酸性甲醇破乳并定容至100 mL。分别进样20 μL,记录色谱图;平均回收率分别为99.14%,99.67%,100.07%,RSD为0.85%(n = 9)。
2.2.5 样品包封率测定 将制备的纳曲酮多囊泡脂质体用2倍体积的0.9%NaCl溶液稀释后,在600×g转速下离心10 min后,分别取沉淀置于100 mL容量瓶中用酸式甲醇破乳定容,取20 μL进样,用HPLC法测定纳曲酮的含量,根据下面的公式计算出盐酸纳曲酮多囊脂质体的包封率:

2.3 单因素试验考察DepoNTX处方工艺
2.3.1 药/脂比对包封率的影响 固定其他条件改变药/脂比,分别以质量比为1∶5,1∶3,1∶2制备DepoNTX,考察其对盐酸纳曲酮包封率及粒径分布的影响。结果显示,药/脂比在1∶5 ~ 1∶3范围对多囊泡脂质体中盐酸纳曲酮包封率的影响不明显,当药/脂比低于1∶3时,包封率有下降趋势。为了减少脂质的用量,降低造价,减少类脂成分对肝脾的副作用,我们选择了药/脂比相对较大的处方制备DepoNTX。2.3.2 三油酸甘油酯的浓度对包封率的影响 三油酸甘油酯在制备多囊泡脂质体的处方中起着关键的作用,其浓度高低对包裹容积和包封率有很大的影响。固定其他条件,分别以1.7,3.4,5.1 μmol的量考察其对盐酸纳曲酮包封率的影响。结果显示,随着三油酸甘油酯浓度的增加,包封率先增加后下降,三油酸甘油酯的量为3.4 μmol时,DepoNTX的包封率较高,平均粒径无明显变化。
2.3.3 离心速度对脂质体包封率的影响 固定其他条件,考察离心速度对盐酸纳曲酮包封率的影响,离心时间为10 min。结果显示,离心速度过低或过高,DepoNTX的包封率都有所下降,离心速度在近600×g时,包封率较高;随着离心速度的加大,粒径相应减小。
2.4 正交试验优化DepoNTX处方工艺
在单因素考察的基础上,确定了卵磷脂与胆固醇摩尔比(1∶2,1∶1,2∶1);制备复乳时的振荡时间(5,10,25 s);L-赖氨酸的浓度(20,40,60 mmol·L-1)以及初乳与第二水相的体积比(1∶1,1∶2.5,1∶4)等4个因素。每个因素取3个水平,以包封率、平均粒径为指标,应用L9(34)表进行正交试验设计,筛选最佳处方和工艺条件。因素水平如表1所示。
表2中F检验结果显示:初乳的体积和第二水相的体积比对盐酸纳曲酮的包封率影响最大(P <0.05),其次是振荡时间(P < 0.05),再其次是卵磷脂和胆固醇的摩尔比,最后为L-赖氨酸的浓度。从表2的分析结果我们可以看出最佳条件是:卵磷脂/胆固醇为1∶1(摩尔比),形成复乳的振荡时间为10 s,L-赖氨酸的浓度为40 mmol·L-1,初乳的体积和第二水相的体积比为1∶2.5。以此处方制备的3批DepoNTX样品,所测包封率分别为43.9%,45.5%和44.1%,用于体内外释放研究的DepoNTX包封率为45.5%。
2.5 DepoNTX形态及粒径分布
DepoNTX混悬液用生理盐水稀释,于光学显微镜下观察其形态并照相,见图l。图中可见,多囊脂质体形状完整,呈规则球形,并可看到其非同心腔体结构。另取2 mL DepoNTX混悬液用生理盐水稀释至50 mL,用库尔特计数仪测定其粒径和粒度分布,如图2所示。粒径范围为5 ~ 50 μm,平均粒径为12.4 μm。

表1 正交试验设计因素水平表Tab 1 Levels of factors of orthogonal experimental design
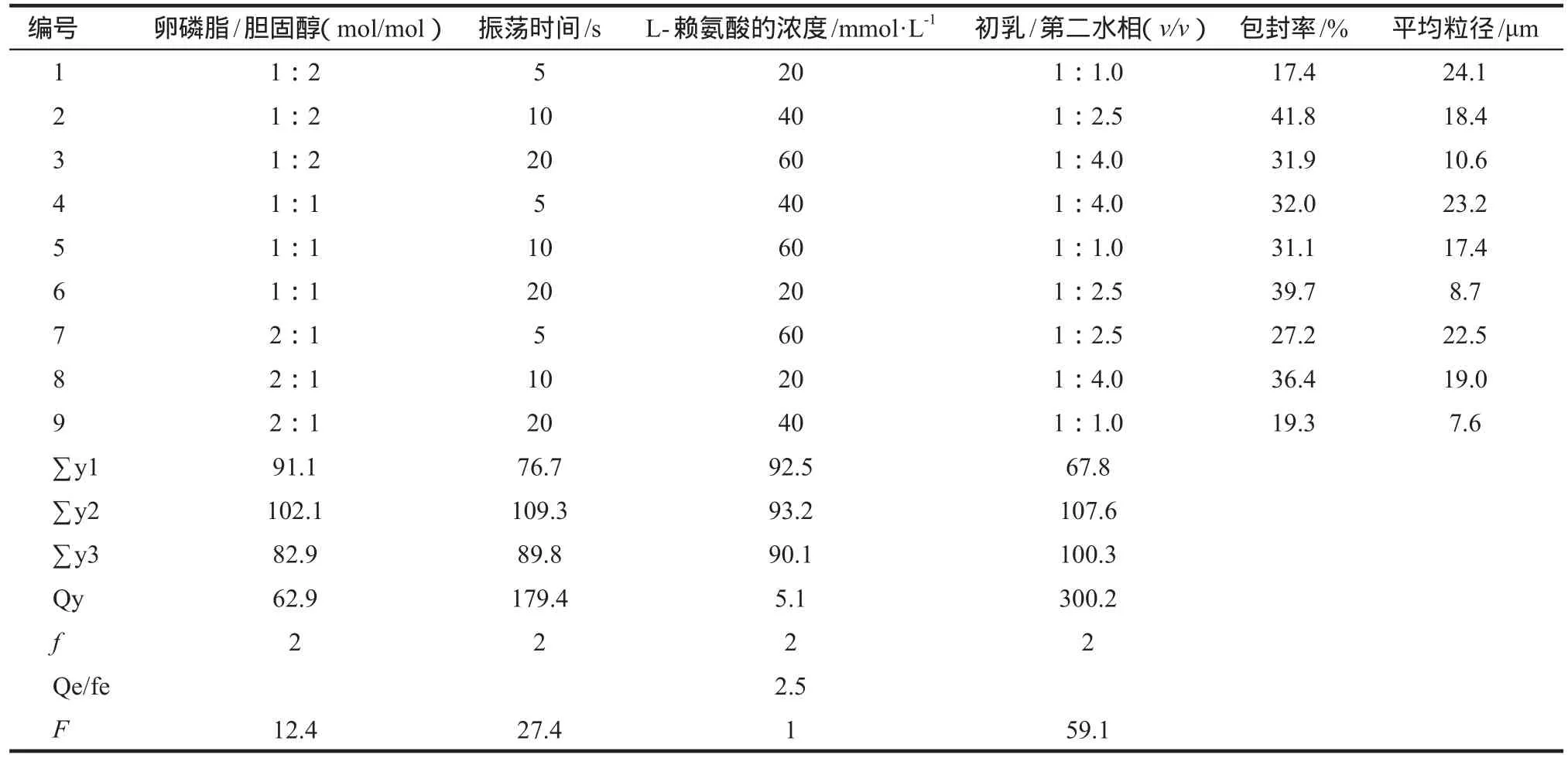
表2 处方因素和工艺因素对盐酸纳曲酮多囊脂质体(DepoNTX)包封率的影响Tab 2 Influences of formulation factors and technology factors on encapsulation efficacy of DepoNTX

图1 盐酸纳曲酮多囊脂质体光学显微照片Fig 1 Light micrograph of DepoNTX
3 讨论
由于多囊脂质体的结构独特,W/O/W复乳法是文献报道中多囊脂质体制备的唯一方法[13],是制备多囊脂质体的一个必要条件,另一个必要条件是油相中应含有中性脂质(如三油酸甘油酯等)。多囊泡脂质体具有不连续药物溶液的球型囊泡,这些囊泡被连续的非同心的类脂双分子磷脂膜所分隔,相邻囊泡之间会存在一定的空隙,三油酸甘油酯在多囊脂质体膜中有填补膜空隙的作用,降低了膜的表面张力,稳定了多囊泡脂质体的骨架。三油酸甘油酯的量要适中,量多会分散到膜的其他部位扰乱磷脂双分子层结构,从而影响多囊泡脂质体膜的致密性及稳定性而使包封率下降;量少时达不到填充空隙所需的量,同样使多囊泡脂质体膜不稳定,继而包封率下降[5,14]。

图2 盐酸纳曲酮多囊泡脂质体粒径分布图Fig 2 Particle size distribution of DepoNTX
胆固醇的加入具有减少膜流动性、增加膜致密性和稳定脂质体的作用,其加入量是一个关键的因素。本实验中发现卵磷脂(PC):胆固醇(CHol)为1∶1时,膜的稳定性最佳。与文献报道中,PC与CHol混合Langmuir膜研究结果高度一致[15]。
DepoNTX内外水相的渗透压差不能太大,否则不能形成稳定的复乳从而使包封率下降。内外水相渗透压的调节可通过改变内外水相中葡萄糖的浓度来达到。葡萄糖的浓度不同,其渗透压也相应不同,都会影响内水相的渗透压,适宜的葡萄糖浓度,才能使内外水相渗透压相匹配。
本实验中制备的DepoNTX包封率较高,粒子表面呈光滑球形,内部具有非同心的多囊泡结构。我们的后续工作将对DepoNTX进行体内外释放研究,进一步评价制剂在体内外的缓释作用。
[1] Tucker TK, Ritter AJ. Naltrexone in the treatment of heroin dependence: a literature review[J]. Drug Alcohol Rev, 2000, 19(1): 73-82.
[2] Rossi S, Sandri G, Caramella CM, et al. Buccal drug delivery: a challenge already won[J]. Drug Discov Today, 2005, 2(1): 59-65.
[3] Thomas CP, Wallack SS, Lee S, et al. Research to practice: adoption of naltrexone in alcoholism treatment[J]. J Subst Abuse Treat, 2003, 24(1): 1-11.
[4] Giannola LI, De Caro V, Gtandalia G, et al. Release of naltrexone on buccal mucosa: permeation studies, histological aspects and matrix system design[J]. Eur J Pharm Biopharm, 2007, 67(2): 425-433.
[5] Yin W, Akala EO, Taylor RE. Design of naltrexone loaded hydrolysable crosslinked nanoparticles[J]. Int J Pharm, 2002, 244(1-2): 9-19.
[6] Valiveti S, Paudel KS, Hammell DC, et al. In vitro/in vivo correlation of transdermal naltrexone prodrugs in hairless guinea pigs[J]. Pharm Res, 2005, 22(6): 981-989.
[7] Valiveti S, Hammell DC, Paudel KS, et al. In vivo evaluation of 3-O-alkyl ester transdermal prodrugs of naltrexone in hairless guinea pigs[J]. J Control Release, 2005, 102(2): 509-520.
[8] Kim S, Turker MS, Chi EY, et al. Preparation of multivesicular liposomes[J]. Biochim Biophys Acta, 1983, 728(3): 339-348.
[9] 王晓梅,唐星,何海水. 多囊脂质体的研究进展[J].中国新药杂志,2006,15(15):1244-1246.
[10] Ye Q, Asherman J, Stevenson M, et al. DepoFoam technology: a vehicle for controlled delivery of protein and peptide drugs[J]. J Control Release, 2000, 64(1-3): 155-166.
[11] Dai C, Wang B, Zhao H, et al. Preparation and characterization of liposomes-in-alginate (LIA) for protein delivery system[J]. Colloids Surf B: Biointerfaces, 2006, 47(2): 205-210.
[12] Grayson LS, Hansbrough JF, Zapata-Sirvent RL, et al. Pharmacokinetics of DepoFoam gentamicin delivery system and effect on soft tissue infection[J]. J Surg Res, 1993, 55(5): 559-564.
[13] Katre NV, Asherman J, Schaefer H, et al. Multivesicular liposome (DepoFoam) technology for the sustained delivery of insulin-like growth factor-I (IGF-I)[J]. J Pharm Sci, 1998, 87(11): 1341-1346.
[14] 张淼,于叶玲,唐星. 阿糖胞苷多囊脂质体的制备及体外释放度考察[J]. 沈阳药科大学学报,2009,1(1):1-5.
[15] 左佼,赵越,张志荣,等. 胸腺五肽多囊脂质体的制备及体外释放的考察[J]. 华西药学杂志,2009,24(3):229-231.
Formulation and preparation technology of naltrexone hydrochloride multivesicular liposomes
SUN Li-jun1, WANG Tao1, QUAN Dong-qin1, FENG Duan-hao2
(1. Institute of Pharmacology and Toxicology, Academy of Military Medical Sciences, Beijing 100850, China; 2. Department of Pharmacy, 309 Hospital of PLA, Beijing 100091, China)
Objective: To prepare the naltrexone hydrochloride multivesicular liposomes (DepoNTX), and study its physicochemical properties. Methods: DepoNTX were prepared using multiple emulsion method. RP-HPLC was used to determine the concentration of naltrexone and encapsulation efficiency. The formulation and pharmaceutical process were optimized by single factor design and orthogonal experimental design with the encapsulation efficiency as the criteria. The multivesicular liposomes particles were characterized by their morphology which was observed using light microscope, the particle size and distribution were determined by coulter counter. Results: The optimal formula was as follows: the mole ratio of phosphatidylcholine to cholesterol was 1∶1, the vortex time for emulsion polymerization was 10 s, the concentration of L-lysine was 40 mmol·L-1, the volume ratio of the first emulsification to the second aqueous phase solution was 1∶2.5. The particle sizes of DepoNTX were 5-50 μm with the mean particle size of 12.4 μm, the encapsulation efficiency of DepoNTX was 44.5%. Conclusion: DepoNTX was successfully encapsulated in this depot with high yield, and showed spherical shape with the non-concentric multivesicular aqueous compartment. [KEY WORDS] Naltrexone; Multivesicular liposomes; Encapsulation efficiency; Preparation technology
R944
A
1672-8157(2010)06-0338-04
全东琴,女,副研究员,主要从事药物新技术新剂型的研究。Tel:(010)66931636,E-mail:wzbqdq@sohu.com
孙丽君,女,主管药师,主要从事药物新剂型研究。Tel:(010)66775321,E-mail:joycesun1973@126.com
2010-08-16
2010-09-26)
