片状α-Fe2O3的制备及其生长机理
2010-09-17
(中南大学 化学化工学院,湖南 长沙,410083)
片状 α-Fe2O3具有独特的鳞片结构,化学性质稳定,无毒无味,耐高温,抗紫外线,有良好的防锈、耐碱性、耐盐雾、耐候性等优良性能,是一种具有广泛用途的片状颜料,在防腐蚀涂料、防锈漆、填料、珠光颜料等领域起着重要作用[1]。人工合成的片状α-Fe2O3纯度高,光亮感与立体感强,表面光滑。晶体为规则的六角形片状α-Fe2O3,结晶面平滑无损,结晶的透过光呈血红色,表面的反射光为有金属般光泽的黑紫色,并且径厚比越大,闪光效果越好[1]。近年来,助熔剂法已用于多种材料的合成[2−3]。常用的水热法[4−6]需要1.0~2.3 MPa压力,而助熔剂法能在常压下进行,并且助熔剂体系在高温下能够提供一个与常温下溶液相似的环境,但活化能很高,因此,各反应物的扩散系数比提高,晶体生长速度更快,其反应时间明显下降。同时,晶体生长形态容易控制,产品纯度也较高[7]。虽然国内外关于助熔剂法制备片状α-Fe2O3的工艺有一些专利文献,但公开发表并探讨其生长机理的文献很少。为了探索助熔剂法在制备片状α-Fe2O3方面的应用,以及不同的前驱体制备方式对产品的影响,本文作者以工业上常用的FeCl3·6H2O为原料,克服其易吸水、易水解的缺点,使用复合硫酸盐(Na2SO4+K2SO4)作为助熔剂,制备径厚比较大、表面光滑、具有高闪光效果的片状α-Fe2O3晶体。利用SEM扫描电镜、激光粒度仪以及X线衍射对片状α-Fe2O3的形貌、粒度分布及物相进行分析表征,并对其晶体生长机理进行探讨。
1 实验
以分析纯 FeCl3·6H2O 为原料,以复合硫酸盐(Na2SO4+K2SO4)作为助熔剂,其中,Na2SO4与K2SO4的物质的量比为 1:1,并掺入少量添加剂,制备前驱体粉末。然后,将前驱体粉末置于刚玉坩埚中压紧,在马弗炉中以300 ℃/h的升温速率由室温程序升温至1 100 ℃,保温4 h后,自然缓慢冷却。随后,将得到的固体产物用 80 ℃的蒸馏水反复洗涤,直至滤液用BaCl2试剂检测不到SO42−为止。最后,将产品分别用酸碱处理,对其进一步精制。
在以上相同条件下,为了更好地对比分析不同制备方式对产品形貌的影响,分别使用干法和液相法 2种方式制备前驱体。
(1) 干法:将FeCl3·6H2O与助熔剂直接混合,用物理机械研磨0.5 h使其混合均匀。
(2) 液相法:根据加入酸碱的不同,又分为 4种制备方式。将FeCl3·6H2O与助熔剂混合后,(a) 溶于水中,不添加酸碱;(b) 缓慢滴加0.2 mol/L NaOH溶液至沉淀完全;(c) 缓慢滴加浓氨水至沉淀完全;(d)溶于适量0.2 mol/L稀硫酸中。然后分别将溶液及混合物在90 ℃下干燥24 h至无水,将得到的混合物研磨均匀,得到前驱体粉末。
助熔剂的加入量以复合硫酸盐与 FeCl3·6H2O 的物质的量之比来度量,用n表示。
用 JEOL ISM−5600LV型扫描电镜(SEM)观察粒径、厚度及表面形貌;用BT−9300H型激光粒度分布测试仪检测粒度分布;用Dmax2500VB型X线衍射仪进行物相分析(XRD)。
2 结果与讨论
2.1 前驱体制备方式的影响
2.1.1 干法
助熔剂在高温下熔化后形成的液态环境,属于广义的溶液范畴。通过程序升温至指定温度后,助熔剂作为溶剂形成高温熔液,片状 α-Fe2O3的生成即为晶体生长的过程,并且也可以分为成核阶段和生长阶段[8]。而与普通溶液不同的是:助熔剂在高温下本身存在熔化过程,这个过程是缓慢的,此时,一个个微小的液相熔区逐渐产生,晶体颗粒通过在液相区域中的传质过程形成和长大[9−10]。
图 1所示为用干法制备前驱体时最终产品片状Fe2O3的形貌。由图1(a)可以看出,在其他条件相同的情况下,干法制备的产品为片状。从图1(b)可见:该片体厚度较大,可达1.0~2.0 μm,部分晶体异常长大粒径超过100 μm。经分析认为:干法采用机械研磨,故原料中的助熔剂硫酸盐晶体较难达到分子级别的混合,而且在研磨过程中,FeCl3·6H2O迅速吸水,使物料易板结成块,研磨时间受到限制,使得前驱体粉末难以混合均匀。因此,高温下助熔剂融化后生成的熔区大小不均,晶体的生长空间不同,导致其在径向和厚度方向都出现异常生长,从而得到的产品粒径分布大,厚度不均匀。此外,从图 1(a)还可以看到:片状Fe2O3晶体表面还有一些微晶颗粒生成。

图1 干法制得的片状Fe2O3的SEM图片Fig.1 SEM images of flaky iron oxide prepared by dry process
2.1.2 液相法
图2所示为液相法制备前驱体时得到的最终产品的形貌。

图2 液相法制得片状Fe2O3的SEM图片Fig.2 SEM images of flaky iron oxide prepared by liquid method
从图2可知:液相法得到的产品基本呈六角形板状或片状,不同酸碱的加入对晶体形貌有一定的影响。分别在前驱体中加入酸或碱,置于坩埚中加热后,其反应过程可分别用如下方程式表示:
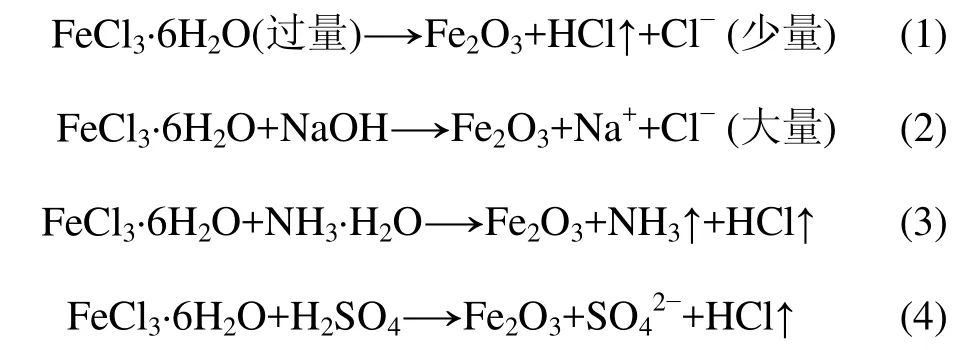
当采用液相法,在前驱体中不添加酸碱时,得到的产品表面有较多微晶(见图 2(a))。根据式(1),加热后若FeCl3·6H2O分解不完全,高温下可能有少量Cl−存在,其离子强度较低,传质速度比硫酸盐快而且均匀,减小了硫酸盐离子对晶粒法向生长的界面控制,因而生长出的晶体较小,并往球形颗粒发展。采用干法制备时,由于没有添加任何酸碱,加热后在体系中发生的化学反应也可用式(1)解释,片状晶体表面有接近球形的微晶颗粒,也是受少量 Cl−存在的影响。根据式(2),加入NaOH后,在高温下形成的熔融盐离子溶液中,有大量Cl−存在(如图2(b)所示),产品晶型大部分聚集成珊瑚状,放大后可见晶型为较厚的六角形片状,验证了 Cl−的影响。而加入氨水时(如图 2(c)所示),虽然有大片的晶体生长,但是形状很不规则,容易断裂,同时有部分晶粒团聚成“晶簇”并阻碍其继续生长,根据式(3)可以推断:由于高温下坩埚中有2种气体产生,在原来混合均匀的前驱体粉末中产生无规则的气体对流,高温下在助熔剂的熔化过程中,原有的温度分布梯度被打乱,根据文献[11],在晶体生长过程中,温度场的不均匀性和非轴向对称性会使晶体产生热应力并引起晶体缺陷,可导致晶体生长过程中产生断裂与晶簇。
而在前驱体中加入稀硫酸时,得到的最终产品表面光滑,形状规则,晶体生长形态较好(如图2(d)所示)。这是因为稀硫酸的加入能促进体系中HCl的挥发,减小高温熔液中Cl−的残余,且其SO42−与助熔剂体系的离子相同,对熔液中晶体生长的环境影响很小,可维持熔液成分不变,使得晶体生长环境较稳定,减少晶体生长过程中晶体缺陷的产生(如式(4)所示)。加入稀硫酸的液相法制得的粉体厚度减小到0.6~0.7 μm,因此,在液相法制备前驱体的过程中,不同的酸碱条件也会影响最终产品的形貌。
2.2 片状Fe2O3晶体的生长机理及缺陷
对上述结果进行分析,可推断在复合硫酸盐(Na2SO4+ K2SO4)中Fe2O3晶体的生长机理。
在高温熔液中,颗粒的生长过程主要受扩散机制或界面反应机制控制[12]。由扩散机制控制的生长过程形成的粉体颗粒为球形,在界面反应机制控制下颗粒则按一定取向生长。从图1和图2都可以看到:在复合硫酸盐中生成的片状氧化铁晶体呈六方板状。可认为其生长在法向上受到抑制,沿二维特定方向生长,因此,可推测在高温复合硫酸盐中氧化铁晶体的生成主要受界面反应机理控制,生成的晶体形貌规则,晶态一致,这也是助熔剂法的主要优势。
而在实际结晶过程中,受到杂质、应力或环境稳定性作用,晶体会形成各种缺陷。从图 2(a)可看到Fe2O3生长成鳞片状不规则晶体,在其晶体尺寸较大时更加明显。从图 2(c)可看到晶体的断裂与镶嵌等宏观缺陷,这是晶体的生长环境不稳定而产生的。这些缺陷的形成证实了Cl−的存在对晶体生长环境的干扰。然而,从图2(d)中正中间晶体的形貌可以看到:其晶体平面沿着螺旋轴旋转生长,经分析认为这是螺型位错的表现。α-Fe2O3的生长基元为Fe-O6八面体[13],晶体呈六方板状结构,生长界面结构可认为是光滑平面,晶体呈层状生长。根据位错理论,在气相或溶液中层状生长出的晶体表面,有时可以观察到高螺旋式的生长台阶,生长界面为一连续的螺旋面,这是螺型位错存在的宏观显露[14]。由此可见,图2(d)中该晶体形貌应是螺型位错存在的宏观表现。究其原因,可认为由于实验中使用坩埚作为容器,在高温下坩埚和助熔剂的热膨胀系数不同,对晶体生长的界面产生热应力。当该应力的作用超过晶体承受限度时,就使得晶体生长平面出现滑移,促使位错现象发生。
从图2(b)可以看到:产品中存在尺寸相差较大的2类粒子,其中,大的呈显著片状,小的径厚比低,但也呈六方板状,仍为同种晶型。这是由于 Fe2O3晶体生长速度过快,在有限的熔液空间里,出现的一种竞争生长现象[15]。在竞争生长过程中,晶粒存在1个临界半径Rc,为10−6m级,晶粒半径小于临界半径Rc的晶粒将会消融,由此产生的Fe和O又不断在大于临界半径的晶粒上生长,从而逐渐出现粒径相差比较大的2类晶粒。1 100 ℃时,该过程可用式(5)和(6)来表示:


2.3 助熔剂用量的影响
以复合硫酸盐(Na2SO4+ K2SO4)作为助熔剂,采用液相法制备前驱体,在复合硫酸盐与FeCl3·6H2O物质的量比n分别为1,2,3,4,5和6时,考察不同助熔剂用量对氧化铁晶体形貌的影响。当n=1时,得到黑色团聚物质,无片状粉体形成;当n≥2时,开始有较多片状粉体产生。为了更好地分析助熔剂用量对片状氧化铁粒径的影响,分别取n为 2,3,4,5和 6时获得的产品进行激光粒度分析,得到n与样品粉体平均粒径的关系如图3所示。
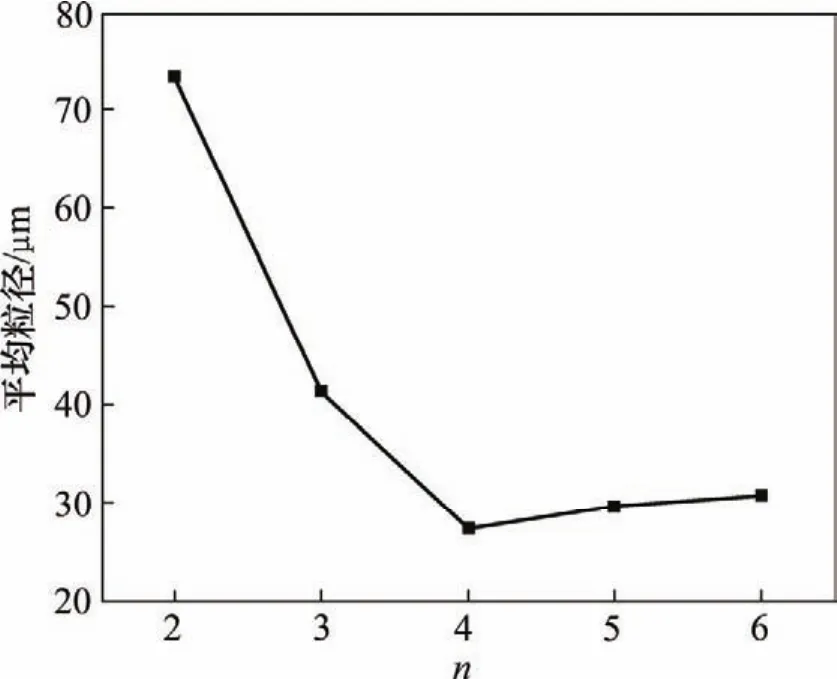
图3 复合硫酸盐用量对片状Fe2O3平均粒径的影响Fig.3 Effect of sulfate dose on mean particle diameters of flaky iron oxide powders
从图3可以看出:当n<4时,随着n的增大,粒径迅速减小;而当助熔剂的用量n>4时,粉体的粒径又逐渐增大。这是因为当助熔剂的用量过低时,高温下晶体的生长空间受限,部分晶体无法正常生长,晶体缺陷较多,所以,团聚现象十分严重,导致测得的粒径很大。而当助熔剂的用量n增大时,这些情况逐渐减少,达到适当比例后,即n=4时,反应物周围正好构成稳定的微液相环境,既控制了 Fe2O3的晶粒尺寸,又利于晶体均匀生长;而当n>4时,虽然晶体的生长空间太大,会导致部分晶粒异常生长,粒径分布范围变宽。此外,当助熔剂过量时,后期的清洗过程耗费的水量更大。由此可见,助熔剂的用量将直接影响到片状晶粒的尺寸与形貌。可确定n=4时为最佳条件,选择该比例,既有利于控制粉体尺寸并减小粒径分布范围,又可降低助熔剂的消耗量。
3 片状Fe2O3的表征
通过实验研究,在以上讨论中得到的最佳条件下,以n=4的复合硫酸盐(Na2SO4+K2SO4)为助熔剂,并加入微量的硫酸铝作为添加剂,采用液相法制备前驱体,升温至1 100 ℃保温4 h,自然冷却后,获得了质量较好的片状氧化铁粉体。图4所示为Fe2O3粉体径向和法向的形貌。

图4 液相法制得的片状Fe2O3粉体的SEM图片Fig.4 SEM images of flaky iron oxide particles prepared by liquid process
从图4可以看出:Fe2O3呈六角形片状,表面平坦光滑,粒径为30~80 μm,厚度分布较均匀,为0.4~0.6 μm,径厚比为70~110,平均径厚比为90。
为了进一步确定以上条件下合成的片状氧化铁粉体的成分,对其进行XRD分析,结果如图5所示。将该谱图与JCPDS卡的赤铁矿型α-Fe2O3进行对比,各衍射峰位基本符合,这表明得到的产品为纯净的、具有六角赤铁矿结构的α-Fe2O3粉体。

图5 片状α-Fe2O3的XRD谱图Fig.5 XRD patterns of flaky iron oxide powders
4 结论
(1) 前驱体的制备方法对产品形貌有较大影响。与干法相比,液相法得到的最终产品厚度更小,形貌更规则。而在液相法中,加入不同的酸碱,也会对最终产品的形貌有较大影响。
(2) 高温熔液中片状氧化铁晶体的生长由界面反应机理控制,前驱体的制备条件不同,会相应引起各种晶体缺陷的产生。
(3) 以分析纯的FeCl3·6H2O为原料,采用复合硫酸盐(Na2SO4+K2SO4)作为助熔剂,辅以适量添加剂,采用液相法将原料和助熔剂溶于 0.2 mol/L稀硫酸中制备前驱体,在复合硫酸盐与FeCl3·6H2O的物质的量比n=4的最佳条件下,合成了厚度为0.4~0.6 μm,平均径厚比为90的片状氧化铁粉体,形貌规则呈六角形片状,表面平坦光滑,其成分为纯相赤铁矿型α-Fe2O3。
[1] 曹智, 叶红齐, 周永华. 片状氧化铁的特性、制备及应用[J].涂料工业, 2003, 33(7): 53−55.CAO Zhi, YE Hong-qi, ZHOU Yong-hua. The characterizes,preparation and apply of flaky iron oxide[J]. Industry of Pigment,2003, 33(7): 53−55.
[2] ZHANG Fan, SHEN De-zhong, SHEN Guang-qiu, et al. Crystal growth of ZnO by flux method[J]. Journal of Synthetic Crystals,2007, 37(3): 551−556.
[3] Nakachi Y, Ueda K. Single crystal growth of LaCuOS by the flux method[J]. Journal of Crystal Growth, 2008(311): 114−117.
[4] Nobuoka S. Method for manufacture of micaceous alpha-iron oxide. US, 3987156[P]. 1976−10−19.
[5] 李振民, 刘跃进, 熊双喜. 云母氧化铁的制备与应用[J]. 无机盐工业, 2002, 34(6): 29−30.LI Zhen-min, LIU Yue-jin, XIONG Shuang-xi. Preparation and apply of micaceous iron oxide[J]. Inorganic Chemicals Industry,2002, 34(6): 29−30.
[6] 郑雅杰, 符丽纯. 硫铁矿烧渣水热法制备氧化铁[J]. 中南大学学报: 自然科学版, 2007, 38(4): 674−680.ZHENG Ya-jie, FU Li-chun. Preparation of ferric oxide from pyrite cinders by hydrothermal method[J]. Journal of Central South University: Science and Technology, 2007, 38(4):674−680.
[7] 张冰, 曹传宝, 许亚杰, 等. 熔盐法合成莫来石晶须[J]. 无机化学学报, 2005, 21(2): 277−280.ZHANG Bing, CAO Chuan-bao, XU Ya-jie, et al. Synthesis of mullite whiskers using salt flux method[J]. Chinese Journal of Inorganic Chemistry, 2005, 21(2): 277−280.
[8] KAN Yan-mei, JIN Xi-hai, WANG Pei-ling, et al. Anisotropic grain growth of Bi4Ti3O12in molten salt fluxes[J]. Mater Res Bull, 2003, 38(4): 567−576.
[9] 郝华, 刘韩星, 欧阳世翕. 熔盐法合成钛酸锶铋[J]. 硅酸盐学报, 2006, 34(7): 815−817.HAO Hua, LIU Han-xing, OUYANG Shi-xi. Synthesis of strontium bismuth titanate by the molten salt method[J]. Journal of the Chinese Ceramic Society, 2006, 34(7): 815−817
[10] Kimura T, Takanashi T, Yamaguchi T. Preparation and characteristics of Ni-ferrite powders obtained in the presence of fused satts[J]. J Mater Sci, 1980, 15(6): 1491−1497.
[11] 张克从, 张乐潓. 晶体生长科学与技术[M]. 北京: 科学出版社, 1997: 479−489.ZHANG Ke-cong, ZHANG Le-hui. The science and technology of crystal growth[M]. Beijing: Science Press, 1997: 479−489.
[12] Cahn J W. On the morphology stability of growth crystals in Crystal Growth[M]. Oxford: Pergamon Press, 1967: 1−40.
[13] 仲维卓, 华素坤. 晶体生长形态学[M]. 北京: 科学出版社,1999: 114−123.ZHONG Wei-zhuo, HUA Su-kun. The morphology of crystal growth[M]. Beijing: Science Press, 1999: 114−123.
[14] Kröner E. Benefits and shortcomings of the continuous theory of dislocations[J]. International Journal of Solids and Structures,2001, 38(6/7): 1115−1134.
[15] 张国青, 孙萍, 熊波, 等. 氧化锌纳米晶体的生长及生长机理分析[J]. 材料科学与工程学报, 2006, 24(2): 286−288.ZHANG Guo-qing, SUN Ping, XIONG Bo, et al. Growth of the ZnO nanocrystals and analysis of its growth mechanism[J].Journal of Materials Science and Engineering, 2006, 24(2):286−288.
