壳聚糖中胺基对其抑菌性能的影响及与DNA的作用
2010-09-15李小芳冯小强伏国庆苏中兴
李小芳,冯小强,伏国庆,杨 声*,苏中兴
1天水师范学院生命科学与化学学院;2天水市中医医院化验科,天水 741001;3兰州大学化学化工学院,兰州 730000
壳聚糖中胺基对其抑菌性能的影响及与DNA的作用
李小芳1,冯小强1,伏国庆2,杨 声1*,苏中兴3
1天水师范学院生命科学与化学学院;2天水市中医医院化验科,天水 741001;3兰州大学化学化工学院,兰州 730000
采用抑菌圈法研究了壳聚糖对大肠杆菌(E.coli)和金黄色葡萄球菌 (St.aureus)的抑菌活性。利用壳聚糖的席夫碱反应,对壳聚糖的胺基进行保护后,研究了壳聚糖中胺基对其抑菌性能的影响。同时,运用紫外吸收光谱和电化学的方法,研究了壳聚糖与 DNA的相互作用,提出了壳聚糖对E.coli和St.aureus的抑菌机理。研究结果表明,壳聚糖对E.coli和St.aureus具有很好的抑制作用,且抑菌活性与其胺基有关;壳聚糖能与细胞内带负电的核酸结合,使细胞正常DNA复制生理功能受到影响,抑制细菌的繁殖,从而达到抑菌的目的。
壳聚糖;抑菌活性;希夫碱;胺基;DNA
壳聚糖(Chitosan,简称 CTS)是甲壳素脱乙酰的产物,来源丰富、无毒,是可吸收降解的直链状高分子化合物。壳聚糖及其衍生物具有广谱的抗菌性能,可抑制多种细菌和真菌的生长[1-5]。但是,就其确切的抑菌机理目前尚不清楚。Young等认为壳聚糖可吸附于细菌表面,与细菌细胞膜作用而改变其通透性[6];Helander等提出,壳聚糖对革兰氏阴性菌的抑菌作用是由于细胞外膜被破坏,最终造成菌体死亡[7];Hadwiger提出以细菌分子中DNA为作用靶向的抗菌机理[8];Tokura等认为壳聚糖吸附细菌后,壳聚糖分子包埋了整个细胞,抑制了细菌的呼吸和营养物质的进入而导致细菌死亡[9];Papineu等研究认为壳聚糖的抑菌作用可能是由于它导致了细胞内物质的泄漏而引起的[10]。普遍认为壳聚糖的抑菌机理存在以下几种可能:(1)壳聚糖干扰菌体细胞膜的功能,从而达到抑菌的效果;(2)壳聚糖直接与菌体的DNA和mRNA作用;(3)壳聚糖激活几丁质酶,达到抑菌的目的;(4)壳聚糖中的胺基在起抑菌作用;(5)壳聚糖与细胞质发生作用。其中壳聚糖对细菌 DNA的作用是基于其抗菌机理研究的推论。有一种推论认为带有正电的低分子量壳聚糖进入到细菌细胞内部,与带有负电的DNA作用,干扰其复制,或阻碍mRNA的合成。刘晓非等用激光共焦显微镜对异硫氰酸荧光素 (FITC)标记的低分子量壳聚糖 (Mw≤8000)与大肠杆菌作用的观察,发现具有抗菌性的壳聚糖齐聚物进入到了细菌细胞的内部[11]。
一般认为壳聚糖的抑菌性能主要由-NH2引起的。利用壳聚糖上的胺基与醛 (或酮)发生反应生成相应的醛 (或酮)亚胺化衍生物[12,13],对胺基进行了保护后,研究了壳聚糖中的胺基对壳聚糖抑菌性能的影响。运用紫外吸收光谱和电化学分析的方法,研究了壳聚糖与 DNA的相互作用,初步提出了壳聚糖对E.coli和St.aureus的抑菌机理。该研究为壳聚糖的临床应用提供更加充分的实验依据,并扩大了壳聚糖在医药和食品工业等领域的应用。
1 实验部分
1.1 材料与仪器
大肠杆菌 (E.coli,ATCC 35218),金黄色葡萄球菌 (St.aureus,ATCC 26113)。相对分子量 50,000的壳聚糖 (浙江玉环壳聚糖有限公司,DD.98%), DNA(美国 Sigma公司),其纯度通过比较 260与280 nm处吸光度来确定 (A260/A280=1.87)。牛肉膏蛋白胨培养基[14]。0.1 mol/L磷酸盐缓冲液由NaH2PO4-Na2HPO4配制;试剂均为分析纯,实验用水均为二次蒸馏水,电化学实验均在室温条件下通氮气 10 min后进行。
UV-9200型紫外可见分光光度计 (北京瑞利分析仪器公司);Spectrum One FT-I R(Perkin Elmer); TG-TDA(Pyris Diamond TG/DTA);EC-12B型多功能微机电化学分析仪 (江苏江分电分析仪器公司),三电极系统 (工作电极:金电极,辅助电极:铂丝电极,参比电极:Ag-AgCl电极)。
1.2 抑菌圈法测定壳聚糖的抑菌活性[15]
抑菌圈法是将含有定量抗生素的滤纸片贴在已接种了测试菌的琼脂表面上,纸片中的药物在琼脂中扩散,随着扩散距离的增加抗生素的浓度呈对数减少,在药物浓度到达的范围内对此药敏感的细菌不能生长而形成透明的抑菌圈,不同细菌形成的抑菌圈各不相同,抑菌圈的大小反映了测试菌对该药的敏感程度。如果抑菌剂能杀死或抑制皿中供试菌的生长,则在滤纸片的周围会出现一个无菌生长的透明圈,即抑菌圈。以抑菌圈的直径作为评定指标,抑菌圈直径越大,说明该抑菌剂对此种供试菌的抑制效果越好,反之则抑制效果越差将受试菌种接种于固体琼脂培养基,37℃活化E.coli24 h,St.aureus活化48 h。将活化后的受试菌种用接种环挑取菌苔于生理盐水中,制成 O.D630(E.coli)=0.745;O.D 630(St.aureus)=0.624的菌悬液备用。取直径 6 mm已灭菌的圆滤纸片放入浓度分别为 5 mg/mL、2.5 mg/mL、1.25 mg/mL的壳聚糖溶液(溶于 1.0% HAc)中浸泡。将 0.1 mL菌悬液涂布在培养基平板上,用无菌镊子取浸泡过的圆滤纸片贴于培养皿中,每皿贴 5片。以 1.0%的 HAc溶液作为空白对照。37℃恒温培养 48 h,测定圆滤纸片的抑菌圈直径。
1.3 壳聚糖席夫碱的制备
一定量壳聚糖溶于 20 mL 3.0%HAc搅拌溶胀30 min,加 20 mL无水乙醇稀释,转入 100 mL圆底烧瓶中,将用 10 mL乙醇分别稀释的醛 (甲醛、苯甲醛、呋喃甲醛、正丁醛)滴入(η-NH2:η-CHO=1:6),水浴加热控制温度 (80℃),回流 5 h。反应快结束时,调 pH到 9~10,抽滤,沉淀用 20 mL无水乙醇和乙醚反复洗涤除过量的醛,烘干后继续在索氏萃取器中用 95%乙醇回流 8 h,恒温干燥分别得到的壳聚糖席夫碱衍生物。
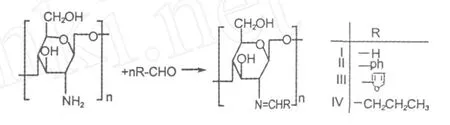
图 1 希夫碱反应方程式Fig.1 The synthesis of Schiff’s base
1.4 壳聚糖席夫碱的表征
1.4.1 红外吸收光谱测定
采用 KBr压片法,Spectrum One傅立叶红外光谱仪 (Perkin E lmere)测量壳聚糖及席夫碱的红外吸收光谱,测量波长数为 400~4000 cm-1。
1.4.2热重-差热(TG-DTA)分析
采用 Perkin Elmere TG-DTA分析仪 (Pyris Diamond Analyzer),以α-Al2O3为参比,升温速率 10℃/min,对壳聚糖及席夫碱热力学分析。
1.5 席夫碱抑菌活性分析
称取壳聚糖及其希夫碱各 50 mg研磨成粉末,溶于 10 mL 1.0%的 HAc溶液中,配成浓度为 5 mg/ mL的溶液待用。含有15 mL液体培养基和4 mL壳聚糖或席夫碱的试管灭菌后,分别加入 1 mL的E. coli(OD600nm=0.473)或St.aureus(OD600nm= 0.435),使壳聚糖及席夫碱最终浓度为 1 mg/mL;用4 mL 1.0%的 HAc溶液作为空白对照。37℃摇床培养,分光光度计下测定不同时间内O.D610 nm。
1.6 壳聚糖与DNA相互作用紫外吸收光谱
在 1 cm×1 cm石英比色管中加入一定量的Tris-HCl缓冲液、2μL的DNA溶液和 80μL 1%已在 121℃灭菌了 15 min的壳聚糖溶液,用二次蒸馏水稀释至刻度,以不含DNA的 Tris-HCl缓冲液为试剂空白,于 200~600 nm波长范围内测定DNA与壳聚糖相互作用后的紫外吸收光谱。
1.7 壳聚糖与DNA相互作用的电化学研究
金电极分别用金相砂纸和在麂皮上用 0.5μm和 0.3μm的α-Al2O3研磨液研磨,再用二次蒸馏水、乙醇、丙酮超声清洗各 5 min,然后浸入新配制的Piranha(VH2SO4∶VH2O2(30%)=7∶3)溶液中 10 min,用二次蒸馏水和乙醇超声清洗干净,氮气吹干即可。以 0.1 mol/L的空白NaH2PO4-Na2HPO4缓冲液(pH=6.5)为支持电解质。先将三电极体系放入空白缓冲液中,在-0.2~1.5 V电位范围内循环伏安扫描至电流稳定为止。处理好的金电极其表面干燥后,滴加 20μL 1.0 mg/mL的 DNA溶液,置于冰箱中干燥 6 h以上。采用传统的三电极体系,以修饰电极为工作电极,铂片电极为对电极,Ag-AgCl电极为参比电极,扫描范围为-0.2~1.5 V(所有实验均在室温下进行)。
2 结果与讨论
2.1 壳聚糖对E.coli和St.aureus的抑菌活性
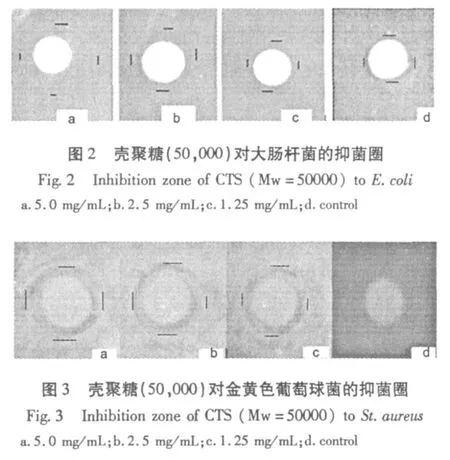
不同浓度壳聚糖对E.coli和St.aureus对应的抑菌圈直径如图 2,3所示。可以看出,壳聚糖作用E.coli和St.aureus后,均具有明显的抑菌圈,且随着壳聚糖浓度的增加,与对照组相比抑菌圈的直径逐渐增加,说明壳聚糖对E.coli和St.aureus的生长有较好的抑制作用。
2.2 壳聚糖席夫碱衍生物的表征
2.2.1 红外光谱
图 4是壳聚糖、壳聚糖-Ⅰ、壳聚糖-Ⅱ、壳聚糖-Ⅲ、壳聚糖-Ⅳ的 FT-IR图。其中,3441.0 cm-1处是壳聚糖形成氢键缔合的-OH伸缩振动吸收峰与-NH2的伸缩振动吸收峰重叠而增宽的多重吸收峰, 1599.4 cm-1处是氨基的 N-H特征吸收峰,1651 cm-1处是酰胺吸收峰。壳聚糖席夫碱在 1599.4 cm-1的N-H特征吸收峰消失,这说明-NH2已经得到了保护;1638 cm-1附近的吸收峰归属 C=N伸缩振动,证明-NH2和-CHO基团发生了反应。

图 4 壳聚糖、壳聚糖-Ⅰ、壳聚糖-Ⅱ、壳聚糖-Ⅲ和壳聚糖-Ⅳ的红外光谱Fig.4 I R spectra of chitosan and Schiff’s base
2.2.2 热重分析
壳聚糖和其席夫碱的 TG如表 2所示。壳聚糖的降解分为三个阶段[16]:第一个阶段在 80℃开始,失重 10%,主要是失去水分子;第二个阶段失重在250℃开始,到 500℃失重达最大,失重 55%;最终分解温度为 688℃。四种壳聚糖席夫碱衍生物主链断裂的温度明显低于壳聚糖主链断裂的温度,这表明壳聚糖的席夫碱衍生物与壳聚糖相比不稳定,它们的不稳定性是由于缺少自由的氨基,在制备衍生物时氨基被醛取代,壳聚糖因其有自由的氨基而更稳定[17]。
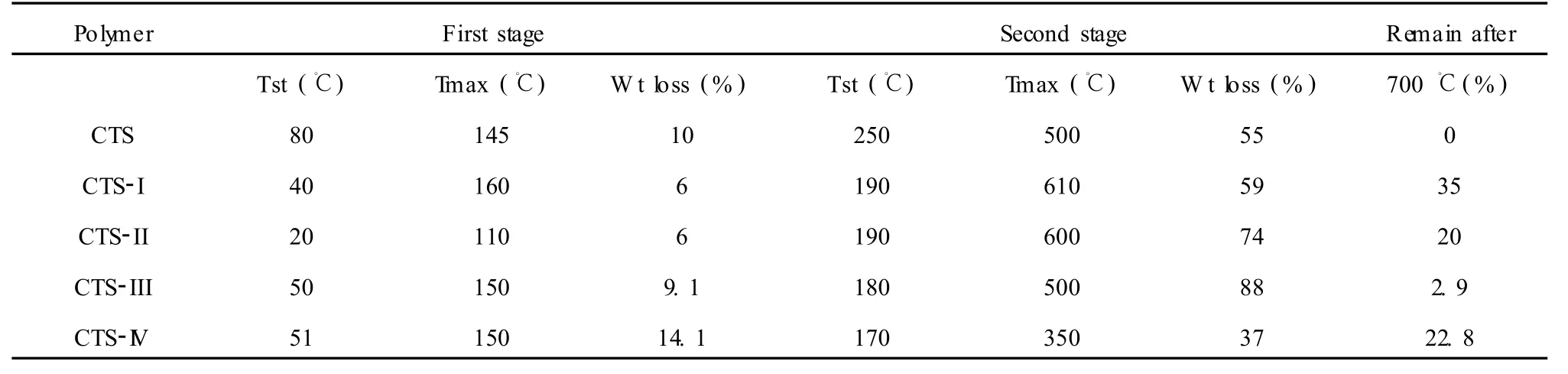
表 1 壳聚糖和席夫碱的 TG数据Table 1 Thermograv imetry analysis of chitosan and schiff’s bases
2.3 壳聚糖及席夫碱对E.coli和St.aureus抑菌活性
图 5是壳聚糖及席夫碱衍生物作用E.coli和St.aureus后不同时间内 O.D610nm的变化。可以看出壳聚糖席夫碱的 O.D610nm均高于壳聚糖,和对照组的O.D610nm相差不大,说明改性的壳聚糖抑菌活性大大降低。并且发现随着时间的延长,苯甲醛与壳聚糖的席夫碱对E.coli有微弱的抑制作用,这可能是结构中含有苯环的缘故。席夫碱改性后的壳聚糖几乎失去了抑菌的功能,同时也说明壳聚糖对E.coli和St.aureus的抑制作用主要与-NH2的质子化有关。

图 5 壳聚糖及希夫碱作用E.coli(a)和St.aureus(b)后的 O.D610nmFig.5 O.D610nmof different Chitosan Schiff bases toE.coliandSt.aureus
2.4 紫外光谱研究壳聚糖与DNA相互作用
由于核酸分子本身有光吸收活性,许多外来分子与核酸结合后,对核酸或外来分子的吸收都有影响。紫外-可见吸收光谱法是研究外来分子与核酸相互作用机理的最常用、最方便的方法。含有芳香性和磷酸生色基团双螺旋结构的DNA分子,其UV-vis吸收光谱在 260 nm附件有一强的吸收峰,某些小分子亦有吸收谱带,可根据相互作用前后DNA或其他分子的吸收谱带的变化对二者相互作用模式进行判断。增色、减色效应是DNA特有的与其双螺旋结构密切相关的光谱性质。对 DNA的吸收光谱来说,如果导致分子的轴向变化即其构象变化,则产生减色效应及红移现象,且作用越强减色效应越明显;如果导致 DNA双螺旋结构的破坏,则产生增色效应[18]。对于外来分子的特征吸收谱带,若该分子与DNA发生嵌插作用,则该分子的吸收光谱发生减色效应和红移现象,且作用越强减色效应越明显;若该分子与DNA发生静电作用,紫外吸收光谱峰将出现较小的红移,且减色效应不明显[19]。
图 6为壳聚糖加入后 DNA的紫外吸收光谱。壳聚糖在 260 nm附近没有紫外吸收,DNA在 260 nm出现吸收峰,且随着加入壳聚糖浓度的增加, DNA吸收光谱产生了明显的增色效应和较小的红移。这些结果表明壳聚糖与 DNA之间可能由于静电作用,发生相互作用而形成了新的复合物,导致DNA双螺旋结构破坏。
2.5 电化学分析
壳聚糖与DNA作用的循环伏安曲线如图 7所示。曲线 a,b,c分别表示裸金电极、DNA修饰金电极以及壳聚糖-修饰金电极在缓冲溶液中的循环伏安图。裸金电极曲线是典型的可逆的氧化还原过程,峰电流相对较大,0.55 V附近的还原峰是对应的金氧化物的还原。DNA修饰金电极在 0.7 V附近产生了一个新峰。然而,在DNA修饰金电极上加入壳聚糖后,循环伏安曲线发生了明显的变化,氧化还原峰电流急剧减小,而且没有新的氧化还原峰出现,这表明壳聚糖与 DNA分子之间发生了键合作用,形成的非电活性化合物不能在电极表面发生氧化还原反应。溶液中自由壳聚糖分子的浓度减少,单位时间迁移到电极表面的壳聚糖分子数下降,导致峰电流减少。

图 6 壳聚糖溶液的紫外吸收光谱Fig.6 Change ofUV spectra of the complex in the absence and presence of different concentrations ofDNA
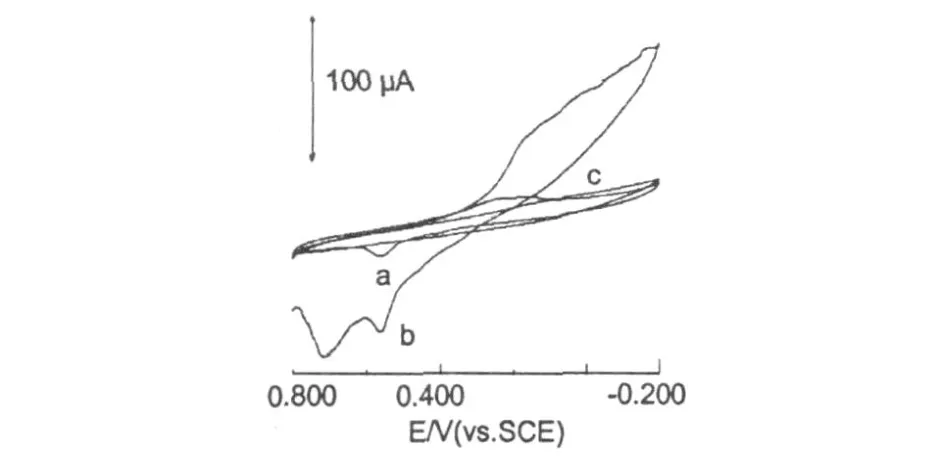
图 7 壳聚糖与DNA作用前后在缓冲溶液中的循环伏安图Fig.7 Cyclic voltammetry ofDNA and after incubation with chitosan in 0.1 mol/LNaH2PO4-Na2HPO4(pH 6.5)
3 结论
3.1 壳聚糖对E.coli和St.aureus有良好的抑制作用,壳聚糖的抑菌活性与其-NH2有关。
3.2 壳聚糖可能有一部分进入细菌细胞内部,与DNA之间由于静电作用而形成了新的复合物,导致DNA双螺旋结构破坏,进而抑制细菌的繁殖。DNA与壳聚糖的可能作用模型如图 8所示。

图8 DNA与壳聚糖的作用模型Fig.8 Action models ofDNA and chitosan
1 Sai GJ,Su WH.Antibacterial activity of shrimp chitosan against Escherichia coli.J Food Prot,1999,62:239-243.
2 JumaaM,Furkert FH,MullerBW.A new lipide emulsion for mulation with high ant imicrobial efficacy using chitosan.Eur J Phar m B iophar m,2002,53:115-123.
3 RhoadesJ,Roller S.Antimicrobial actionsof degraded and native chitosan against spoilage organis ms in laboratory media and foods.Appl Environ M icrobiol,2000,66:80-86.
4 Mathivanan N,Kabilan V,Murugesan K.Purification,characterization,and antifungal activity of chitinase fromFusarium chlam ydosporum,a mycoparasite to groundnut rust Puccinia arachidis.Can J M icrobiol,1998,44:646-651.
5 Xie Y(谢勇),Xie ZX(谢正兴),Zhou NJ(周南进),et al. The study of antibacterial effectof chitosans and their derivativeson Helicobacterpyloriin vitroand influence factor.Chin Phar m Bull(中国药理学通报),2005,11:1343-1347.
6 Young DH,Kohle H,Kauss H.Effect of chitosan on membrane per meability of suspension-culturedGlycine m axandPhaseolus vulgariscells.Plant Physiol,1982,70:1449-1454.
7 Helander IM,Nurmiaho-Lassila EL,et al.Chitosan disrupts the barrierproperties of the outermembrane of gram-negative bacteria.International J Food M icrobiology,2001,71:235-244.
8 Tharanathan RN,Kittur FS.Chitin-the undisputed biomolecule of great potential.Crit Rev Food SciNutr,2003,43:61-87.
9 Tokura SK,Ueno S,Miyazaki.Molecularweight dependent antimicrobial activity of chitosan.Macromol Symp,1997,120:1-9.
10 Papineau AMD,Hoover G,Knorr D.Antimicrobial effect of water-soluble chitosans with high hydrostatic pressure.Food B iotechnology,1991,5:45-57.
11 Xiao FL,Yun LG,Dong ZY,et al.Antibacterial action of chitosan and carboxymethylated chitosan.J Applied PolymerSci, 2001,79:1324-1335.
12 Jacek D.Some aspects of the reaction between chitosan and formaldehyde.J M accrom ol Sci Chem,1983,20:877.
13 Tang ZX(唐振兴),Qian JQ(钱俊青),Ge LJ(葛立军),et al.Chitin/chitosan and its derivatives and its latest progress in the chemicalmodification.Hangzhou Chem Indus(杭州化工),2003,33(4):16-20.
14 Shen P(沈萍),Fan XR(范秀荣),Li G W(李广武).Experiment ofMicrobiology.Beijing:High Education Press,2003.53.
15 Yang TC,Chou CC,LiCF.Antibacterial activity ofN-alkylated disaccharide chitosan derivatives.Int J Food M icrobiol, 2005,97:237-245.
16 Jiang TD(蒋挺大).Chitosan(壳聚糖).Beijing:Chemistry Industry Press,2001.17-18.
17 Toshihiko T,AmornrutC,RobertJL.Structure and bioactivity of sulfated polysaccharides.Trends in Glycoscience and Glycotechnology,2003,15:29-46.
18 Du JY(杜江燕),Huang XH(黄晓华),Xu F(徐飞),et al. Spectral study on the interactionmechanis m between thionine and calf thymusDNA.Spec Spectral Anal(光谱学与光谱分析),2005,25:1435-1438.
19 Zhang F(张芳),ZhangQQ(张前前),Zhu CJ(祝陈坚),et al.Synthesis and DNA binding spectroscopy studies of Cu (Ⅱ)-Thr-Phen.Spec Spectral Anal(光谱学与光谱分析), 2005,25:1439-1442.
Interaction of Chitosan with DNA and Effect of Am ino Group on Antibacterial Activity
L IXiao-fang1,FENG Xiao-qiang1,FU Guo-qing2,YANG sheng1*,SU Zhong-xing3
1College of Life Science and Chem istry,Tianshui Nor m al University;2TraditionalM edical hospital of Tianshui,Tianshui 741001,China;3Chem istry and Chem ical Engineering College,Lanzhou University,Lanzhou 730000,China
The antibacterial activity of chitosan against Escherichia coli and Staphylococcus aureus were investigated by measuring inhibition zone.Aimed to explain the effect of amino group on antibacterial activity of chitosan,four different kinds of chitosan Schiff’s baseswere synthesized.UV absorption spectroscopy and electrochemical analysiswere used to illuminate the interaction of chitosan with DNA.The results showed that the antibacterial ability of chitosan was related to the amino group.Chitosan can bind with negative nucleic acids in cell,affect the normal replication function of DNA and ultimately inhibit the growth of bacteria.
chitosan;antibacterial activity;Schiff’s base;amino group;DNA
Q946.91;R285
A
1001-6880(2010)03-0373-06
2009-04-07 接受日期:2009-07-03
甘肃天水师范学院物理无机化学重点学科基金
*通讯作者 Tel:86-532-88963253;E-mail:ysh@mail.tsnc.edu.cn
