水杨酸和壳聚糖对NaCl胁迫下黄瓜种子萌发的促进作用
2010-09-13张志刚尚庆茂
张志刚 尚庆茂
(中国农业科学院蔬菜花卉研究所,北京 100081)
水杨酸和壳聚糖对NaCl胁迫下黄瓜种子萌发的促进作用
张志刚 尚庆茂*
(中国农业科学院蔬菜花卉研究所,北京 100081)
以黄瓜津优1号为试材,采用0.1mmol·L-1水杨酸(SA)、50mg·L-1壳聚糖(CTS)溶液浸种,测定了100mmol·L-1NaCl胁迫下黄瓜种子发芽势、发芽率及α-淀粉酶、脱氢酶、磷酸酶活性等指标。NaCl胁迫下,黄瓜种子萌发受到明显抑制,发芽势、发芽率分别比清水对照降低31.3、25.6个百分点;SA、CTS单一或共同浸种处理提高了NaCl胁迫下黄瓜种子发芽率及相关酶活性,且SA、CTS共同浸种的效果优于SA、CTS单一处理,发芽率比NaCl胁迫处理增加19.2个百分点,α-淀粉酶、脱氢酶、磷酸磷活性分别比NaCl胁迫处理增加24.7 %、16.2 %、24.1 %。说明SA、CTS对NaCl胁迫下黄瓜种子萌发具有明显的促进作用,且两者呈协同效应。
水杨酸;壳聚糖;盐胁迫;黄瓜种子
随着设施蔬菜的发展,设施内特有的小气候以及不当的栽培管理措施(施肥量大且偏重化肥、地温高、蒸发旺盛、无雨水冲淋等),土壤次生盐渍化日趋明显,已成为制约蔬菜高产、优质、可持续发展的主要因素(史庆华 等,2004)。盐胁迫下,黄瓜(Cucumis sativus L.)种子发芽率、胚根长、下胚轴长、胚根和下胚轴鲜(干)质量、侧根数均降低(曾秀存和许耀照,2008)。盐胁迫抑制种子萌发主要来自3个方面:一是渗透胁迫,种子萌发过程中,渗透胁迫造成植物细胞生理缺水,从而影响种子萌发;其次是破坏细胞质膜,盐胁迫使膜透性增大,导致溶质外渗,电解质渗透率增大,导致种子萌发受阻;三是离子毒害,盐胁迫下,过量的Na+导致植物细胞膨胀、变异和取代质膜,破坏细胞膜的选择透性,使细胞内离子大量外渗,造成胞内离子不平衡,破坏细胞的正常生理功能(刘洪兰 等,2008)。水杨酸(salicylic acid,SA)、壳聚糖(chitosan,CTS)是植物抗病反应和诱导植物对非生物逆境反应的抗逆信号分子,两者均能诱导植物体内抗病相关蛋白(PRs)产生,提高保护酶活性,增加渗透调节物质及次生代谢产物含量,从而提高植物的抗病性、耐盐性及抗热性等(Romanazzi et al.,2003;Agarwal et al.,2005),说明SA、CTS两种信号转导途径之间可能存在交叉作用。前人研究结果已证明,SA、CTS单一施用可提高黄瓜幼苗耐盐性(宋士清 等,2006;尚庆茂 等,2007),而关于两者共同施用对植物抗逆性特别是盐胁迫下黄瓜种子萌发方面的研究鲜见报道。为此,笔者研究了SA与CTS共同浸种对盐胁迫下黄瓜种子萌发的影响,以明确两者对提高NaCl胁迫下黄瓜种子萌发是否具有协同效应及可能的生理机制。
1 材料与方法
1.1 试验材料
黄瓜选用盐敏感品种津优1号(王广印 等,2004)。SA购自北京化学试剂公司,含量≥99.5 %,规格AR。CTS购自SIGMA公司,规格AR,脱乙酰度≥85 %。
1.2 试验处理
黄瓜种子用下述溶液浸种:① 清水(CK),未进行NaCl胁迫处理;② 清水,进行NaCl胁迫处理;③ SA0.1mmol·L-1;④ CTS50mg·L-1;⑤ SA0.1mmol·L-1+CTS50mg·L-1。种子浸泡12 h后用清水冲洗3次。塑料箱(60cm×40cm×20cm)装入1 L蒸馏水,水深1.5cm,将滤纸对折平铺在玻璃板上,揭开上层滤纸,贴在玻璃上的下层滤纸用清水浸湿,距玻璃板下边缘12cm处按一定间距放上种子(种孔朝下),将上层滤纸折叠过来覆盖种子,然后将玻璃板垂直放入塑料箱,②~⑤ 处理每天用30mL100mmol·L-1NaCl冲淋种子1次,处理 ① 用等量蒸馏水冲淋。每处理黄瓜种子30粒,随机区组设计,3次重复。
1.3 测定方法
黑暗培养3d后,调查发芽率(以芽长≥2mm为发芽标准)、胚根长(用直尺测定)、一级侧根数(记录主根上肉眼可见的长于1mm的一级侧根数)。活力指数=S×∑(Gt /dt),其中Gt为在t天的发芽数,Dt为相应的发芽天数,S为胚根鲜质量。淀粉酶活性参照Downie等(1994)方法测定;脱氢酶活性采用氯化三苯基四氮唑法(颜启传和黄亚军,1992)测定;磷酸酶活性参照陈润政(1986)的方法进行测定。
1.4 数据分析
试验数据均采用SAS软件Duncan’s新复极差法进行多重比较及差异显著性分析,数据均为3次重复的平均值。
2 结果与分析
2.1 SA、CTS对NaCl胁迫下黄瓜种子发芽率的影响
NaCl胁迫下,黄瓜种子萌发受到明显抑制(表1),种子发芽势、发芽率分别比清水对照降低31.1、25.6个百分点,活力指数比对照降低86.3%,差异达显著水平;SA、CTS单一或共同浸种处理提高了NaCl胁迫下黄瓜种子的发芽势发芽率和活力指数,且 SA与 CTS共同浸种效果优于SA、CTS单一处理,发芽势、发芽率分别比NaCl胁迫处理增加24.3、19.2个百分点种子活力指数比NaCl胁迫处理增加135.8 %。

表1 SA、CTS对NaCl胁迫下黄瓜种子萌发、生根的影响
2.2 SA、CTS对NaCl胁迫下黄瓜种子胚根长及一级侧根数的影响
从表1可知,SA、CTS单一或共同浸种处理均提高了NaCl胁迫下黄瓜种子胚根长、一级侧根数,且SA单一浸种效果大于CTS单一浸种,胚根长、一级侧根数分别比 NaCl胁迫处理提高了111.1 %、92.5 %。NaCl胁迫处理明显抑制了黄瓜种子胚根长、一级侧根数,分别比清水对照降低了80.2 %、87.4 %。
2.3 SA、CTS对NaCl胁迫下黄瓜种子酶活性的调节作用
与 NaCl胁迫处理相比,SA、CTS单一或共同浸种处理增强了黄瓜种子相关酶活性(表2),且作用大小为:SA+CTS>CTS>SA,如α-淀粉酶活性分别比 NaCl胁迫处理提高了24.7 %、18.8 %、7.8 %。
2.4 SA、CTS在NaCl胁迫下黄瓜种子萌发及酶活性中的互作效应
从表3可知,SA与CTS对NaCl胁迫下黄瓜种子发芽率、活力指数、α-淀粉酶及脱氢酶活性均存在极显著的互作效应,对磷酸酶活性两者互作效应未达到显著水平。F值大小反映处理对某一指标的影响大小,通过比较 F值可知,CTS主效应对黄瓜种子发芽率、活力指数及α-淀粉酶、脱氢酶、磷酸酶活性的影响大于SA主效应。
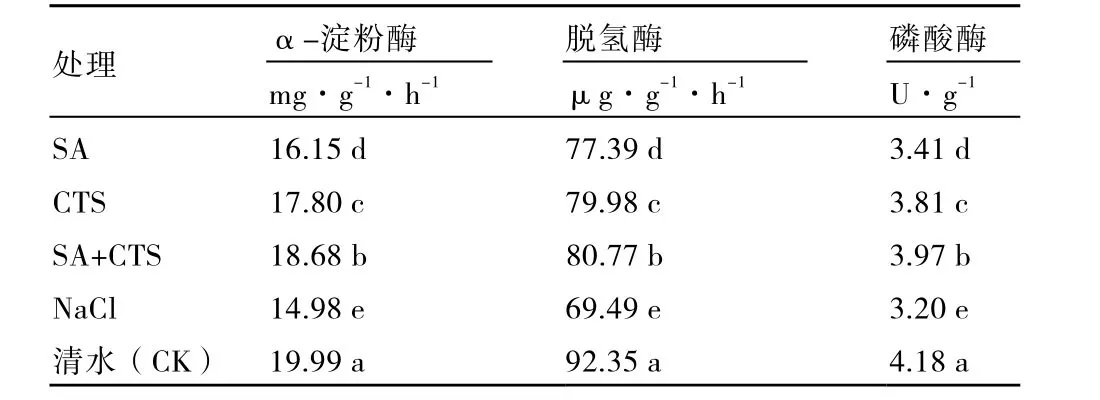
表2 SA、CTS对黄瓜种子酶活性的调节作用
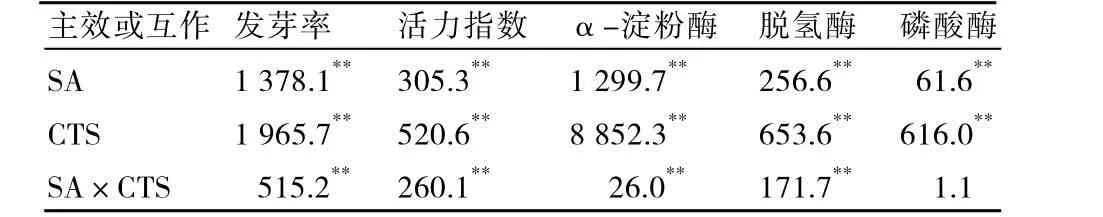
表3 SA、CTS二因素方差分析F值及差异显著性比较
3 结论与讨论
SA、CTS可作为植物抗逆反应所需的信号分子激活植物防御保护机制,在植物信号传导和抗逆反应中起关键作用(Omar et al.,2001)。SA、CTS可提高黄瓜种子抗热性(许耀照 等,2004)、耐低温性(孙艳 等,1999;舒英杰 等,2007)、耐盐性(董涛 等,2009),以及莴苣(任艳芳和何俊瑜,2008)、大麦(Wxsniewska & Chelkowski,1999)、小麦(李焰焰 等,2005;盛玮 等,2007)种子的抗盐性。本试验结果与前人研究结果一致,即SA、CTS单一或共同浸种处理均提高了黄瓜种子耐盐性,表现为发芽率升高,且SA与CTS共同浸种效果优于单一SA、CTS处理,3个处理的发芽率分别比NaCl胁迫处理增加19.2、14.1、15.8个百分点。
种子萌发依赖于水分及营养物质的供应,营养物质的供应又依赖于水解酶的活性与作用(宾金华 等,2001)。如淀粉酶降解淀粉以供应胚生长所需要的小分子糖(Nandi et al.,1995);蛋白酶降解贮藏蛋白供应各种氨基酸(郭栋梁 等,2008);脱氢酶能准确快速地反映种子胚细胞的还原能力,其酶活性大小是衡量种子活力大小的重要生理指标(乔燕祥 等,2003)。SA浸种增强NaCl胁迫下小麦种子α-淀粉酶、蛋白酶活性及可溶性糖、可溶性蛋白质和游离氨基酸的含量,进而提高种子发芽的数量、速度和质量(张士功和高吉寅,1999)。CTS包衣处理可提高 NaCl胁迫下水稻(阮松林和薛庆中,2002)、小麦(盛玮 等,2007)种子的发芽率、α-淀粉酶活性。CTS浸种提高黄瓜种子发芽率及活力指数(舒英杰 等,2007),可能与 CTS提高种子中与萌发有关的激素(GA、IAA)含量和脂肪酶(周永国 等,2002)及淀粉酶(胡景江 等,2003)活性有关。本试验结果显示,SA、CTS单一或共同浸种处理均提高了NaCl胁迫下黄瓜种子α-淀粉酶、脱氢酶及磷酸酶活性。
综上所述,SA、CTS可能通过提高NaCl胁迫下黄瓜种子的α-淀粉酶、脱氢酶及磷酸酶活性,从而促进种子萌发,SA、CTS在提高 NaCl胁迫下黄瓜种子发芽率及相关酶活性等存在极显著的互作效应。
宾金华,黄胜琴,何树春,贺立红,潘瑞炽.2001.茉莉酸甲酯对水稻种子萌发和贮藏物质降解的影响.植物学报,43(6):578-585.陈润政.1986.种子中酸性磷酸酶活性的测定.种子,(4):79-80.
董涛,张志刚,尚庆茂.2009.水杨酸和壳聚糖对黄瓜幼苗耐盐性的共诱导作用.中国蔬菜,(2):46-50.
郭栋梁,王静杰,万小荣,李玲.2008.外源脱落酸抑制花生种子发芽的生理机制.植物生理学通讯,44(5):936-938.
胡景江,左仲武,刘彦超.2003.壳聚糖对油松种子萌发及幼苗生理生化特性的影响.西北林学院学报,18(4):21-23.
李焰焰,聂传朋,董召荣.2005.盐胁迫下5-磺基水杨酸、水杨酸对小黑麦种子生理特性的影响.种子,24(1):8-10.
刘洪兰,李景富,许向阳,洪瑞,崔丽.2008.NaCI胁迫对不同番茄种子萌芽的影响.东北农业大学学报,39(5):28-33.
乔燕祥,高平平,马俊华.2003.两个玉米自交系在种子老化过程中的生理特性和种子活力变化的研究.作物学报,29(1):123-127.任艳芳,何俊瑜.2008.外源SA对盐胁迫下莴苣种子萌发和幼苗生长的影响.北方园艺,(11):11-13.
阮松林,薛庆中.2002.壳聚糖包衣对杂交水稻种子发芽和幼苗耐盐性的影响.作物学报,28(6):803-808.
尚庆茂,宋士清,张志刚,郭世荣.2007.水杨酸增强黄瓜幼苗耐盐性的生理机制.中国农业科学,40(1):147-152.
盛玮,薛建平,高翔,刘艳.2007.壳聚糖包衣对小麦种子发芽和幼苗耐盐性的影响.淮北煤炭师范学院学报,28(3):39-42.
史庆华,朱祝军,Khalid Al-aghabary,刘慧英,喻景权.2004.等渗盐胁迫对番茄抗氧化酶和ATP酶及焦磷酸酶活性的影响.植物生理与分子生物学学报,30:311-316.
舒英杰,时侠清,张子学,隋益虎.2007.壳聚糖对黄瓜种子萌发及幼苗抗冷性的效应.种子,26(1):22-25.
宋士清,尚庆茂,郭世荣,张志刚.2006.壳聚糖对黄瓜幼苗抗盐的协同生理作用研究.西北植物学报,26(3):435-441.
孙艳,秦吉全,崔鸿文,丁勤.1999.SA浸种对黄瓜幼苗耐冷性的影响.河北农业技术师范学院学报,13(1):37-40.
王广印,周秀梅,张建伟,沈军.2004.不同黄瓜品种种子萌发期的耐盐性研究.植物遗传资源学报,5(3):299-303.
许耀照,郁继华,张国斌,钟新榕,王鸿雁.2004.水杨酸对黄瓜种子萌发的高温耐性诱导.甘肃农业大学学报,39(3):290-294.颜启传,黄亚军.1992.种子四唑测定手册.上海:上海科学技术出版社:78-81.
曾秀存,许耀照.2008.不同NaCl浓度对黄瓜种子萌发特性的影响.河西学院学报,24(2):55-58.
张士功,高吉寅.1999.水杨酸和阿斯匹林对盐胁迫下小麦种子萌发的作用.植物生理学通讯,35(1):29-32.
周永国,杨越冬,齐印阁.2002.壳聚糖对花生种子萌发过程中某些生理活性的影响.花生学报,31(1):22-25.
Agarwal S,Sairam R K,Srivastavag C,Meena,R C.2005.Changes in antioxidant enzymes activity and oxidative stress by abscisic acid and salicylic acid in wheatgenotypes.Biologia Plantarum,49(4):541-550.
Downie B,Hilhorst H W,Bewley Jd.1994.A new assay for quantifying endo-β-D-mannanase activity using congo reddye.Phytochemistry,36:829-835.
Nandi S,Dasg,Senmandi S.1995.Beta-amylase activity as an index forgermination potential in rice.Annals of Botany,75(5):463-467.
Omar B,Victoriano V,Miguel A B.2001.Evidence for a role of salicylic acid in the oxidativedamagegenerated by NaCl and osmotic stress in Arabidopsis seedlings.Plant Physiol,126:1024-1030.
Romanazzig,Nigro F,Ippolito A.2003.Short hypobaric treatments potentiate the effect of chitosan in reducing storagedecay of sweet cherries.Postharvest Biology and Technology,29(1):73-80.
Wxsniewska H,Chelkowski J.1999.Influence of exogenic salicylic acid on Fusarium seedling blight reduction in barley.Acta Physidrgieae plantarum,21(10):63-66.
Promoting Effect of Salicylic Acid and Chitosan ongermination of Cucumber Seeds under NaCl Stress
ZHANG Zhi-gang,SHANG Qing-mao*
(Institute of Vegetables and Flowers,Chinese Academy of Agricultural Sciences,Beijing100081,China)
Cucumber(Cucumis sativas L.)‘Jinyou No.1’was taken as experimentalmaterial and soaked in the liquor of0.1mmol·L-1SA and50mg·L-1CTS.Thegermination rate and activities of α-amylase,dehydrogenase,phosphatase were tested under NaCl stress.Thegermination rate andgermination energy of cucumber seed were inhibited remarkably anddecreased by31.3 and25.6 percentage point,respectively under NaCl stress compared with normal control.Single ormixture treatments of SA,CTS increasedgermination rate and enzymes activity under NaCl stress,while the effect ofmixture treatment with SA,CTS was better than that of single SA,CTS.Itsgermination rate,activities of α-amylase,dehydrogenase,and phosphatase were increased by19.2 percentage point,24.7 %,16.2 %,24.1 % compared with NaCl stress treatment.This indicated that SA and CTS could promotegermination of cucumber seed under NaCl stress and have teamwork effect.
Salicylic acid;Chitosan;Salt stress;Cucumber seeds
S642.2
A
1000-6346(2010)08-0026-04
2009-11-11;接收日期:2010-01-21
“十一五”国家科技支撑计划项目(2006BAD07B04,2006BAD11A10-003),公益性行业(农业)科研专项(nyhyzx07-007),中国农业科学院作物科学研究所中央级公益性科研院所科研业务费专项资助项目
张志刚,助理研究员,主要从事蔬菜苗期发育调控研究,E-mail:zhangzhigang75@yahoo.com.cn
* 通讯作者:尚庆茂,博士,研究员,主要从事蔬菜苗期发育调控研究,E-mail:shangqm@mail.caas.net.cn
