5种海洋微藻细胞膜与细胞内脂肪酸组成分析
2010-09-13孙书勤王江涛孙宝维孙铭一
孙书勤,王江涛**,孙宝维,郑 宇,孙铭一,2
(1.中国海洋大学海洋化学理论与工程技术教育部重点实验室,山东青岛266100;2.美国佐治亚大学海洋科学学院,佐治亚30602-3636)
5种海洋微藻细胞膜与细胞内脂肪酸组成分析
孙书勤1,王江涛1**,孙宝维1,郑 宇1,孙铭一1,2
(1.中国海洋大学海洋化学理论与工程技术教育部重点实验室,山东青岛266100;2.美国佐治亚大学海洋科学学院,佐治亚30602-3636)
对5种海洋微藻的脂肪酸组成进行了研究。微藻在确定的条件下生长,分别于指数生长前期和稳定期后期,测定其脂肪酸组成。根据细胞膜上和细胞内脂肪酸极性差别,采用硅胶柱层析法分离脂肪酸,应用GC与GC-MS进行定量与定性分析。实验结果表明:在微藻生长的不同时期,细胞内脂与细胞膜脂含量及各自的脂肪酸组成明显不同;无论是指数生长前期还是稳定期后期,胞内物质的脂肪酸含量明显要低于细胞膜组分,细胞内与细胞膜中主要组成是C16系与C18系脂肪酸。
海洋微藻;细胞膜与细胞内脂肪酸;脂肪酸组成
海洋浮游植物承担着目前地球上光合作用的一半任务,对大气CO2浓度和全球碳循环有重要的调控作用[1]。浮游植物是海洋系统有机物的主要生产者,为浮游和底栖群落提供食物和能量;一部分浮游植物产生的有机物(包括脂类化合物)被保存在海洋沉积物中,既是全球碳收支中有机碳的主要组分,又作为生命活动和环境变迁的记录,提供地球历史演变的重要信息。浮游植物通过光合作用合成多种脂类化合物,可以占到生物量总碳的5%~20%[2]。由于脂类化合物结构具有指纹特征,并较之蛋白质和糖类化合物结构稳定[2],作为一种生物标记物,已经被广泛地用于研究有机物的生物地球化学循环和沉积物历史记录的反演[3-5]。
脂肪酸是浮游藻类活体细胞生物合成的一类重要的脂类化合物,(它在细胞中一般与一些大分子结合为复合物,如磷脂与三酰甘油等[6],这些化合物在浮游藻类细胞体内具有重要的生物学功能,它们不仅参与细胞膜结构,而且是细胞内储存能量的物质和一些代谢过程的前体。磷脂是细胞膜的主要成分,尽管它们的脂酰基组成可能发生显著变化[7],但在不同的生长期其含量相对稳定。三酰甘油是浮游藻类细胞内的主要能量储存物质,用于细胞的新陈代谢[8-9],这些用于能量储存的物质主要在藻类生长的稳定期合成[10]。由于细胞膜与细胞内脂肪酸的作用不同,导致它们在地球化学沉积保存过程中也存在差别[11]。本文就五种海洋微藻的细胞膜与细胞内脂肪酸在不同生长期的组成进行了初步研究比较,以期为脂类化合物作为生物标记物的研究提供依据。
1 材料与方法
1.1 藻种的来源
所有藻种均来自中国海洋大学海洋污染生态化学实验室藻种库,种类如下:

表1 实验藻种名称Table 1 List of the species of microalgae
1.2 微藻的培养
5种微藻分别培养于500 mL三角瓶中,平行双样。培养液按f/2配方[12]配制,在生化培养箱中培养。光照强度为4 000 lx,光暗周期是12/12,温度为20.5℃。微藻细胞数用血球计数板显微计数,并在指数生长前期及达到稳定期2周后取一定量藻液,过滤留膜,冷冻保存。
1.3 脂肪酸的提取与分析
参照Sun等人[13]的方法提取总脂肪酸,然后根据极性差别,按照Ding[11]的方法采用硅胶层析分离出细胞内脂(主要是三酰甘油,属于中性脂)与细胞膜脂(主要是磷脂,属于极性脂)。用Agilent 6890N气相色谱仪(带有Agilent-B.01.01C工作站)与Agilent 6890N/ 5973B气相色谱-质谱联用仪对样品做定量与定性分析。
GC分析条件:FID检测器温度300℃,无分流进样口温度300℃,进样量1μL,高纯N2做载气,载气流速1 mL/min,HP-5色谱柱。
MS条件:离子化方式EI(70 ev),采集方式扫描(scan),He做载气,流速1 mL/min,无分流进样口温度100℃,离子源温度200℃,EMV为300 V,进样口温度:250℃,接口温度:250℃。
升温程序:
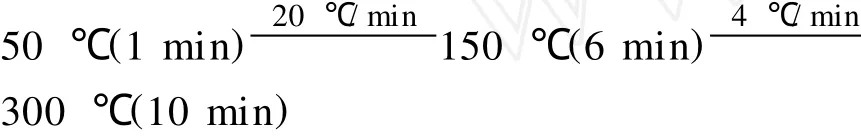
2 结果
每个藻种2个平行组的结果取平均值后分析,其生长曲线及取样时间如图1。从图中可以看出,5种微藻在培养的最初几天细胞数明显增加,青岛大扁藻在培养16 d后进入稳定期,盐藻在培养12 d后进入稳定期,塔玛亚里山大藻在18 d后进入稳定期,三角褐指藻和聚球藻则在培养9 d后达到稳定期。在培养的第3天取藻液作为指数生长前期样品(塔玛亚里山大藻除外,在第12天取藻液),在进入稳定期2周左右取藻液作为稳定期样品。
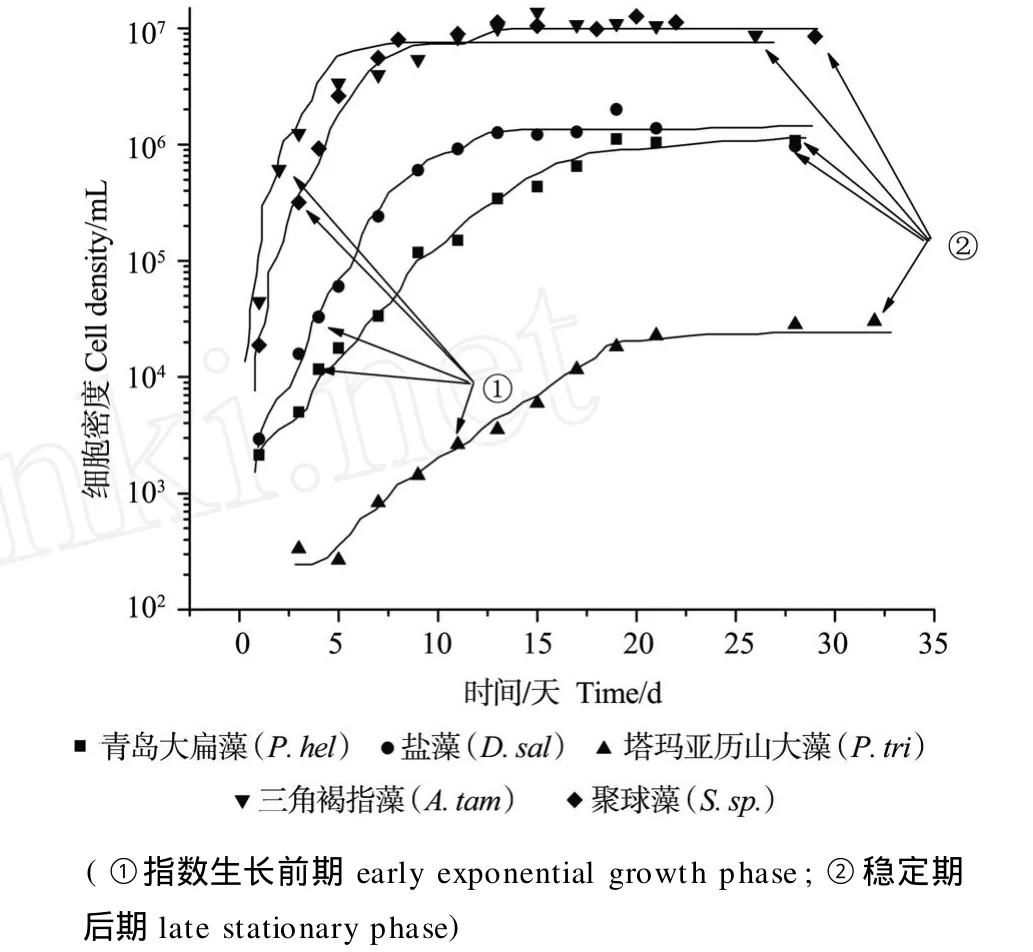
图1 生长曲线及取样时间Fig.1 The growth curve and the harvest days
2.1 不同生长时期脂肪酸分布
如图2所示,在微藻生长的不同时期,细胞内脂、中间产物、细胞膜脂含量(见表2)及各自的脂肪酸组成明显不同,不同的微藻差别较大。
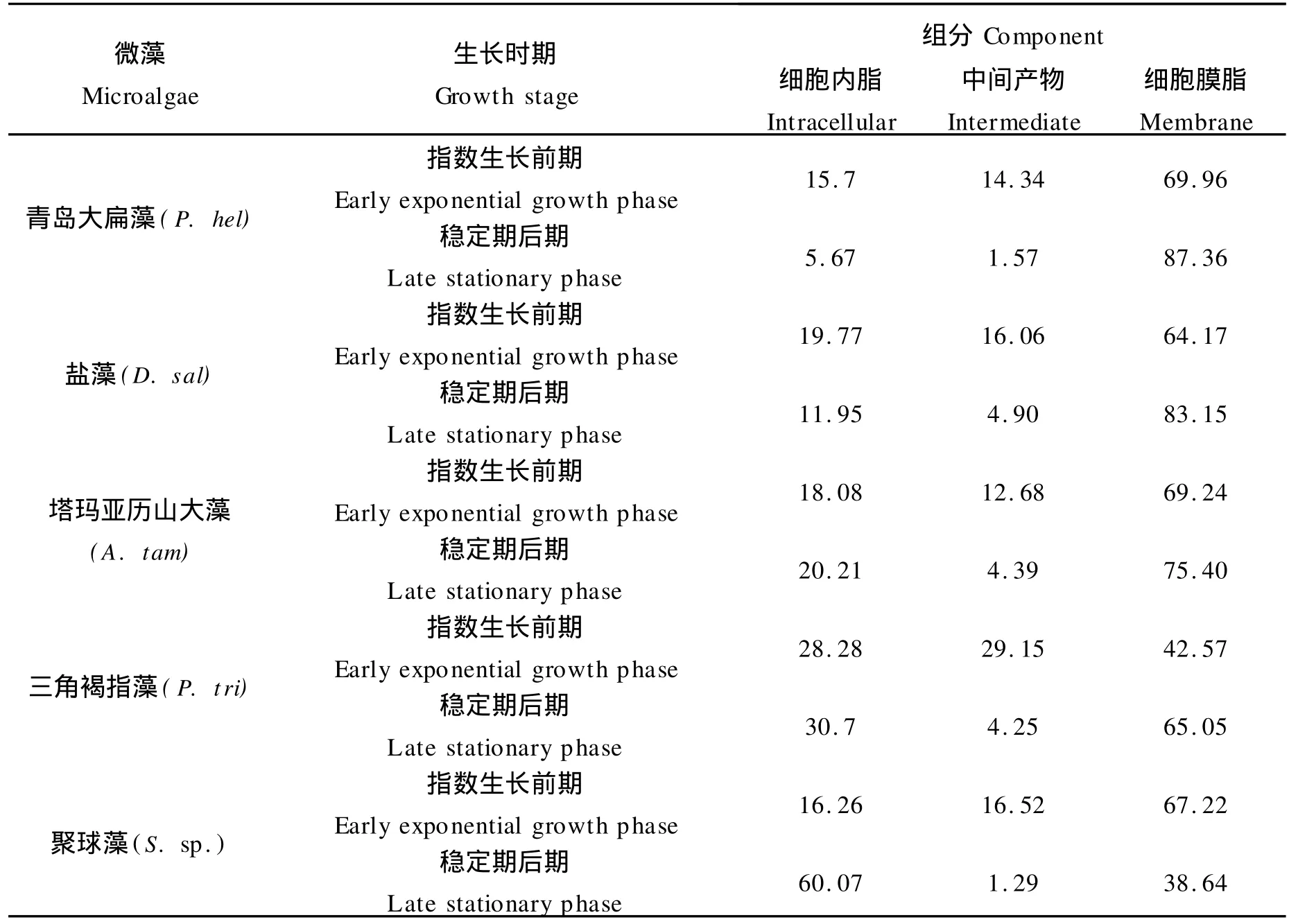
表2 不同生长时期5种微藻各组分脂肪酸(占总脂肪酸含量的百分比)Table 2 Fatty acids composition of five marine microalgae during different growth phases(%of total FA content)

图2 5种海洋微藻不同生长时期细胞膜和细胞内的脂肪酸组成(占总脂肪酸含量的百分比)Fig.2 Fatty acids composition(percentage of total fatty acids)in membrane and intracellular components of five marine microalgae during different growth phases
2.1.1 指数生长前期脂肪酸分布 由图2可知,5种海洋微藻在指数生长前期脂类组成主要是以细胞膜脂为主,其中尤以16∶0和18∶0 2种饱和脂肪酸为主, 16∶0含量最高。而14∶0在多种微藻中也可检出,但含量相对较低。细胞内脂含量较低,种类较少,主要也是以16∶0和18∶0 2种饱和脂肪酸为主,16∶0含量最高。细胞内与细胞膜中不饱和脂肪酸种类较少。
指数生长前期的青岛大扁藻,主要的细胞膜脂肪酸包括16∶0(39.01%),18∶0(25.48%),少量的14∶0与18∶2。细胞内组分包含3种饱和脂肪酸14∶0,16∶0,18∶0但含量都不高。在细胞膜与细胞内都检出了多不饱和脂肪酸22∶6。
指数生长前期的盐藻,细胞膜中16∶0,18∶1,18∶0在总脂肪酸中的比例接近60%;还检出2种多不饱和脂肪酸16∶2与18∶2,但含量较低。细胞内脂肪酸含量为19.77%,种类较少,仅含有3种饱和脂肪酸14∶0,16∶0,18∶0。
塔玛亚历山大藻在指数生长前期细胞膜与细胞内脂肪酸组成相似,都是以短链饱和脂肪酸为主,16∶0, 18∶0含量较多,不饱和脂肪酸主要是C18系脂肪酸。在细胞膜中检出14∶0,但含量极少(0.52%)。
指数生长前期的三角褐指藻,相对于前3种藻,细胞膜脂含量较低,而细胞内脂含量较高(见表1)。细胞膜脂肪酸包括较多的16∶0(25%)与18∶0(10.64%)以及少量的14∶0与20∶5。细胞内除3种饱和脂肪酸14∶0,16∶0,18∶0外,还发现少量多不饱和脂肪酸18∶2。
指数生长前期的聚球藻,细胞膜与细胞内脂肪酸都是以16∶0与18∶0为主,以及少量的14∶0。细胞膜中检出3种不饱和脂肪酸16∶1,18∶2,20∶5,其中20∶5含量最高(5.94%)。细胞内仅包括1种多不饱和脂肪酸18∶2。
2.1.2 稳定期后期脂肪酸分布 进入稳定期后期,5种微藻体内脂肪酸组成较指数生长前期有一定差异,不饱和脂肪酸种类明显增多。经过硅胶层析后,我们发现,稳定期藻体细胞膜脂以16∶0及C18系脂肪酸为主,其中16∶0,18∶1含量较高,18∶0相对较低。微藻细胞内脂肪酸的相对含量明显增高。
青岛大扁藻在稳定期后期细胞膜脂肪酸的含量略高于指数生长前期,占总脂肪酸的87.36%(见表1),细胞膜脂肪酸含量从高到低依次为18∶1,16∶0,16∶1,还包括少量18∶0与16∶2,而该藻体在指数生长前期细胞膜中含量最高组分为16∶0。细胞内脂肪酸含量低于指数生长前期,未检出16∶2,其余脂肪酸与细胞膜组分相同,但含量都很少。在细胞膜与细胞内都检出长链多不饱和脂肪酸20∶5与22∶6。
稳定期后期的盐藻,细胞膜中主要脂肪酸含量从多到少依次为包括18∶1,16∶0,16∶1,18∶0,多不饱和脂肪酸20∶5(4.4%)与18∶2(4.24%)含量相对较高。细胞内脂肪酸以16∶0与18∶1为主。
塔玛亚历山大藻在稳定期后期细胞膜与细胞内脂肪酸种类相同,各自含量较指数生长前期都有所增加。相对于前3种藻,塔玛亚历山大藻细胞内与细胞膜中14∶0含量较多。细胞膜中16∶0含量最高(25.47%);从图2可以看出,随不饱和度降低,细胞膜中C18系列脂肪酸浓度依次降低;长链多不饱和脂肪酸20∶5与22∶6含量相对较高,都在9%左右。细胞内主要脂肪酸含量从高到低依次为16∶0,18∶1,18∶0,其余组分含量很少。
稳定期后期三角褐指藻细胞膜脂主要以16∶0 (43.03%)为主,其含量远高于其他组分。而细胞内含量最高的脂肪酸为16∶1(14.07%),16∶0次之(8.54%)。细胞膜与细胞内18∶0含量都较各自在指数生长前期同种物质的含量有所降低。
聚球藻在稳定期后期的细胞内脂肪酸含量远高于指数生长前期,达到总脂肪酸比例的60.07%,其中16∶0比例最高,其它脂肪酸含量均低于5%。主要细胞膜脂肪酸包括16∶0与20∶5,而该藻指数生长前期细胞膜中除16∶0与20∶5外,还含有一定量的18∶0。
3 讨论
本研究通过对5种海洋微藻细胞的脂类化合物进行硅胶层析,分离出细胞膜脂类和胞内物质,分别比较了不同生长阶段二者间的脂肪酸组成异同。
比较指数生长前期的五种微藻可以发现:盐藻、三角褐指藻与聚球藻不饱和脂肪酸种类以及含量相对其他2种藻较高;5种藻体内大部分不饱和脂肪酸都存在于细胞膜上,这说明在指数生长前期不饱和脂肪酸是细胞膜的重要组成物质之一。细胞膜组分的脂肪酸种类要多于胞内物质;2种组分在指数生长前期均以饱和脂肪酸为主,不饱和脂肪酸种类及含量都相对较少。
进入稳定期后期,5种微藻体内脂肪酸种类明显增多,组成较指数生长前期有一定差异,不饱和脂肪酸种类明显增多。藻体细胞膜中以16∶0及C18系脂肪酸为主,其中,大多数微藻以16∶0与18∶1含量较高。细胞内脂中不饱和脂肪酸浓度要高于饱和脂肪酸,但胞内物质的脂肪酸整体浓度分布仍要低于细胞膜脂类。
通过比较不同组分、不同生长时期的脂肪酸组成与含量我们发现:细胞膜脂(极性脂)一般为这5种微藻的主要脂类,是长链多元不饱和脂肪酸(如20∶5, 22∶6)的主要提供者,细胞内脂(中性脂)含短链脂肪酸较多(如C16系与C18系脂肪酸),为主要的储存脂类,这与俞建江等[14]的研究结果一致。另外,对于塔玛亚历山大藻、三角褐指藻与聚球藻,这3种藻细胞内脂(中性脂)的含量在稳定期高于指数生长前期,塔玛亚历山大藻、三角褐指藻中细胞膜脂的含量比较稳定,但聚球藻中细胞膜脂在稳定期略有下降,这与魏东等[15]对后棘藻(Ellipsoidionsp.)与眼点拟微绿球藻(N annochloropsis oculata)的研究结果有一定的相似性。此外Emdadi等[16]、Dunstan等[10]也报道指出,中性脂(主要是三酰甘油)在稳定期积累[17]。因为细胞进入稳定期后,培养基中氨基酸合成所必需的氮减少,细胞内蛋白质的合成量降低,光合作用所同化的碳进入到碳水化合物和脂肪(多为三酰甘油)中,出现能量积累的趋势[7,18]。
此外,由图2可以看出,对于细胞内组分,青岛大扁藻与盐藻中14∶0,16∶0,18∶0,塔玛亚历山大藻与三角褐指藻中16∶0,18∶0,18∶2在指数生长前期的含量要远远高于其稳定期含量。据文献报道,微藻为了生存需要,在新陈代谢过程中会利用部分脂类化合物形成储能物质,在环境中营养元素缺乏或光缺乏的条件下,为了维持自身生长需要,这部分物质的含量会随藻类的生长及环境变化而变化[19]。本实验采用一次培养过程,只添加一次营养盐,藻类会在营养缺乏的后期,消耗体内的储能物质,造成部分脂肪酸的减少,故说明上述几种在稳定期后期含量减少的脂肪酸是各种藻体内储存能量物质的组分。
总的来说,在微藻生长的不同时期,细胞内脂、中间产物、细胞膜脂含量及各自的脂肪酸组成明显不同,不同的微藻差别较大。无论是指数生长前期还是稳定期后期,胞内物质的脂肪酸含量明显要低于细胞膜组分,细胞内与细胞膜中主要组成是C16系与C18系脂肪酸。
[1] 李丽,汪品先.大洋“生物泵”—海洋浮游植物生物标志物[J].海洋地质与第四纪地质,2004,24:73-79.
[2] Parsons T R,Stephens K,Strichland J D H.On the chemical composition of eleven species of marine phytoplanktons[J].Journal of Fisheries Research.Board of Canada,1961,18:1001-1016.
[3] Gagosian R B,Volkman J K,Nigrelli G E.The use of sediment traps to determine sterol sources in coastal sediments of Peru[C].∥Bjoroy M.Advance in Organic Geochemistry-1981.New York: Wiley,1983:369-379.
[4] Volkman J K,Farrington J W,Gagosian R B.Marine and terrigenous lipids in coastal sediments from the Peru upwelling region at 15 S:sterols and triterpene alcohols[J].Organic Geochemistry, 1987,11:463-477.
[5] Derieux S,Fillaux J,Saliot A.Lipid class and fatty acid distributions in particulate and dissolved fractions in the north Adriatic Sea [J].Organic Geochemistry,1998,29:1609-1621.
[6] Dembisty V M,Rozentsvet O A.Distribution of polar lipids in some marine,brackish and freshwater green macrophytes[J]. Phytochemistry,1996,41:483-488.
[7] Zhu C J,Lee Y K,Chao T M.Effects of temperature and growth phase on lipid and biochemical compositon ofIsochrysis galbana T K1[J].Journal of Applied Phycology,1997,9:451-457.
[8] Vechtel B,Eichenberger W,Ruppel H G.Lipid bodies inEremosphaera viridisDe Bary(Chlorophtceae)[J].Plant and Cell Physiology,1992,33:41-48.
[9] Wood B J B.Lipids of algae and protozoa.∥Ratledge G,Wilkinson S G,eds.Microbial Lipids.New York:Academic Press, 1988,807-865.
[10] Dunstan G A,Volkman J K,Barrett S M,et al.Changes in the lipid composition and maximization of the polyunsaturated fatty acid content of three microalgae grown in mass culture[J].Journal of Applied Phycology,1993,5:71-83.
[11] Ding H B,Sun M Y.Biochemical degradation of algal fatty acids in oxic and anoxic sediment-seawater interface systems:effects of structural association and relative roles of aerobic and anaerobic bacteria[J].Marine Chemistry,2005,93:1-19.
[12] Guillard R R L,Ryther J H.Studies of marine plank tonic diatomsI.CyclotellananaHustedtandDetonulaconvervacea (Cleve)Gran[J].Microbiol,1962,8:229-239.
[13] Sun M Y,Wakeham S G,Lee C.Rate and mechanism of fatty acid degradation in oxic and anoxic coastal marine sediment of Long Island Sound,New York,USA[J].Geochimica et Cosmochimica Acta,1997,61:341-355.
[14] 俞建江,李荷芳,周汉秋.10种海洋微藻总脂、中性脂和极性脂的脂肪酸组成[J].水生生物学报,1999,23(5):481-488.
[15] 魏东,张学成,邹立红,等.细胞生长时期对两种海洋微藻总脂含量和脂肪酸组成的影响[J].青岛海洋大学学报,2000,30: 503-509.
[16] Emdadi D,and Berland B.Variation in lipid class composition during batch growth ofN annochloropsis salinaandPavlova lutheri[J].Marine Chemistry,1989,26:215-225.
[17] 石娟,潘克厚.不同培养条件对微藻总脂含量和脂肪酸组成的影响[J].海洋水产研究,2004,25:79-85.
[18] Aaronson S.Effect of incubation temperature on the macromolecular and lipid content of the phytoflagellateOchromonas danica [J].Journal of Phycology,1973,9:111-113.
[19] Bell M V,Pond D.Lipid composition during growth of motile and coccollith forms ofEmilliania huxleyi[J].Phytochemistry, 1996,41:465-471.
Abstract: To examine composition of algal fatty acids,five marine microalgae were cultured and harvested at logarithmic and stationary phases.Their membrane and intracellular fatty acids were separated by silica gel column due to the polarity.Quantification and identification of fatty acids were performed on GC and GC-MS.Experimental results showed that the composition and concentration of membrane and intracellular fatty acids were apparently different during the two growth phases.Content of intracellular fatty acids were lower than that of membrane composition at both growth stage,C16and C18fatty acids were dominated composition in membrane and intracellular components.
Key words: marine microalgae;membrane and intracellular fatty acids;fatty acid composition
责任编辑 徐 环
The Fatty Acid Composition in Membrane and Intracellular Components of Five Species of Marine Microalgae
SUN Shu-Qin1,WAN GJiang-Tao1,SUN Bao-Wei1,ZHENG Yu1,SUN Ming-Yi1,2
(1.Key Laboratory of Marine Chemistry Theory and Technology,Ministry of Education,Ocean University of China,Qingdao 266100,China;2.Department of Marine Sciences,University of Georgia,Athens,GA 30602-3636,USA)
P736.4
A
1672-5174(2010)09Ⅱ-191-06
国家重点基础研究发展计划项目(2001CB409703);国家高技术研究发展计划项目(2006AA09Z176);中国海洋大学绿卡教授项目资助
2009-03-06;
2009-11-04
孙书勤(1983-),女,硕士生。E-mail:sqsun1983@hotmail.com
E-mail:jtwang@ouc.edu.cn
