南药五味子提取物的抗菌及抗氧化作用*
2010-09-12马永全于新黄雪莲杨敏
马永全,于新,黄雪莲,杨敏
(仲恺农业工程学院轻工食品学院,广东广州,510225)
南药五味子提取物的抗菌及抗氧化作用*
马永全,于新,黄雪莲,杨敏
(仲恺农业工程学院轻工食品学院,广东广州,510225)
应用琼脂平板扩散法、DPPH·法、结晶紫法、邻苯三酚自氧化法,测定五味子提取物对大肠杆菌、金黄色葡萄球菌、乙型副伤寒沙门氏菌的抑菌活性及清除 1,1-二苯基-2-苦苯肼自由基(DPPH·)、羟自由基(·OH)、超氧阴离子(·)的能力。结果表明,五味子提取物对大肠杆菌、金黄色葡球菌、乙型副伤寒沙门氏菌 3种食品常见致病菌均具有强的抑菌作用,抑菌圈直径均在 20 mm以上。其中,五味子乙醇提取物对大肠杆菌、金黄色葡球菌、沙门氏菌的抑菌圈和MIC及对 DPPH·、·OH、·清除活性 EC50分别为 34.8 mm,28.6 mm,23.2 mm,0.1250 g/mL,0.0313g/mL,0.1250 g/mL,0.69 mg/mL,0.78 mg/mL,0.57 mg/mL;蒸馏水提取物的抑菌圈和MIC清除率分别为 25.4 mm,23.0 mm,23.4 mm,0.1250 g/mL,0.0625g/mL,0.1250 g/mL,0.72 mg/mL,0.63 mg/mL,0.61 mg/mL。说明五味子提取物具有明显的抗菌和抗氧化作用。
南药五味子,提取物,抗菌作用,抗氧化作用
南药五味子(Kadsura longipedunculata),又称华中五味子,属五味子科(Schisandraceae)五味子属(Schisandra)植物,是我国卫生部 2002年公布的可用于保健食品的中草药之一。具有益气 、敛肺、生津、止渴、止泻、敛汗、壮阳、补肾等功能,是产自我国的名贵中药材[1-2]。五味子及其部分亲缘种普遍含有木脂素,且不同品种的含量和成分有较大差异,一般含有挥发油、有机酸及脂肪油,此外还含有五味子甲素、乙素、乙醇及甲、乙、丙、丁、戊酯等成分[3]。动物和临床实践证实,五味子对病毒性肝炎或化学中毒性肝损伤有降低转氨酶和改善症状的作用,对中枢神经系统有兴奋作用,能改善条件反射的形成,提高大脑皮层细胞的机能[4]。据报道,五味子提取物对大鼠脑、肝、肾微粒体的脂质过氧化有显著的抑制能力,可维持断奶仔猪血液正常生化指标[5-6]。但有关五味子提取物抑菌活性的报道甚少。本试验采用 2种不同溶剂的提取物,研究了五味子提取物的抗菌和抗氧化作用,旨在为开发利用提供科学依据。
1 材料与方法
1.1 材料、仪器与试剂
1.1.1 材料与仪器
五味子果实,购于广东阳西县。
电子天平(Sartorial公司);MJ-176NR型多功能粉碎机(松下电器产业株式会社);DHG-9140A型电热恒温干燥箱(广东环凯微生物科技有限公司);PHS-25型酸度计(上海伟业仪器厂);UV-1700型紫外可见分光光度计(岛津分析仪器厂);HH数显恒温水浴锅(金坛市金城国胜试验仪器厂);TGL-16C型台式离心机(上海安宁科学仪器厂);R201D-II型旋转蒸发仪(无锡星海王生化设备有限公司)。
1.1.2 菌种
大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus),仲恺农业工程学院微生物实验室;乙型副伤寒沙门氏菌(Salm onella paratyphiB,CMCC50094),广东省微生物菌种保藏中心。
1.1.3 试剂
1,1-二苯基-2-苦苯肼自由基(DPPH·)、邻苯三酚,为美国 Sigma公司产品。结晶紫、FeSO4、30%H2O2、三羟甲基氨基甲烷(Tris)、HCl、KH2PO4、K2HPO4、无水乙醇等均为国产分析纯试剂。
1.2 试验方法
1.2.1 五味子 70%乙醇和水提取物的制备
五味子经 60℃干燥后粉碎,过 60目筛,取五味子粉 10 g,用 70%乙醇和蒸馏水进行 80℃水浴,料液比为 1∶10,浸提6h。将浸出液根据不同需要浓缩至不同体积,定容,4℃贮存备用(抗菌试验前需经121℃,30 min灭菌 )。
1.2.2 菌液的制备
将各试验菌种活化后,用生理盐水配成菌悬液,经比浊法判定菌量,稀释到 109CFU/mL。
1.2.3 抑菌圈的测定
待培养基冷却到 55℃左右,接入含菌量为 109CFU/mL的指示菌的菌悬液,接种量为 10%。灭菌后将 3个牛津杯放在培养皿上。每种菌倒 5个平板,3个作为平行组,2个作为对照组。培养基完全凝固后,取出牛津杯。用移液枪往平行组培养皿的各小孔内加入 0.06 mL的五味子提取物,对照组培养皿小孔内加入 0.06 mL无菌水作为对照。把各平板放置于37℃恒温培养箱中培养 24 h后,测量抑菌圈直径。
1.2.4 最低抑菌浓度(MIC)的测定
分别取灭菌试管 8支,将提取物浓缩液1mL以灭菌生理盐水倍比稀释(1∶10、1∶20、1∶40、1∶80、1∶160、1∶320、1∶640、1∶1280),另用无菌水加入 9 mL琼脂培养基做无提取液的对照,倒 10 mL琼脂培养基作为无菌水的对照。每种菌倒 7个平板,3个作为提取液的平行组,2个作为无提取液的对照组,2个作为无菌水的对照组。待完全凝固后加 0.1 mL菌悬液涂布于平板上(无菌水对照组则加 0.1 mL无菌涂布),在 37℃下培养 24 h,观察菌落生长情况,以不长菌的五味子提取物最低浓度为 3种食品常见致病菌的最低抑菌浓度(MIC)。
1.2.5 提取物对 DPPH·清除率的测定
参照Vattem等[7]的方法。用蒸馏水和 70%乙醇分别配制浓度为 0.2 mg/mL,0.4 mg/mL,0.6 mg/mL,0.8 mg/mL,1.0 mg/mL和 1.2 mg/mL提取物溶液,精确吸取不同浓度的提取物溶液 2.0 mL放入试管中,加入 2.0×10-4mol/L DPPH·溶液(无水乙醇配制)2.0 mL,摇匀后于室温下放置 30 min,测定其在 517 nm处的吸光度值(AS);以水或 70%乙醇代替样品为空白对照(A0);以 2.0 mL不同浓度的提取物溶液与 2.0 mL水或 70%乙醇混合液为样品对照(AX),以消除样品本身颜色的影响;以水或 70%乙醇校正仪器 0点,重复测定 3次。清除率 R计算:
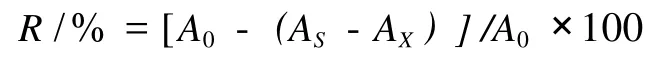
1.2.6 提取物对羟自由基(·OH)的清除率的测定
采用结晶紫分光光度法[8],用蒸馏水和 70%乙醇分别配制浓度为 0.2 mg/mL,0.4 mg/mL,0.6 mg/mL,0.8 mg/mL,1.0 mg/mL和 1.2 mg/mL的提取物溶液。具体试验步骤为在一系列 50 mL具塞比色管中分别加入 0.4 mmol/L结晶紫溶液 1.5 mL,1.0mmol/L FeSO4溶液 2.0 mL,2.0 mmol/L H2O2溶液 1.0 mL。调至 pH 4.0,稀释到 50 mL并摇匀,放置30 min后,测 580 nm处的吸光度 A,同时测定不加H2O2时 580 nm处的吸光度 A0。则羟自由基的产生量可以用ΔA=A-A0表示。样品液对羟自由基清除率的测定:在上述反应体系中加 H2O2之前,加入2mL蒸馏水或 70%乙醇抽提的不同浓度的五味子提取物溶液,测定其吸光度 AS,样品组对·OH的清除率(R)计算:
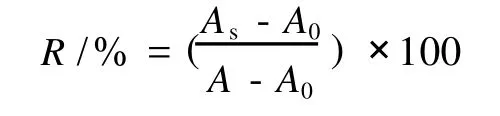
1.2.7 提取物对超氧阴离子(·)清除率的测定
采用邻苯三酚自氧化法[9-10]。用蒸馏水和 70%乙醇分别配制浓度为 0.2 mg/mL,0.4 mg/mL,0.6 mg/mL,0.8 mg/mL,1.0 mg/mL和 1.2 mg/mL的提取物溶液。具体操作为:每支试管加入 3.0 mL Tris-HCl缓冲液(pH8.2),0.2 mL五味子提取液,(37±0.5)℃水浴平衡 10 min后,加入 7 mmol/L的邻苯三酚溶液 0.3 mL,准确反应 4.0 min,加入 12 mol/LHCl0.8 mL终止反应,在 320nm处测吸光度,计算清除率(R):
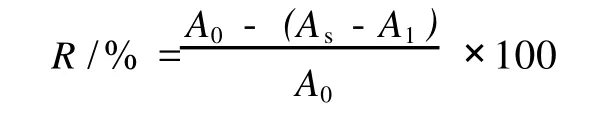
式中:A0,空白液的吸光度,以蒸馏水或 70%乙醇代替样品液的吸光度;As,样品组的吸光度;A1,五味子提取物本身的吸光度,以蒸馏水或 70%乙醇代替反应试剂的吸光度。
2 结果分析
2.1 抑菌圈测定结果
五味子乙醇、水提取物对大肠杆菌、金黄色葡球菌、乙型副伤寒沙门氏菌 3种食品常见致病菌均具有强抑菌作用,抑菌圈直径均在 20 mm以上,醇提物的抑菌效果强于水提物的抑菌作用。其中醇、水提物对大肠杆菌的抑菌圈分别为 34.8 mm、25.4 mm,对乙型副伤寒沙门氏菌的抑菌圈达 23.2 mm、23.4 mm,对金黄色葡球菌的抑菌圈达 28.6 mm、23.0 mm。
2.2 最低抑菌浓度(MIC)测定结果
五味子乙醇、水提取物对大肠杆菌、金黄色葡球菌、乙型副伤寒沙门氏菌 3种食品常见致病菌的MIC均很低,当浓度稀释到 0.1250 g/mL时,仍能对大肠杆菌、金黄色葡萄球菌、乙型副伤寒沙门氏菌达到100%的抑菌效果。浓度为 0.0625g/mL时,醇提取对金黄色葡萄球菌仍可抑制,水提取对大肠杆菌也可抑制,对其它菌则无抑制作用。最终结果表明,水提物对大肠杆菌的 MIC为 0.0625g/mL,金黄色葡萄球菌、乙型副伤寒沙门氏菌的MIC为0.1250 g/mL;醇提物对金黄色葡球菌的MIC可低至 0.0313g/mL,对大肠杆菌、乙型副伤寒沙门氏菌的 MIC为0.1250 g/mL。
2.3 五味子提取物对DPPH·的清除效果
五味子水和乙醇的提取物对 DPPH·具有较好的清除作用,结果如图 1所示。
图1表明,五味子提取物对 DPPH·具有较高的清除率,且清除率随提取物浓度的增加而增强。当其浓度为 1.2 mg/mL时,水提取物和醇提取物的清除率分别为 88.16%和 93.83%。在试验浓度范围内,乙醇提取物对 DPPH·的清除率均高于水提取物。说明对DPPH·的清除物质在水和醇溶液下均存在。以体系中DPPH·的吸光值减少 50%时抗氧化剂的浓度为准,即半数抑制浓度(EC50)。南五味子水、醇提取物清除 DPPH·的 EC50分别是 0.72 mg/mL和0.69 mg/mL。
2.4 五味子提取物对·OH的清除效果
五味子水和乙醇的提取物对·OH的均有抑制作用,水提物的清除作用强于醇提物。结果见图2。
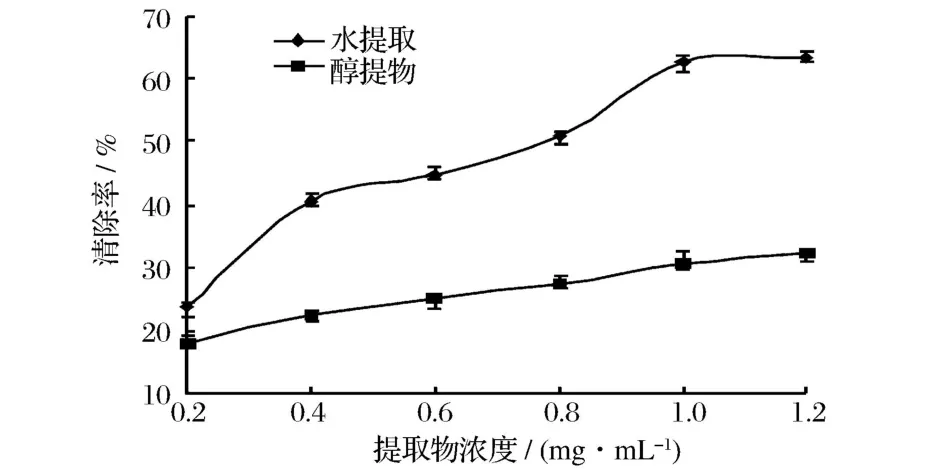
图2 五味子提取物对·OH的清除作用
由图2可知,在 0.2~0.6 mg/mL,水提物的清除率从 23.66%增加到 44.68%,增幅达 19%。在整个试验浓度范围内,水提取物对·OH的清除率均高于醇提取物。水提取物和醇提取物的清除率均随提取物浓度的增加而增强。但醇提物清除率随浓度增幅变化不大,可能因为清除·OH自由基的抗氧化物质水溶性的较多,而醇溶性的较少。当浓度为 1.2 mg/mL时,水和乙醇提取物的清除率分别为63.17%、32.26%。以体系中·OH的吸光值减少50%时抗氧化剂的浓度为准,即半数抑制浓度(EC50)。南五味子水、醇提取物清除·OH的 EC50分别是 0.63 mg/mL、0.78 mg/mL。
2.5 五味子提取物对·的清除效果
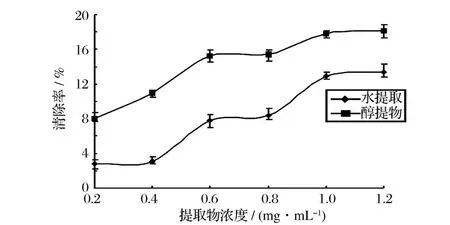
图3 五味子提取物对·的清除作用
3 结论
五味子提取物对大肠杆菌、金黄色葡球菌、乙型副伤寒沙门氏菌 3种食品常见致病菌均具有强的抑菌作用,抑菌圈直径均在 20 mm以上。五味子乙醇提取物对大肠杆菌、金黄色葡球菌、沙门氏菌的抑菌圈和MIC分别为 34.8 mm,28.6 mm,23.2 mm,0.1250 g/mL,0.0313 g/mL,0.1250 g/mL,对 DPPH·、·OH、·清除活性分别为 93.83%,32.26%,18.22%;蒸馏水提取物对大肠杆菌、金黄色葡球菌、沙门氏菌的抑菌圈和 MIC分别为 25.4 mm,23.0 mm,3.4 mm,0.1250 g/mL,0.0625g/mL,0.1250 g/mL,对 DPPH ·、·OH、·清除率分别为86.16%,63.17%,3.37%。
4 讨论
(1)南药五味子提取物对 G+(金黄色葡萄球菌)、G-(大肠杆菌、乙型副伤寒沙门氏菌)细菌均有较强的抑制作用,并且在提取物较低浓度时具有较强的抑菌作用。可见,南药五味子在食品防腐和水果保鲜等领域具有广阔的应用前景。
(3)五味子提取物对 DPPH·有较高的清除能力,醇提物明显强于水提取。而对·OH的清除作用,水提物却强于醇提取。说明清除自由基的抗氧化物质既溶于水也溶于醇,但对具体的自由基,其抗氧化物质却有略有不同。初步推断,对不同自由基具有清除作用的活性物质可能为不同成分,或是多种成分综合作用的结果,具体抗氧化成分可能是五味子酮、五味子乙素、五味子二醇等。一般认为,抗氧化剂的作用机理主要包括 3个方面:1是对自由基的直接清除作用。2是阻断自由基的反应链;3是提高体内抗氧化酶活力和抗氧化物质含量,如谷胱甘肽等[10]。有研究表明,五味子酚对自由基有直接的清除作用[10]。但五味子中其它抗氧化物质抗氧化作用的机理仍在研究中。
[1]李钧敏,虞优优,金则新 .大血藤叶片提取物抑菌作用的初步研究[J].浙江中医学院学报,2004,28(1):55-57.
[2]谭晓虹,王治宝,李如章.北五味子中多糖含量的测定[J].河北北方学院学报:医学版,2005,22(6):45-46.
[3]汪发缵,唐进.中国植物志(第 14卷:百合科)[M].北京:科学出版社,1980:159-165.
[4]黄诒森,何燕,张均田.五味子三种成分的抗氧化作用[J].中国药理学与毒理学杂志,1990,4(4):275-277.
[5]卢华,刘耕陶.五味子的抗活性氧自由基作用[C].中国协和医科大学建院建校 30和 70周年纪念学术论文集,北京:中国科学技术出版社,1987:88-89.
[6]李牧,高鹏,徐良梅,等.五味子提取物对断奶仔猪血液生化指标和抗氧化能力的影响 [J].中国饲料,2007(20):17-19.
[7]Vattem D A,Lin Y T,Labbe R G,et al.Phenolic antioxidantmobilization in cranberry pomace by solid-state bioprocessing using food grade fungus lentinus edodes and effect on ant imicrobial activity against select food borne pathogens[J].Innovative Food Science and Emerging Technologies,2004(5):81-91.
[8]刘骏.结晶紫分光光度法测定 Fenton反应产生的羟自由基[J].武汉工业学院学报,2005,24(2):53-55.
[9]周凤娟,苏朋,孔翠萍,等.核桃油体外清除自由基活性的研究[J].中国油脂,2007,32(7):32-33.
[10]林童俊.五味子酚和丹酚酸 A抗氧化作用机理及对阿霉素心脏毒性的保护作用[J].生理科学进展,1991,22(4):342-345.
ABSTRACTTo study the effectsofAntibacterial and anti-oxidation of Extracts fromKadsura longipedunculata.The inhibition effect of the extracts fromK.longipedunculataagainstE.coli,S.aureus,S.paratyphiand its scavenging abilities to 1,1-2-phenyl-2-bitter phenylhydrazine radical(DPPH·),hydroxyl radical(·OH),superoxide anion(·)were respectively deter mined via agar plate diffusion method,DPPH·method and pyrogallol auto-oxidation method.The extracts fromK.longipedunculata,with its inhibition zone diameters larger than 20mm,have strong inhibition effect to three kinds of food pathogenic bacteria:E.coli,S.aureusandS.paratyphi.Inhibition zone diameters of inhibition andMI C of ethanol extract againstE.coli,S.aureus,S.paratyphiwere 34.8mm,28.6mm,23.2mm,0.1250g/mL,0.0313 g/mL,0.1250 g/mL respectively,and scavenging abilities to 1,1-2-phenyl-2-bitter phenylhydrazine radical(DPPH·),hydroxyl radical(·OH),superoxide anion(·)were 0.69mg/mL,0.78mg/mL,0.57mg/mL.Distilledwater extract ofK.longipedunculataandMI C againstE.coli,S.aureus,S.paratyphiwere 25.4mm,23.0mm,23.4mm,0.1250 g/mL,0.0625g/mL,0.1250 g/mL respectively and scavenging abilitiesof 1,1-2-phenyl-2-bitterphenylhydrazine radical(DPPH ·),hydroxyl radical(·OH),superoxide anion(·)were 0.72mg/mL,0.63mg/mL,0.61mg/mL.K.longipedunculataextract has strong anti-oxidation and inhibition effect to bacteria.
Key wordsKadsura longipedunculata,extract,antibacterial,antioxidation
Study on Ant im icrobial and Anti-oxidation Activities of Extracts fromKadsura longipedunculata
Ma Yong-quan,Yu Xin,Huang Xue-lian,YangMin
(College of Light Industry and Food Science,ZhongkaiUniversity ofAgriculture and Engineering,Guangzhou 510225,China)
硕士研究生(于新教授为通讯作者)。
*广东省科技计划项目(2005B20401002)
2010-01-27,改回日期:2010-04-02
