三株异淀粉酶酶源菌株的筛选分离及部分酶学性质研究*
2010-09-12王晓燕李俊俊杨云娟唐湘华孟艳芬许波黄遵锡
王晓燕,李俊俊,杨云娟,唐湘华,孟艳芬,许波,黄遵锡
1(中国农业大学水利与土木工程学院,北京,100193)
2(生物能源持续开发利用教育部工程研究中心,云南昆明,650092)
3(云南师范大学酶工程重点实验室,云南昆明,650092)
4(云南师范大学生命科学学院,云南昆明,650092)
三株异淀粉酶酶源菌株的筛选分离及部分酶学性质研究*
王晓燕1-4,李俊俊2-4,杨云娟2-4,唐湘华2-4,孟艳芬2-4,许波2-4,黄遵锡1-4
1(中国农业大学水利与土木工程学院,北京,100193)
2(生物能源持续开发利用教育部工程研究中心,云南昆明,650092)
3(云南师范大学酶工程重点实验室,云南昆明,650092)
4(云南师范大学生命科学学院,云南昆明,650092)
从云南温泉中分离鉴定了3株产异淀粉酶的芽孢杆菌,经16Sr DNA序列比对分析及主要生理生化研究,初步鉴定为:Bacillus am yloliquefacieLCEP-1、Bacillus subtilisDL-3-4-2、Bacillus subtilisDMJS-2-1。GeneBank登录号分别为:gb.GQ199589、gb.GQ199593、gb.GQ199594。3株菌所产的异淀粉酶都能降解玉米支链淀粉。酶解反应的最适pH分别为pH 6.8、5.4和pH 7.8;最适温度分别为60、55、60℃。优化条件下,最高酶活分别为:36.5、18.89、11.08μ/mL。3株菌的酶对不同金属离子有不同的反应,金属螯合剂EDTA对酶活又有较强的抑制作用,推测可能都属于金属酶。3株菌能在偏酸性至中性的pH范围内(pH 4.4~8.0)保持稳定,可以在pH变化较大的条件下保持较高的酶活,在偏酸性、中性和弱碱性环境中都能有效地水解淀粉质底物。3株菌所产异淀粉酶,底物专一性强,最适pH可低至5.4。
异淀粉酶,菌株筛选,酶学性质
异淀粉酶(E.C.3.2.1.168,isoamylase)是内切型淀粉酶,可专一性地切开支链淀粉分支点的α-1,6-糖苷键,形成直链淀粉,它只能水解构成分支点的α-1,6-糖苷键,不能水解直链分子中的α-1,6-糖苷键的特性,早期主要应用于淀粉、糖原及其水解产物和其他有关化合物分子结构的理论研究[1]。近年来,异淀粉酶广泛应用于酶制剂领域并成为食品工业的加工助剂[2]。自然界中,异淀粉酶来源广泛。目前已在水稻、玉米、马铃薯、蚕豆及拟南芥等许多植物中发现有异淀粉酶(R-酶)[3]。高等动物的肝脏、肌肉中也有类似于异淀粉酶的水解α-1,6-糖苷键的酶存在。1940,日本学者首次从酵母细胞提取液中发现异淀粉酶[4],后续研究发现,有不少细菌和某些放线菌均能产生异淀粉酶[5-6],但能满足工业化生产的菌种还是比较难得。
王弋博[7]等人诱变中温地衣芽孢杆菌,其出发菌株的异淀粉酶活达到3.35μ/mL,诱变后酶活提高到7.37μ/mL;夏静[8]等人从云南梁河温泉水样中分离筛选到1株产异淀粉酶的栖热菌(Thermus),其产酶的初始酶活达4.14μ/mL。王武[9]等对短杆菌异淀粉酶产生菌进行诱变、选育,从初始酶活为7μ/mL的出发菌I2,获得了摇瓶发酵液中酶活单位最高可达520μ/mL的突变菌株,其酶作用最适pH低至pH 5.0,最适温度高至55℃,是至今国内较为优良的产异淀粉酶菌株,但一直未其后续研究及工业化生产的报道。目前,只有丹麦的Novo公司具备淀粉酶的工业化生产能力,我国工业所用异淀粉酶全部从Novo公司进口,价格昂贵,极大地限制了异淀粉酶在我国的应用。因此,如何降低酶成本,寻找一条国产化生产异淀粉酶的途径,成为酶制剂行业努力的方向。
为了获得性能更优良的酶源菌,我们从云南全省各地温泉、土壤中分离鉴定了数十株产异淀粉酶的菌株,其中3株芽孢杆菌:B acillus am yloliquefacieLCEP-1、B acillus subtilisDL-3-4-2、B acillus subtilisDMJS-2-1产异淀粉酶的初始酶活较高,本文对这3株菌产的异淀粉酶进行了初步研究。
1 材料和方法
1.1 试验材料
采自云南腾冲、洱源温泉的水样和土样,共计100余份。
1.2 试验方法
1.2.1 试验仪器和主要药品
仪器:722S型分光光度计,上海分析仪器总厂;VPL-1型回转式恒温调速摇瓶柜,上海通特电讯设备厂;冷冻高速离心机,德国Eppendorf公司;S W-CJZFD净化工作台,苏净集团苏州安泰空气技术有限公司;精密pH仪,梅特勒-托利多仪器上海有限公司。
主要药品:支链淀粉(corn amylopectin),马铃薯淀粉(potato amylose)、普鲁兰糖、葡萄糖、麦芽糖均购自Sigma公司。
1.2.2 培养基
富集培养基(g/L):支链淀粉1.0,蛋白胨0.1,酵母膏0.1,NH4NO30.1,K2HPO40.7,KH2PO40.3,MgSO4·7H2O 0.05,CaCl2·2H2O 0.05,pH 4.5。
初筛平板培养基A(g/L):支链淀粉0.5,蛋白胨0.5,酵母膏0.5,KH2PO40.05,MgSO4·7H2O 0.01,CaCl2·2H2O 0.05,琼脂2.5,pH5.0。
初筛平板培养基B(g/L):红色普鲁兰糖0.3,蛋白胨0.5,酵母膏0.5,KH2PO40.05,MgSO4·7H2O 0.01,CaCl2·2H2O 0.05,琼脂2.5,pH5.0。
斜面培养基(g/L):支链淀粉2.0,蛋白胨0.4,KH2PO40.1,MgSO4·7H2O 0.05,pH6.0。
种子培养基(g/L):蛋白胨1.0,酵母膏0.5,NaCl 0.5,pH6.5。
发酵培养基(g/L):支链淀粉2.0,蛋白胨0.5,酵母膏 0.5,KH2PO40.05,MgSO4·7H2O 0.01,(NH4)2SO40.1,CaCl2·2H2O 0.05,pH6.5。
测透明圈平板培养基(g/L):支链淀粉0.01,Na2HPO4-柠檬酸缓冲液(pH值分别为pH 3.8、4.4、5.0、5.6、6.2、6.8、7.4),琼脂2.5。
1.2.3 方法
1.2.3.1 菌种筛选方法
称取土样10 g至90 mL灭菌水中,加入灭菌玻璃珠,振荡摇瓶10 min,静置1 h后取土样上清液100 μL于试管中(水样直接取100μL),加入2 mL富集培养基,37℃富集培养16 h。将富集菌液做梯度稀释,取适宜稀释度涂布初筛平板A,分别置于50℃培养24 h,浇入Lugo碘液,挑取有蓝色透明圈,且透明圈HC值较大的菌落,划线分离、纯化,50℃培养24 h后接入试管斜面。将纯化菌种同时划线于初筛平板B中,根据水解圈的有无判断该菌是否产生普鲁兰酶,以此区别于产异淀粉酶的菌株。
1.2.3.2 菌株生理生化特征的鉴定
菌株的染色研究:筛选出的菌种划板,在50℃的培养箱中培养24.48 h,然后挑取单菌落,进行细菌的简单染色、革兰氏染色、荚膜染色和芽孢染色。
菌株主要生理生化研究:筛选出的菌种划板培养24 h,然后挑取单菌落,进行细菌的硝酸盐还原试验、V-P试验、甲基红试验、石蕊牛奶试验、接触酶试验。
1.2.3.3 菌株的16sRNA序列分析:
CTAB/NaCl法[10]提取菌株总DNA,琼脂糖凝胶电泳检测DNA片段长度。
16S rDNA扩增:
(1)细菌专一性16S rDNA引物,由TaKaRa公司合成,其序列为:
正向引物:5’-AGAGTTTGATCCTGGCTCAG-3’
反向引物:5’-AAGGAGGTGATCCAGCCGCA-3’
(2)16S r DNA PCR反应体系:50μL
(3)PCR扩增条件:94℃变性5 min;94℃变性1 min,55℃退火90 s,72℃延伸150 s,30个循环;72℃保温20 min。
(4)16S rDNA PCR产物纯化:用上海生工的SilverBeadsDNA胶回收试剂盒进行纯化。
测序及分析:PCR产物经纯化后,与pMD-18-T载体连接,转化DH5α,阳性转化子菌液送华大基因公司完成测序。采用BLASTN在Genbank中进行同源性比对分析。
1.2.3.4 菌株发酵培养方法
用牙签挑取少许纯化菌种接入装有30 mL种子培养基的250 mL锥形瓶内,37℃,180 r/min,培养16 h,然后按20%比例转接入装有40 mL发酵培养基的250 mL锥形瓶内中,置于迴转式恒温调速摇瓶柜中进行好氧发酵,转速200 r/min,37℃发酵48 h。
发酵液离心(10000 r/min,10 min),取上清液,(NH4)2SO4分级沉淀,测定酶活力变化,确定淀粉酶的(NH4)2SO4饱和度。(NH4)2SO4沉淀的酶,经Na2HPO4-柠檬酸缓冲液透析,适当浓缩,用于酶学性质研究。
1.2.3.5 异淀粉酶酶活的测定
[11],DNS法测定菌株酶学活性。
酶活定义:在最适条件下,每1 min产生相当于1 μmol葡萄糖还原力的酶活为1个单位(U)。
发酵时间对酶活力的影响:将种子培养液接入发酵液,于37℃分别发酵24、36、48、60、72、96 h,测定酶活力,确定最适发酵时间。
最适pH及pH对酶稳定性的影响:用不同pH值(pH 3.2、3.8、4.4、5.0、5.6、6.2、6.8、7.4、8.0、8.5)的磷酸盐缓冲液配制0.5%的底物(支链淀粉)溶液,测定酶活,确定最适pH值;将用上述不同pH值缓冲液配制的酶液在40℃分别放置1 h,然后测定剩余酶活力。
最适温度及温度对酶稳定性的影响:用最适pH值的缓冲液配制0.5%的底物溶液,在不同的温度(25、40、50、60、70、80、90℃)下测定酶活,确定酶促反应的最适温度;将酶液分别在上述温度下保温30 min,然后在最适pH、最适温度下测定酶活力。
金属离子及EDT A对酶活力的影响:在酶液中分别添加各种金属离子和EDT A,使反应液中各种金属离子和EDT A的终浓度为1×10-2mol/L,室温下放置30 min,以不加金属离子和EDT A为对照(酶活力为100%),在最适pH值和最适温度下测定残余酶活力。
2 结果与分析
2.1 产异淀粉酶菌株的筛选
筛选到3株透明圈HC值较大的单菌落,编号LCEP-1,DL-3-4-3,DMJS-2-1,经新平板上划线分离、纯化,甘油保种,-70℃保存。
2.2 菌株淀粉水解试验
LCEP-1菌株最适生长温度50℃,用Lugo碘液喷洒在测透明圈平板培养基上测透明圈HC=10;DL-3-4-3菌株最适生长温度50℃,HC=7;DMJS-2-1菌株最适生长温度37℃,HC>10(见图1)。
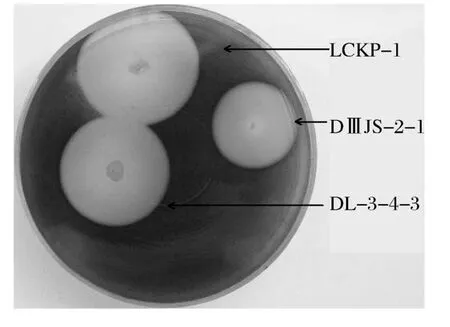
图1 三株菌在含1%玉米支链淀粉平板上产生的透明圈
2.3 菌株生理生化特征的鉴定
菌株的生理生化特征见表1、表2。

表1 菌落特征

表2 细菌的生理生化特征
2.4 菌株的16SrRNA序列分析
CTAB/NaCl法提取菌株总DNA,琼脂糖凝胶电泳检测DNA片段长度大于15 kb。
用细菌特异性16S rDNA引物,扩增出约1.6kb的单一目的条带(图2)。
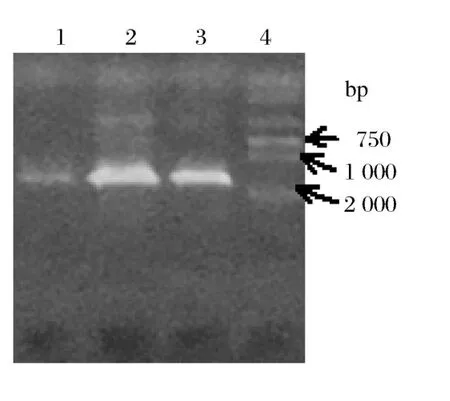
图2 三株菌的16Sr DNA PCR产物约1.6 kb
16S rDNA序列同源性比对分析结果:
产异淀粉酶菌株LCEP-1、DL-3-4-3、DMJS-2-1的16S r DNA在Genbank中分别与B acillus am yloliquefaciensstrain SE-02 BCRC(AB201122)、B acillus subtilis strain ZJ06(Fu266071)、Bacillus subtilisstrain Pab02(EU346662)有99%、97%、99%的同源性,与这3株菌的进化关系较近。综合形态鉴定及生理生化鉴定,初步将它们鉴定为B acillus am yloliquefaciens strain LCEP-1(gb.GQ199589)、Bacillus subtilisDL-3-4-3(gb.GQ199593)和 B acillussubtilisDMJS-2-1(gb.GQ199594)。
2.5 菌株的酶学性质研究
2.5.1 发酵时间对酶活力的影响
由图3知LCEP-1、DL-3-4-3、DMJS-2-1最适发酵时间为48,36、36 h。
2.5.2 酶作用的最适pH值
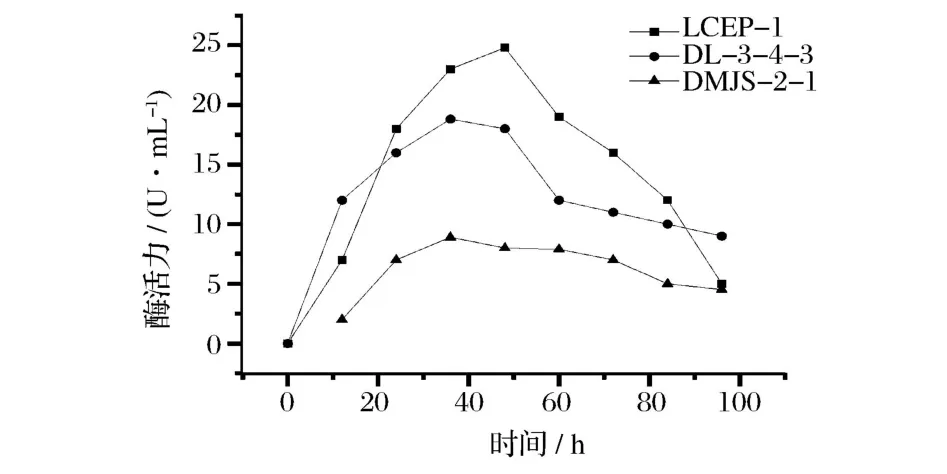
图3 发酵时间-活力曲线
由图4知,LCEP-1、DL-3-4-3、DMJS-2-1最适pH值分别为6.2、5.4、7.8。

图4 pH-活力曲线
3株菌能在偏酸性至中性的pH范围内(pH值4.4~8.0)保持稳定,可以在pH变化较大的条件下保持较高的酶活,在偏酸性、中性和弱碱性环境中都能有效地水解淀粉质底物。
2.5.3 酶作用的最适温度
由图5知,LCEP-1、DL-3-4-3、DMJS-2-1酶的最适反应温度分别为60、55、60℃;LCEP-1酶活力随着温度的升高而下降,70℃以上下降明显。DL-3-4-3、DMJS-2-1在50~70℃间变化较缓慢。
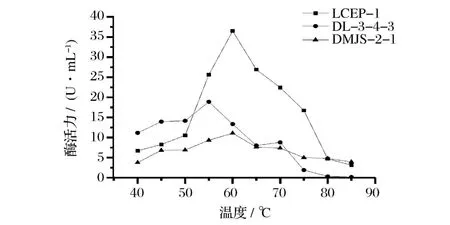
图5 温度-酶活力曲线
2.5.4 金属离子及EDTA对酶活力的影响
图6 结果显示,3株菌的酶对不同金属离子有不同的反应,金属螯合剂EDTA对酶活又有较强的抑制作用,推测可能都属于金属酶。
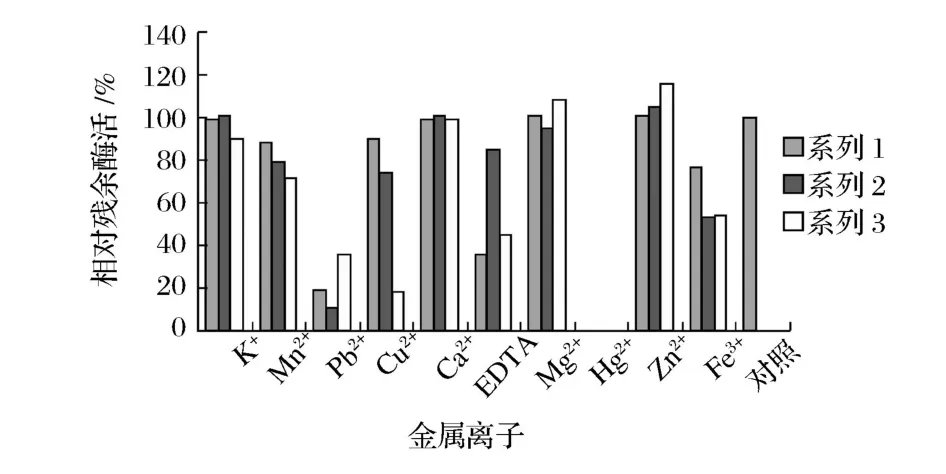
图6 金属离子对酶活的影响
Mn2+、Zn2+对LCEP-1酶活有微弱的激活作用;Pb2+、Fe3+、Cu2+、EDTA对酶活有显著抑制作用;Hg2+对酶活完全抑制;而K+、Mn2+、Ca2+则对酶活影响不大。
Fe3+、Mn2+、Ca2+对DL-3-4-3酶活有微弱的激活作用;Pb2+、Fe3+、Cu2+对酶活有显著抑制作用;EDTA对酶活有轻微抑制作用;Hg2+对酶活完全抑制;而K+、Zn2+、Ca2+则对酶活影响不大。
Zn2+、Mg2+、Ca2+对DMJS-2-1酶活有微弱的激活作用;Cu2+、Pb2+、Fe3+、Mn2+、K+、EDTA对酶活有显著抑制作用;Hg2+对酶活完全抑制;其余则对酶活影响不大。
3 结论
本研究的3株芽孢杆菌的异淀粉酶最适pH分别为pH值6.8、5.4和pH值7.8;最适温度分别为60、55、60℃,与文献报道基本一致。3株芽孢杆菌对金属离子的反应基本相符,但Hg2+的抑制作用非常敏感,酶活被完全抑制。B acillus am yloliquefacie LCEP-1、Bacillus subtilisDL-3-4-2、B acillus subtilisDMJS-2-1在含支链性淀粉的平板上50℃培养24 h,产生典型的变色透明圈;以普鲁兰糖为底物、DNS法测酶活,无活力;而以1%玉米支链淀粉(corn amylopectin,Sigma)为底物,用DNS法测酶活(测定条件:t:55℃,pH:5.0)酶活分别为:27.45、22.17、18.53μ/mL。可见,3株菌所产异淀粉酶,酶系纯,底物专一性强,最适pH可低至pH值5.4,具有良好的应用潜力。
后续工作将对该酶的发酵条件进行优化、诱变育种,克隆和表达该淀粉酶基因,并对酶的应用价值进行更为深入的研究。
参考文献
[1]Nakamura Y.Towards a better understanding of the meta-bolic system for amylopectin biosynthesis in plants:rice endosperm as amodel tissue[J].PlantCell Physiol,2002,43(7):718-725.
[2]张锡清,尤红棣,程池,等.食品级异淀粉酶的提制技术[J].食品与发酵工业,1990,16(2):51-59.
[3]Streb S,Delatte T,UmhangM,et al.Starch granule biosynthesis in Arabidopsis is abolished by removal of all debranching enzymes but restored by the subsequent removal of an endoamylase[J].Plant Cell,2008,20:3448-3466.
[4]Vihinen M,MäntsäläP.Microbial amylolytic enzymes[J].Crit Rev Biochem Mol Biol,1989,24(4):329-418.
[5]Hussain H.Three isoforms isoamylaes Contrbute different catalysis properties for the Debranching of Potato glucans[J].America Society of Plant Biologists,2003,15:133-149.
[6]Gastro G R,Gareia G F,Snierzi F,et al.Extracellular iosmaylaes porduced byBacillus circulans M IR-137[J].ApplBacterial,1992,73:520-523.
[7]王弋博,李博,李三相,等.异淀粉酶产生菌的分离纯化及生长特性[J].青海师范大学学报:自然科学版,2003(1):82-85.
[8]夏静,陈朝银,上官俊龙,等.一株产异淀粉酶栖热菌生产和产酶初步研究[J].微生物学杂志,2005,25(5):107-109.
[9]王武,周晓宏.短杆菌异淀粉酶产生菌选育及酶作用性质研究[J].无锡轻工业学院学报,1993,12(3):197-204.
[10]奥斯伯F,金斯顿R E,塞德曼J G,等著,颜子颖,王海林译.精编分子生物学实验指南[M].北京:科学出版社,1998:39-40.
[11]肖敏、赵祥颖、刘富今.K123普鲁兰酶的合成及酶性质研究[J].山东大学学报,1998,33(1):87-93.
ABSTRACTTo determine the physiological and biochemical characteristics,three B bacillusstrains were isolated from Yunnan springs and were identified by 16 SrDNA sequence analysis asBacillus am yloliquefacieLCEP-1,B acillus subtilisDL-3-4-2 and B acillus subtilisDMJS-2-1 with their GeneBank accession numbers of gb.GQ199589,gb.GQ199593 and gb.GQ199594,respectively.Isoamylases from all three strains could hydrolyze corn amylopectin.The optimal pH of enzymatic reaction respectively was 6.8,5.4 and 7.8;opt imum temperature was 60℃,55℃ a nd 60℃.Underoptimized conditions,the highest enzyme activitywas36.5 U/mL,18.89 U/mL and 11.08 U/mL.The enzymes react differently to metal ions.It isproposed that the three isoamylases belong tometal enzymes because some metal and EDTA showed stronger inhibitory effect than others on the enzyme activity.W ithin the pH range of 4.4~8.0 all three enzymes remain stable;the enzyme activities can maintain high under the condition ofweak acidic,neutral to weak alkaline.
Key wordsisoamylase,screening of strains,characterization
Isolation of ThreeBacillusStra ins and Characterization of Their Isoamylase
Wang Xiao-yan1-4,Li Jun-jun2-4,Yang Yun-juan2-4,Tang Xiang-hua2-4,Meng Yan-fen2,3,4,Xu Bo2-4,Huang Zun-xi1-4
1(College ofWater Conservancy and Civil Engineering,China AgriculturalUniversity,Beijing 100193,China)
2(Engineering Research Center of Sustainable Development and Utilization of Biomas Energy,Ministry of Education,Yunnan 650092,China)
3(The Key Lab of Enzymatic Engineering in Yunnan NormalUniversity,Yunnan 650092,China)
4(Life Science School of Yunnan NormalUniversity,Yunnan 650092,China)
在读博士,副教授。
*云南省应用基础研究计划重点项目:热泉中高温酶功能基因研究与评价(2006C004Z)
2009-12-08,改回日期:2010-01-23
