牛血清白蛋白BSA与维生素A1的相互作用
2010-09-12陈瑞,高雁
陈 瑞,高 雁
(1.忻州师范学院 专科部,山西 忻州 034000;2.忻州师范学院 物理系,山西 忻州 034000)
牛血清白蛋白BSA与维生素A1的相互作用
陈 瑞1,高 雁2
(1.忻州师范学院 专科部,山西 忻州 034000;2.忻州师范学院 物理系,山西 忻州 034000)
文章通过荧光光谱技术研究了维生素A1与牛血清白蛋白BSA的相互作用。结果表明:维生素A1的加入引起了牛血清白蛋白的荧光光谱的静态猝灭,计算了结合常数,推测了维生素A1与BSA结合的位点和驱动力。
维生素A1;牛血清白蛋白;荧光光谱
维生素A1,又称视黄醇,是人体必需的13种维生素之一,是一种脂溶性抗氧化剂,在人体中可以维持视力,促进骨骼成长和增强抵抗力[1]。有时为了提高食品的营养,往往通过在食品中加入维生素进行强化。血蛋白作为体内含量最大的蛋白,许多内源性和外源性化合物都能与它结合,在体内起存储和转运的功能,因此它在药物代谢过程中起到了重要的作用[2]。本文对维生素A1与牛血清白蛋白(BSA)作用的光谱进行了研究。分析出维生素A1对BSA的荧光猝灭机制,由实验得出它们的结合常数,计算出结合距离,并通过热力学参数分析了它们之间的作用力类型。
1 实验部分
1.1 仪器与试剂
LS-50B型荧光分光光度计(美国Perkin-Elmer公司),HP 8453紫外分光光度仪,循环水浴控温比色槽,微量进样器,牛血清白蛋白BSA(美国Sigma公司,生化试剂),维生素A1为市售产品。
1.2 光谱测定
利于紫外分光光度仪测定维生素A1(2.0×10-5mol·L-1)溶液的吸收光谱。
用维生素A1溶液滴定BSA溶液,以λex=290 nm,测定300~400 nm荧光光谱。测定分别在27℃和37℃下进行。
1.3 维生素A1与BSA上第一位强结合部位残基间的距离
移取1 ml 2.0×10-5mol·L-1的BSA于1 cm石英比色池中,加入与BSA等量的维生素A1,测定其荧光光谱。在荧光分光光度计上测定BSA在290-450 nm波长范围内的发射光谱。紫外吸收光谱在300-450 nm范围内测定BSA与UV物(2.0×10-5mol·L-1)分子比为 1∶1 的光谱。
2 结果与讨论
2.1 维生素A1与BSA作用的荧光光谱研究
蛋白质的荧光光谱可以反映出蛋白分子中荧光生色基团的种类及其所处微环境及分布情况,BSA分子所具有的内源性荧光就是由其结构中的Trp和Tyr残基所致。在本实验中,当λex=280 nm时,在345 nm附近会出现BSA的荧光发射峰。而维生素A1在345 nm附近区域无荧光发射峰。图1为27℃时,维生素A1对BSA的荧光猝灭图。由图1可见,随着维生素A1的加入,BSA的荧光发射峰强度逐渐降低。说明维生素A1对BSA有猝灭作用。
据文献报道,蛋白质的荧光猝灭有动态猝灭和静态猝灭[3]两种机制。蛋白质的激发态分子和猝灭剂之间的相互作用引起动态猝灭,随温度升高其猝灭常数增大;而荧光物质和猝灭剂发生配合反应形成不发光的配合物引起静态猝灭,随温度升高其猝灭常数减小。其中金属配合物对蛋白质的动态猝灭可以下式表示:
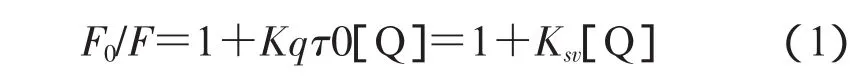
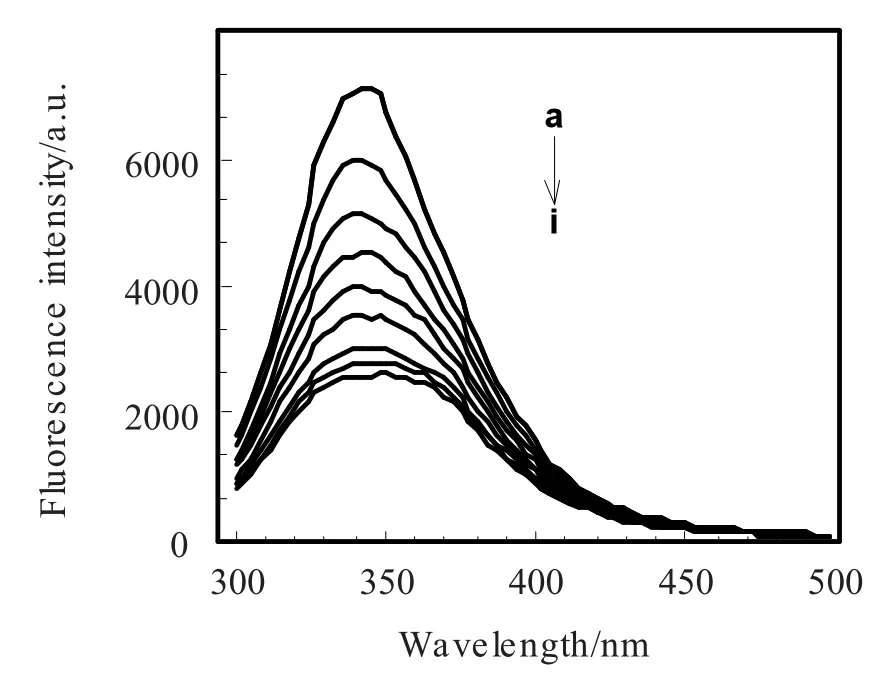
图1 维生素A1对BSA荧光光谱的影响Fig.1 VitaMin A1 in fluences on fluorescence spectra of BSA at 27℃
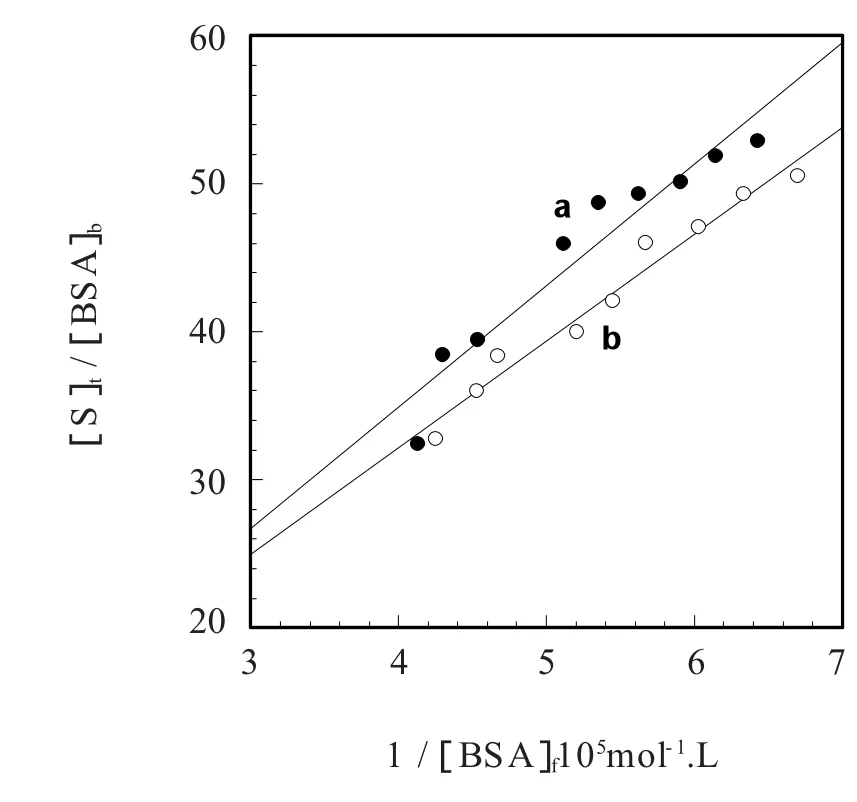
图2 维生素A1-BSA体系的Stern-Volmer方程拟合图Fig.2 Stern-Volmer polts of VitaMin A-BSA systems
即Stern-Volmer方程,式中F0表示蛋白质的原始荧光强度,F表示在加入配合物后蛋白质的实时荧光强度,Kq为动态荧光猝灭速率常数(L·mol-1·s-1),τ0为蛋白质荧光平均寿命,约为 10-8s[4]。[Q]表示配合物平衡浓度,Ksv表示配合物对蛋白质的动态猝灭常数(L·mol-1),配合物对蛋白质的最大动态荧光猝灭速率常数约为2.0×1010L·mol-1·s-1。研究分别在不同温度时,以维生素A1对BSA进行滴定,由实验数据作出BSA的Stern-Volmer曲线(图2),按照(1)式处理实验数据得到KSV约为3.2×1012L·mol-1·s-1,远大于配合物对蛋白质的最大动态荧光猝灭速率常数 2.0×1010L·mol-1·s-1。同时,猝灭常数随温度升高而降低,故可知维生素A1对BSA的荧光猝灭机制为静态猝灭。
若维生素A1与BSA结合形成不发荧光的维生素A1-BSA复合物,同时假定每个BSA分子有n个相互独立且完全等同的结合位点[5],则有:
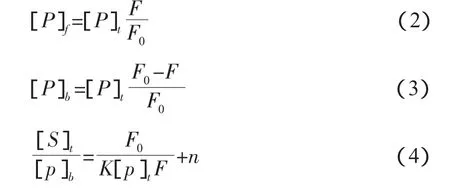
其中[P]t表示 BSA原始浓度,[P]b表示结合维生素A1后的BSA即时浓度,[P]f表示游离的BSA浓度,[S]t表示维生素A1的总浓度,F0和F分别表示未加和加入维生素A1的BSA荧光强度,K为维生素A1与BSA的结合常数,n为结合位点数。结合图1中维生素A1对BSA的荧光猝灭数据,根据(3)式计算结合维生素A1的BSA的浓度[P]b,然后以(4)式作图,由图中直线的斜率可得结合常数K,见表1。

表1 维生素A1与牛血白清蛋白结合常数Table 1 Binding constants k for VitaMin A1 and BSA
2.2 维生素A1与BSA结合位点
蛋白质中荧光基团和小分子之间的结合距离,按Förster偶极 - 偶极无辐射能量转移传递机理[6],可由下列关系式求出:
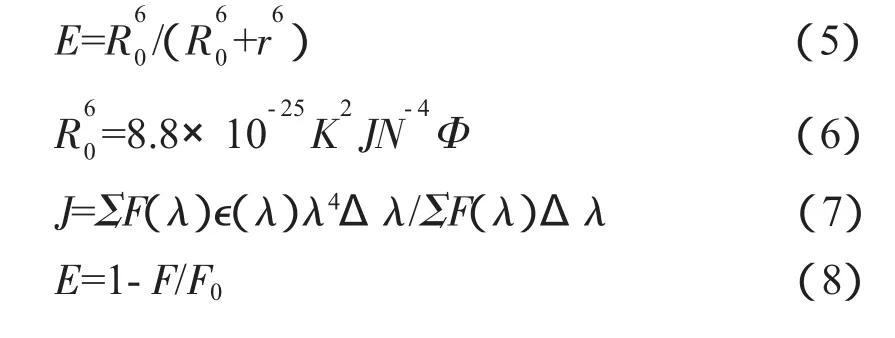
其中,E表示能量供体和能量接受体的能量传递效率,R0是E为50%时临界能量转移距离,r表示授体-受体间距离,K表示偶极空间取向因子,K2=2/3,介质的折射指数N=1.33,授体的荧光量子产率Φ=0.13,J是授体荧光发射光谱与受体吸收光谱间的光谱重叠积分,F(λ)是授体在波长λ处的荧光强度,∈(λ)是受体在波长λ处的消光系数。
根据(7)式计算得 J=17M-1cm3(nm)4,代入式(6),求得 R0。由式(8)和图3,得到维生素 A1 与BSA等摩尔比时的能量转移效率E=0.045,然后再由式(5)可求得维生素A1与BSA中的色氨酸残基间的距离r=3.0 nm。
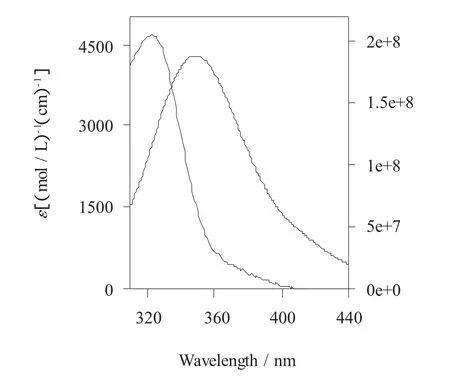
图3 BSA荧光光谱和维生素A1的UV光谱Figure.3 The UV spectra of VitaMin A1 and fluorescence spectra of BSA at20℃
2.3 作用力类型的确定
根据下列热力学参数之间的关系式,结合前面求得的不同温度下的结合常数,可计算出维生素A1与BSA作用的热力学参数ΔH、ΔS、ΔG:
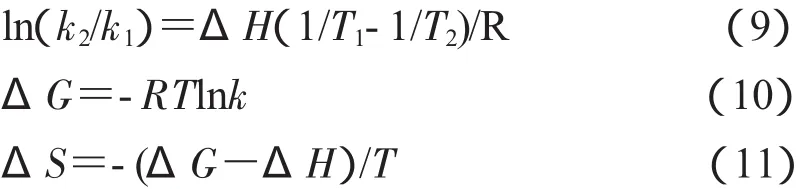
当温度变化区间较小时,焓变ΔH可以近似认为是一个常数。由上述热力学公式计算出的维生素A1与BSA作用的热力学参数ΔH、ΔS、ΔG如表2所示。
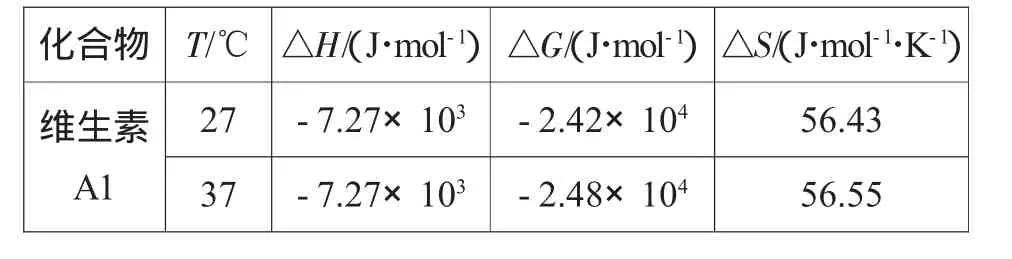
表2 维生素A1-BSA结合过程的热力学参数Table 2 ThermodynaMic parameters of VitaMin A 1-BSA binding process
配合物分子和蛋白质等生物分子间的作用力主要有:静电力、疏水力、范德华力和氢键。Ross根据热力学参数与作用力的关系,归纳出了配合物分子和蛋白质的分子间作用力的类型。Ross认为:若ΔS>0,ΔH≌0,配合物与蛋白之间主要以疏水作用力结合,ΔS>0,ΔH<0时配合物与蛋白质分子以静电作用力结合[7]。故推断维生素A1与BSA的结合可能是静电作用与疏水作用共存作用的结果。
[1]Tekes K,Gyenge M,Hantos M,Csaba G.Brain Dev,2009,31,666-670.
[2]Bakshi,MS,Jaswal,VS,Kaur,G,et al.J.Phys.Chem.C,2009,113,9121-9127.
[3]闻晓东,李萍,等.三种抗氧化物质与牛血清白蛋白的相互作用[J].化学学报,2007,65,421-429.
[4]杨频,高飞.生物无机化学原理[M].科学出版社,北京:2002,p.493.
[5]肖厚荣,盛良全,施春华,等.水杨酸与牛血清蛋白相互作用的荧光光谱研究[J].光谱学与光谱分析,2004,24(1),78-81.
[6]程极济译:蛋白质及核酸的激发态与能量转移译文集[M].科学出版社,1981,77.
[7]Ross P D,Subramanian S.BiocheMistry,1981,20,3096-3102.
(责任编辑 王璟琳)
O657.31
A
1673-2014(2010)02-0008-03
2009—12—11
陈 瑞(1971— ),女,山西保德人,硕士,讲师,主要从事基础化学及实验研究。
高 雁(1976— ),女,山西保德人,硕士,副教授,从事大学物理教学与研究工作。
