食用百合试管苗缓慢生长保存的研究
2010-09-12张玉芹冯建军赵景芳
张玉芹 冯建军 赵景芳
(1内蒙古民族大学农学院,内蒙古通辽 028043;2兴安盟科右中旗农业局,内蒙古科右中旗 029400;3内蒙古兴安盟突泉县农业技术推广中心,内蒙古兴安盟 137500)
食用百合试管苗缓慢生长保存的研究
张玉芹1冯建军2赵景芳3
(1内蒙古民族大学农学院,内蒙古通辽 028043;2兴安盟科右中旗农业局,内蒙古科右中旗 029400;3内蒙古兴安盟突泉县农业技术推广中心,内蒙古兴安盟 137500)
为了建立食用百合种质资源缓慢生长保存体系,将扩繁培养后得到的试管苗接种到12种不同培养基中,10 ℃和25 ℃下分别保存6个月,观察不同处理试管苗生长情况。结果表明:低浓度甘露醇对百合试管苗生长的抑制效果差,而高浓度甘露醇严重影响其生长势,缓慢生长保存的最适浓度为20 g·L-1;蔗糖对百合试管苗的生长有抑制作用,适宜浓度为60 g·L-1;20 g·L-1甘露醇+60 g·L-1蔗糖处理的百合试管苗存活率均达100 %,且有鳞茎形成,保存效果最好。10 ℃保存的试管苗生长缓慢,有利于鳞茎形成,保存至6个月时不需要继代培养;25 ℃保存试管苗的鳞茎形成率低,培养基损失量高,必须继代才能继续保存。
食用百合;试管苗;缓慢生长
食用百合有很高的食用价值,是菜中珍品,其肥厚的鳞片含有丰富的淀粉和蛋白质、脂肪、糖类、果胶质,VB1、胡萝卜素的含量也较丰富,还含有钙、磷、锌、铁、硒等13种微量元素和18种氨基酸(卢美娇,2001;马云光和邓成忠,2002)。百合栽培一般采用分球繁殖,用种量大,生长周期长;鳞片扦插易腐烂,成活率低,容易感染病毒,造成品种退化,从而影响产品品质(岳雷,2005)。缓慢生长保存植物种质资源是近年来新发展起来的,较为有效的种质保存方法:以组织培养技术为基础,通过改变试管苗的生长环境,使细胞生长降至最小限度,延长继代间隔时间,减少继代次数,以避免频繁继代造成污染或引发种质变异。具有保存时间长,占空间少,利用时可直接播种入土壤,操作简便,节省费用,且安全、可靠、无病虫为害等优点,尤其适用于无性繁殖的作物(周逊和向长萍,2008)。该技术已应用于马铃薯、甘薯、草莓、大蒜、生姜、胡萝卜等作物(Westcott,1981;Withers,1986;徐培文 等,2002;庄飞云 等,2005;赵密珍 等,2006;周逊 等,2008),但通过缓慢生长保存食用百合种质资源的研究却鲜见报道。本试验以兰州百合〔Lilum davidiiDuch. var.unicolor(Hoog)Cotton〕为试材,探讨温度、甘露醇及蔗糖浓度对百合试管苗缓慢生长的影响,以期为保存百合种质资源提供理论依据。
1 材料与方法
1.1 材料
供试材料为兰州市场上购买的2008年收获的新鲜兰州百合。
1.2 试验方法
MS+IAA0.05 mg·L-1+6-BA0.1 mg·L-1培养基诱导分化形成的小苗,经 MS+NAA0.1 mg·L-1+6-BA0.25 mg·L-1培养基扩繁后继代培养一段时间,待长成15~25 mm长的幼苗后,接种在不同培养基上(表1),分别在(10±1)℃和(25±1)℃下保存,光照时间为每天8 h,光照强度为6130 lx(560 FC)。每个处理3次重复,每个重复接种3瓶,共9瓶,每瓶5株试管苗,同时做空白培养基计算培养基损失量,每处理3瓶。
保存期间,测定培养基的质量,观察试管苗的生长状况和基部是否有鳞茎发生,测量试管苗的株高。为防止污染,试管苗株高是用直尺直接在三角瓶外测定。

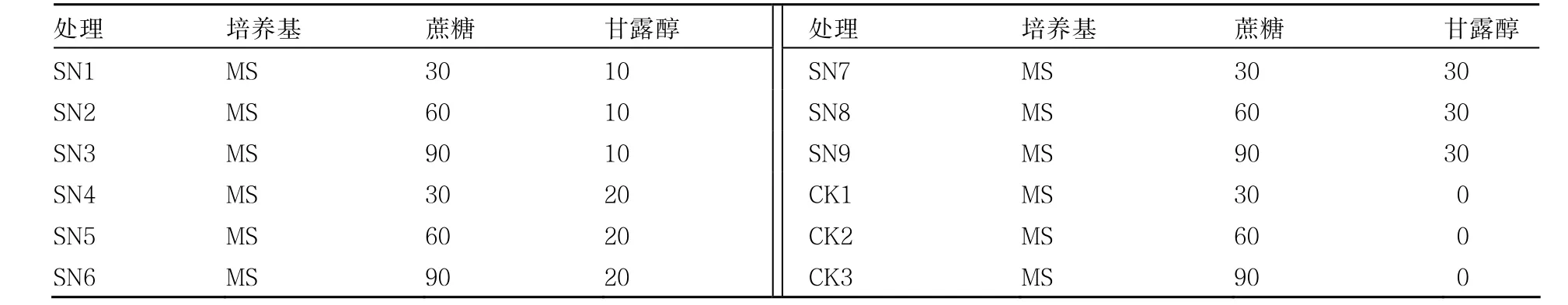
表1 试管苗缓慢生长保存培养基设计 g·L-1
2 结果与分析
2.1 试管苗成活率
由表2可以看出,不同处理试管苗,10 ℃下保存3个月时,存活率均为100 %,保存6个月时,除SN2、SN4、SN5和SN6外,其他处理的试管苗均有不同程度枯死,其中CK3蔗糖浓度为90 g·L-1且未添加甘露醇的试管苗存活率最低,只有79.6 %。甘露醇和蔗糖浓度对试管苗存活率均有影响:SN4、SN5和SN6甘露醇浓度为20 g·L-1的试管苗存活率最高,达100 %;SN8蔗糖浓度为60 g·L-1时,试管苗的存活率较高,蔗糖浓度过高存活率下降。
25 ℃下保存3个月时,不同处理的试管苗开始出现枯死现象。SN4和SN5甘露醇浓度20 g·L-1试管苗存活率为100 %,SN8蔗糖浓度60 g·L-1时,试管苗存活率为100 %,甘露醇浓度和蔗糖浓度过高试管苗的存活率均下降。保存6个月时,SN5(20 g·L-1甘露醇+60 g·L-1蔗糖)试管苗存活率为100 %,其他处理的试管苗均有不同程度死亡。
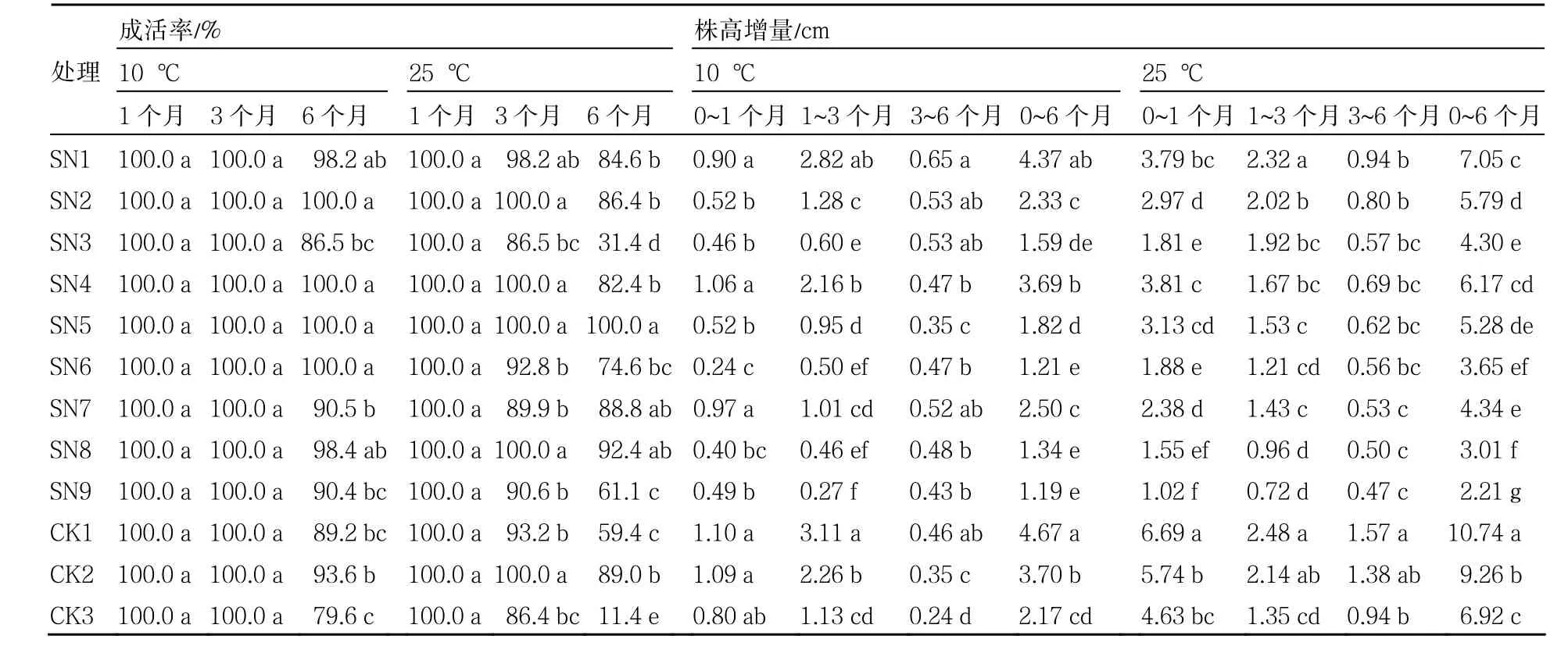
表2 不同处理保存试管苗平均成活率及株高增量
2.2 试管苗株高变化
从表2可知,10 ℃下保存的试管苗在保存1个月时生长很缓慢,除CK1、CK2和SN4外,其他处理株高增加量均不到1 cm,且生长健壮。第1~3个月试管苗生长较快,保存到3个月时,CK1株高增量最大,为3.11 cm,但叶尖有轻度枯死,SN9株高增量最小,只有0.27 cm。蔗糖浓度越高株高增量越小,说明蔗糖可明显抑制试管苗的生长,甘露醇浓度对株高的影响不及蔗糖浓度,但也表现为随着浓度增高抑制作用增强的趋势。保存到6个月时,试管苗增长缓慢,未添加甘露醇的处理株高增量最小,但试管苗叶尖枯死较严重,SN5(60 g·L-1蔗糖+20 g·L-1甘露醇)处理的增量小且未出现叶尖枯死。
25 ℃下保存的试管苗株高较10 ℃下保存的试管苗增长快,对蔗糖及甘露醇的反应与10℃下保存的趋势基本相同,蔗糖浓度及甘露醇浓度过高导致试管苗枯死,CK3叶尖枯死最为严重,甘露醇浓度超过20 g·L-1时叶尖也出现枯死。25℃下保存的试管苗仍表现为甘露醇浓度20 g·L-1+糖浓度60 g·L-1时保存效果最好。
2.3 缓慢保存试管苗微型鳞茎形成状况
由表3可知,在10 ℃下保存3个月,除SN1和CK1外,其他处理试管苗均有微型鳞茎形成,SN5形成率最高,为68.9 %;保存6个月时各处理及对照均有微型鳞茎形成,SN3、SN5和SN8形成率均超过80 %,其中SN5达到了93.3 %。
25 ℃下保存的试管苗在保存1个月时部分处理就有微型鳞茎出现,以SN5的形成率最高,为24.4 %,而培养基中蔗糖浓度较低的SN1、SN4、SN7和CK1均未有微型鳞茎形成。保存6个月后,SN1、SN4、SN7和CK1仍未有微型鳞茎出现,SN5的鳞茎形成率仍最高,同一处理的鳞茎形成率均低于10 ℃保存6个月的鳞茎形成率,表明在一定范围内,提高蔗糖浓度降低保存温度有利于兰州百合试管苗的鳞茎形成。
2.4 试管苗培养基损失量
由表3可以看出,10 ℃下保存1个月,培养基损失量均很低,未超过2 %;随着保存时间延长,培养基损失量增加,3个月时CK1损失量最大,为6.92 %,SN6损失量最小,为4.34 %;保存6个月时,CK1损失量最大,为12.40 %;10 ℃下保存试管苗6个月不需要更换培养基。25 ℃下保存试管苗培养基保存1个月时损失量均超过5 %,保存6个月时损失量超过20 %,损失量最大的为CK1,达31.54 %,最小的为SN9,达20.21 %,如作保存培养基需继代才能继续保存。
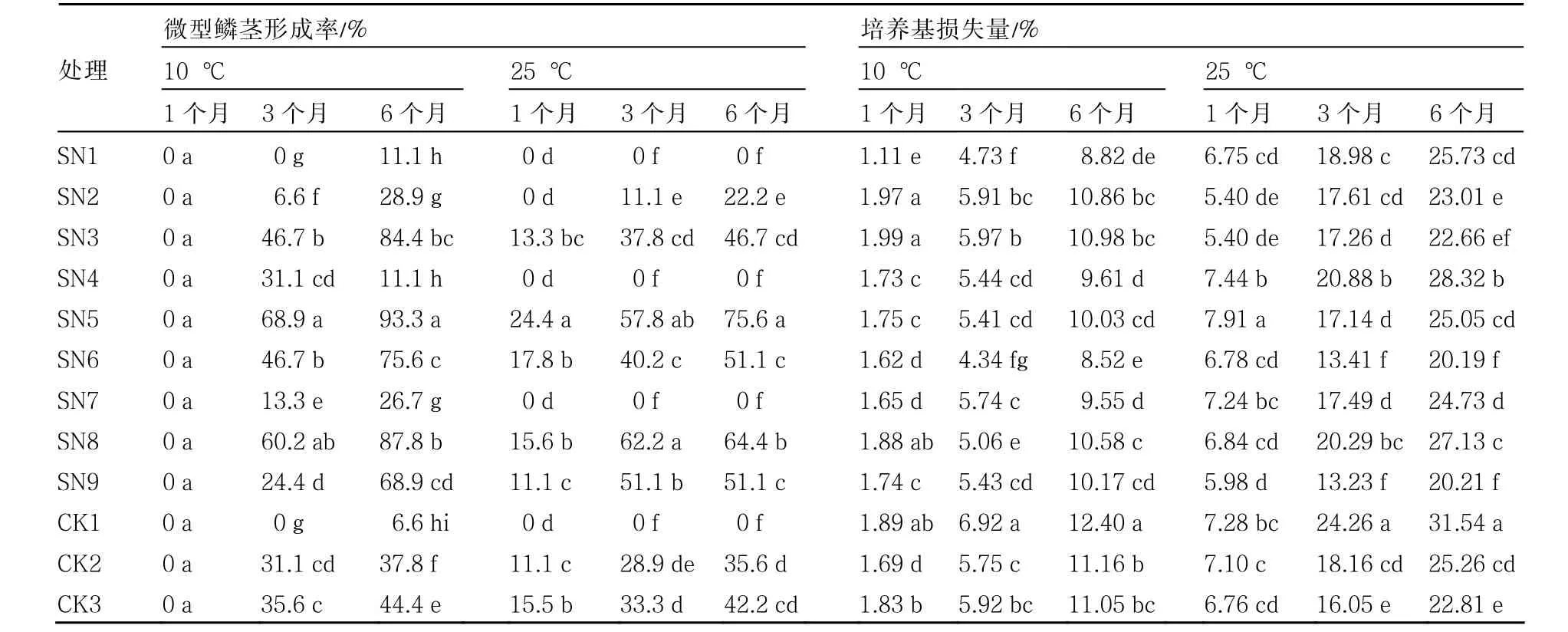
表3 不同处理保存试管苗微型鳞茎形成率及培养基损失量
3 结论与讨论
3.1 温度对试管苗保存的影响
降低培养温度是植物组织培养物缓慢生长保存最常用的方法(徐刚标,2000),野葛常温下保存180 d后成活率为80 %,4 ℃低温下保存180 d后成活率可达98 %(洪森荣 等,2007)。本试验将百合试管苗在2种温度条件下培养,结果表明,10 ℃的低温条件下培养6个月,试管苗不需要更换培养基可继续保存,且低温有利于微型鳞茎的形成;25 ℃下保存的试管苗3个月就出现叶尖枯死,6个月后培养基损失量大,需要更换培养基才能继续保存。因此,降低培养温度可显著降低百合试管苗生长速度,减少其继代次数,节省人力、物力,使其得以较长期的保存。
3.2 生长抑制剂对试管苗保存的影响
甘露醇能减小细胞膨压,使养分和水分吸收困难,从而抑制植株生长,减少养分消耗,具有延长植株保存期限的作用(Dorion et al.,1994);香草在添加15 g·L-1甘露醇培养基上保存,只需每年继代1次即可(Divakaran et al.,2006);在添加1 %~3 %甘露醇的MS培养基上,淡黄花百合组培苗保存10个月后存活率为92 %左右(李黛 等,2006);辛淑英和谢欣(1995)研究得出2 %甘露醇处理保存的百合试管苗效果最好。本试验中,10 ℃下保存在添加甘露醇培养基试管苗,6个月后不需要继代而继续保存,且试管苗生长健壮;25 ℃下保存的百合试管苗,在加有甘露醇的培养基中保存6个月,转到新鲜培基上仍能成活,甘露醇浓度为20 g·L-1时效果最好。
糖类物质是试管苗生存和生长的主要碳源(史永忠 等,1996)。添加蔗糖后,咖啡试管苗保存2 a大大提高了成活率,但浓度过高,植株吸水困难,也会导致不良后果(Kartha et al.,1981)。陈辉等(2006)研究百合种质资源限制生长法保存时得出,培养基中添加高浓度蔗糖会限制其生长,随着蔗糖浓度的升高,抑制作用逐渐加强,但高浓度的糖会增加试管苗死亡率,蔗糖浓度达到90 g·L-1以上时出现死亡。本试验结果表明,蔗糖浓度在60 g·L-1时保存的百合试管苗效果最好。
3.3 试管苗保存的可行性
建立在植物微繁基础上的试管苗缓慢生长保存,其目的是降低试管苗的生长速度,从而建立试管苗种质库,达到中长期保存。缓慢生长保存的试管苗可随时转入繁殖,不需长时间恢复,这对快速繁殖十分有用。在年周期中,并非任何时候都适于进行快繁;市场对品种的需求也是变化莫测的。因此,有必要对一些试管材料进行中短期的保存,在这种情况下,试管缓慢生长保存是较为合适的保存方法。在本试验中,由百合鳞片诱导培养出来的试管苗在10 ℃低温下不经继代遮光保存6个月,长势良好,SN2、SN5和SN6处理存活率达到100 %。说明利用这一途径对百合种质资源进行中短期保存是可行的。但要在实践中运用还有许多需要完善的地方,如:关于百合低温保存生理的研究、百合低温保存后遗传变异的检测等。
陈辉,陈晓玲,陈龙清,卢新雄.2006.百合种质资源限制生长法保存研究.园艺学报,33(4):789-793.
洪森荣,尹明华,柯维忠,黄永福,王忠敏,张莉华.2007.PP333对野葛离体保存的影响.上饶师范学院学报,27(6):68-72.
李黛,曾艳玲,魏福伦.2006.淡黄花百合的离体保存.贵阳学院学报:自然科学版,1(3):45-47.
卢美娇.2001.药用百合与食用百合的区别.时珍国医国药,12(9):806.
马云光,邓成忠.2002.食用百合高产栽培技术.中国果菜,(1):23.
史永忠,邓秀新,万蜀渊,薛光荣.1996.苹果种质资源的离体保存.作物品种资源,(4):42-44.
辛淑英,谢欣.1995.甘露醇浓度对百合种质离体保存的影响.作物品种资源,(3):50-52.
徐刚标.2000.植物种质资源离体保存研究进展.中南林学院学报,20(4):81-87.
徐培文,曲士松,刘恒英,张杰,孙晋斌,黄宝勇.2002.中国大蒜种质资源离体保存初步研究.中国农业科学,35(3):314-319.岳雷.2005.浅谈食用百合的应用和栽培技术.中国果菜,(5):53.
赵密珍,王壮伟,钱亚明,苏家乐,袁骥.2006.不同培养基对草莓种质离体保存的影响.果树学报,23(1):27-30.
周逊,李锡香,向长萍,王海平,沈镝.2008.生姜种质资源的常温离体保存.遵义师范学院学报,8(4):50-53.
周逊,向长萍.2008.植物种质资源缓慢生长离体保存研究进展.中国蔬菜,(11):39-42.
庄飞云,赵志伟,廖开志,王翠.2005.常低温离体保存胡萝卜种质资源研究初探.中国蔬菜,(3)19-20.
Divakaran M,Babu K N,Peter K V.2006.Conservation of Vanilla species,in vitro.Scientia Horticulturae,110:175-180.
Dorion N,Regnard J L,Serpette I,Bigot C.1994.Effects of temperature and hypoxic atmosphere on preservation and further development of in vitro shoot of peach(‘Armking’)and peach×almondhy-hybrid(‘GF677’).Scientia Horticulturae,57(3):201-213.
Kartha K K,Mroginski L A,Pahl K,Leung N L.1981.Germplasm preservation of coffee(Coffea arabica L.)by in vitro culture of shoot apical meristems.Plant Sci Lett,22(4):301-307.
Westcott R J.1981.Tissue culture storage of potato germplasm.2.use of growth retardants minimal growth storage.Potato Research,24:343-352.
Withers L A.1986.Cryopreservation and genebanks.Plant Cell Culture Technology:6-140.
Studies on Edible Lily in vitro Conservation Technique by Slow-growth Method
ZHANG Yu-qin1, FENG Jian-jun2, ZHAO Jing-fang3
(1College of Agronomy, Inner Mongolia University for Nationalities, Tongliao028043, Inner Mongolia, China;2Agriculture Bureau of Xinganmeng, Keyouzhongqi029400, Inner Mongolia, China; 3Agricultural Technology Extension Center of Tuquan County, Xinganmeng137500, Inner Mongolia, China)
In order to establish conservation system for edible lily slow-growth germplasm resources,the test-tube plantlets gained from micro-propagation were inoculated in12 different culture media and conserved under10 ℃ and25 ℃ for6 months, respectively, so as to observe the growth of test-tube plantlets under different treatments. The results showed that the low mannitol concentration has poor control affect on the growth of test-tube plantlets, while the high concentration severely affect the plantlets growth. The suitable mannitol concentration was20 g·L-1for conserving edible lily plantlets with slow-growth. Sucrose has restrain effect on the growth of test-tube plantlet,60 g·L-1sucrose is the suitable media.20 g·L-1mannitol+60 g·L-1sucrose is the best treatment for slow growth conservation of edible lily test-tube plantlets. Their survival rate can reach100 %, and the rate of bulb formation is high.10 ℃ can keep the plantlet grow slowly and promote the bulb formation for6 months conservation without subculture, while under25 ℃ the rate of bulb formation is reduced, and the medium loss is serious. The plantlets must be preserved with subculture.
Edible lily; Test-tube plantlet; Slow-growth
S644.1
A
1000-6346(2010)24-0069-05
2010-09-16;接受日期:2010-10-16
张玉芹,女,博士,讲师,主要从事无性繁殖蔬菜种质保存研究工作,E-mail:zhyq369@126.com
