采用PCR方法对我国蜱伯氏疏螺旋体感染的流行病学调查
2010-09-11牛庆丽关贵全杨吉飞付钰广马米玲李有全刘军龙郝雪峰罗建勋
牛庆丽,关贵全,杨吉飞,付钰广,马米玲,李有全,刘军龙,郝雪峰,罗建勋,殷 宏
(中国农业科学院兰州兽医研究所家畜疫病病原生物学国家重点实验室,甘肃兰州730046)
莱姆病(Lyme disease)又称莱姆包柔体病或莱姆疏螺旋体病,是一种经蜱传播的自然疫源性人兽共患病,因首次在美国康涅狄格州的莱姆镇发现而得名[1]。病原体为伯氏疏螺旋体(Borrelia burgdorferi),可分为13个基因型或组[2]。1982年,W illy等在美国首次从肩突硬蜱中分离出B.burgdorferi[4],我国于1986年首次在黑龙江省海林县林区发现该病,之后陆续报道的病原有狭义伯氏疏螺旋体(B.burgdorferi sensus stricto)、伽氏疏螺旋体(B.garinii)、阿氏疏螺旋体(B.afzelii)和法雷斯疏螺旋体(Borrelia valaisiana)共4个基因型[3]。到目前为止,我国29个省(区、市)均有人莱姆病的报道,每年新发病例高达万余例。蜱是B.burgdorferi的传播媒介和贮存宿主,在其叮咬吸血的过程中,将病原传递给脊椎动物。我国地域辽阔,不同地区蜱的种类及B.burgdorferi感染情况存在很大的差异,因此探明媒介蜱的种类在该病的防治中具有重要意义。
虽然在莱姆病的流行病学方面取得了一定的研究进展,但是获得的数据已经不能确切反应该病在我国的流行状况。常规的细菌分离与鉴定、细菌抗原检测等方法,对动物组织、血液以及传播媒介蜱等菌体含量低微的样品检测时,往往得不到准确的结果,容易漏检。本研究从文献[6-8]中用于扩增B.burgdorferi OspA基因片段的3对引物中筛选出一对特异、敏感的引物,建立了PCR检测方法,该方法具有高度的敏感性和特异性,并且操作简便,适用于动物组织、血液及蜱体内的病原检测。
1 材料和方法
1.1 实验用B.burgdorferi标准基因组DNA 分别从德国慕尼黑大学Max von pettenkofer研究所和荷兰引进14株B.burgdorferi基因组样品,涵盖了国内分布的主要基因型,即:PKo(B.afzelii)、PKa(B.burgdorferi sensus stricto)、 T25(B.garinii)、 PBi(B.garinii)、PBr(B.garinii)、B31(B.burgdorferi sensus strict)、 20047(B.garinii)、IP90(B.garinii)、PFim(B.garinii)、Poti(B.garinii)、PTrob(B.garinii)、PHei(B.garinii)、PKab(B.garinii)和 TN(B.garinii)。
1.2 样品采集 2009年4月~7月在福建省(南平市)、湖南省(怀化市)、广东省(惠州市)、广西壮族自治区(来宾市)、黑龙江省(尚志市)、吉林省(珲春市)和甘肃省(临潭县)的山区放养的牛羊身上采集寄生蜱共667只,经实验室鉴定为革蜱属(264只)、血蜱属(173只)、牛蜱属(185只)和扇头蜱属(45只)。
1.3 主要试剂 Taq DNA聚合酶等购自TaKaRa公司,DNA提取试剂盒购自Gentra公司。
1.4 引物合成及筛选 按照文献[6-8]设计3对通用引物,SL1PF:5'-AATAggTCTAATAATAgCCTTAA TAgC-3', SL1PR: 5'-CTAgTgTTTTgCCATCTTCTTT gAAAA-3'; SL2PF: 5'-ggAAAAgCTAAAgAg[A]gTT TTAAAA-3',SL2PR:5'-TTATTTTAAAgCgT[g]T[C]TTT-3';SL3PF:5'-ggAAAAgCTAAAgAggTTTTAAA A-3', SL3PR: 5'-TTATTTCAAAgCg-3'。 引 物 由TaKaRa公司合成,扩增目的片段分别为307bp、316bp和 320bp。
1.5 基因组DNA的提取 按说明书DNA提取试剂盒提取667只蜱的DNA。
1.6 PCR的特异性试验 采 用 引 进 的 14株B.burgdorferi基因组样品和从健康牛羊血液、衣原体、支原体、牛无浆体、羊无浆体样品中提取的DNA,进行PCR扩增,体系为:10×PCR buffer 5μL,dNTPs(2.5mmol/L)4μL,Taq DNA 聚合酶 0.3μL(5u),上、下游引物 (50pmol/μL)各0.5μL,模板(10ng/μL)1μL。反应条件:94℃3m in;94℃ 1min、57.6℃ 1m in、72℃ 1min,35个循环;72℃10min。PCR产物经琼脂糖凝胶电泳观察并分析结果。
1.7 PCR敏感性试验 将PKo,B31和PBi3株代表性B.burgdorferi基因组DNA进行分光光度计测定含量,稀释至 10ng/μL,10倍倍比稀释(10-1~10-12)进行PCR扩增,以检测其敏感性。
1.8 流行病学调查 以提取的667只蜱样品基因组DNA为模板,用SL1引物对进行PCR扩增,分析结果。
2 结果与讨论
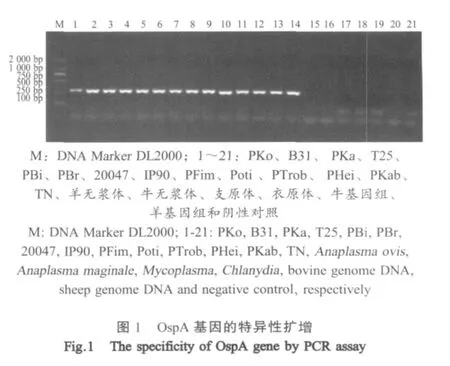
2.1 引物筛选及PCR特异性扩增结果 分别对3对引物扩增的反应条件进行比较,从中筛选出特异性和敏感性较好的一组引物SL1,退火温度确定为57.6℃。对14株B.burgdorferi分离株的OspA基因进行PCR扩增,均出现了与预期片段大小一致的条带,大小约为 300bp(图 1)。扩增产物测序及BLAST分析结果表明,其序列为B.burgdorferi OspA基因,而衣原体、支原体、牛无浆体、羊无浆体和牛羊血液基因组DNA及阴性对照,均无扩增片段。结果表明,所建立的PCR方法具有良好的特异性。OspA是B.burgdorferi主要外膜蛋白之一,在体外和体内高效表达。OspA是一种粘附素(Adhesion),对螺旋体在蜱肠中(M idgut)的定居至关重要,缺乏该蛋白B.burgdorferi在蜱体内无法存活。B.burgdorferi OspA与其他微生物如梅毒螺旋体、赫氏疏螺旋体和钩端螺旋体的交叉反应较低,因此,在分子诊断及流行病学研究方面有重要意义[9]。
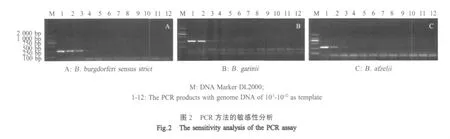
2.2 PCR敏感性试验结果 选用B.burgdorferi 3个致病性种代表株,将基因组DNA定量后,稀释为 10ng/μL,以 10倍倍比稀释进行 PCR检测。BB、BG和BA 3种基因组DNA样品的最低检出量分别为0.01pg、1pg和10pg,即该方法可检测到0.01pg~10pg的基因组DNA(图2),表明该方法具有较高的敏感性。
2.3 野外样品检测结果 对采集自7个省份的蜱用建立的PCR方法进行检测,其中革蜱属10只为阳性,血蜱属有11只检测为阳性,牛蜱属59只为阳性,扇头蜱属14只为阳性结果,4种蜱属的检出率分别为 4%(10/264),6%(11/137),32%(59/185)和31%(14/45)。
这4种蜱属中的3种,即:牛蜱属,血蜱属和革蜱属,体内存在莱姆病病原,并且带菌率较高,表明这些蜱可能在莱姆病的流行与传播中发挥一定的作用。试验结果表明,湖南省和广西省的牛蜱属感染率较高,与以往报道结果相符,证实牛蜱在这些地区为莱姆病传播的优势蜱属[10],而血蜱属感染率与以往所报道的相比较低,这可能与采集地区蜱的分布及莱姆病流行地区的密度有关。从甘肃省采集的蜱体内分离到B.burgdorferi病原也已得到证实[11]。本研究首次从黑龙江尚志市采集的革蜱体内检测到B.burgdorferi,而吉林省珲春市革蜱的检测结果比黄海楠等报道的用RFLP法检测的革蜱的感染率低[12],造成这种差异的原因可能与采集地地理区域的差异、检测样本的数量和该蜱本身的自然感染率的高低有关。扇头蜱在莱姆病传播中的媒介作用目前未见报道,本研究首次从扇头蜱体内检测到B.burgdorferi,并认为可能该蜱属是莱姆病潜在的传播媒介,其媒介地位需进一步证实。我国蜱的种类较多,已证实有30种蜱具有医学重要性,对人畜的攻击性强,作为莱姆病媒介的可能性较大,并且存在着较大的地区差异。研究证实在我国北方林区全沟硬蜱为优势种,河南、山东等地长角血蜱为优势种,南方林区为二棘血蜱和粒形硬蜱传播本病[13-14]。
本研究建立的PCR方法具有较高的特异性和敏感性。对来自于牛羊体表的蜱体内B.burgdorferi感染情况的调查结果表明,该方法适应于评估B.burgdorferi在这些地区的感染状况,确定其对人畜可能造成感染的潜在威胁的高风险区,从而有助于控制莱姆病的传播与流行,减少经济损失,为我国莱姆病的防治提供诊断方法。
[1]Steere A C.Lyme disease[J].N Engl J Med,1989,321(9):586-596.
[2]Maria E,Aguero-Rosenfeld,Wang Gui qing,et al.Diagnosis of Lyme Borreliosis[J].Clin M icrobiol Rev,2005,18(3):484-509.
[3]王定明,郝琴,蔡星和,等.贵州省莱姆病螺旋体的基因分型研究[J].中华流行病学杂志,2003,24(12):1129-1131.
[4]Burgdorfer W,Barbour A G,Hayes S F,et al.Lyme Disease,a tick-borne spirochetosis?[J].Science,1982,216(4552):1317-1319.
[5]张哲夫,张金声,朱桂凤,等.我国东北林区莱姆病的调查[J].中华流行病学杂志,1989,10(5):261-264.
[6]Isabelle D,Abdelouahid B M,Myriam de K,et al.Simultaneous presence of different Borrelia burgdorferi genospecies in biological fluids of Lyme disease patients[J].J clin M icrobiol,1995,33(3):602-608.
[7]李建民,曹务春,张习坦,等.用聚合酶链方法对北京林区莱姆病疫源地及莱姆病病原体基因型的探索性研究[J].中华流行病学杂,2002,23(3):209-212.
[8]Vlad V,Peter H,Dieter R G L,et al.Heterogeneity of Borrelia burgdorferi sensu lato demonstrated by an ospA-type-specific PCR in synovial fluid from patientsw ith Lyme arthritis[J].Med M icrobiol Immunol,1998,187(2):97-102.
[9]李新军.莱姆病的实验室诊断技术研究进展[J].国外医学(流行病学传染册),1998,25(6):272-275.
[10]何汉江,黄晓敏.湘南微小¨牛蜱携带莱姆病螺旋体的调查[J].中国媒介生物学及控制杂志,2003,14(4):303.
[11]孙毅,许荣满,张泮河,等.我国一些常见蜱种莱姆病螺旋体的分离与鉴定[J].寄生虫与医学昆虫学报,2002,9(2):114-119.
[12]黄海楠,丁壮,何静,等.吉林林区动物莱姆病螺旋体感染的调查研究[J].中国人兽共患病学报,2006,22(8):785-788.
[13]刘国平,任清明,贺顺喜,等.我国东北三省蜱类的分布及医学重要性[J].中华卫生杀虫药械,2008,14(1):39-42.
[14]万康林,张哲夫,张金声,等.中国20个省、区、市动物莱姆病初步调查研究[J].中国媒介生物学及控制杂志,1998,9(5):366-369.
