小麦籽粒多酚氧化酶活性变化研究
2010-09-10高贵珍曹稳根马传喜
陈 军,高贵珍,曹稳根,马传喜
(1.宿州学院化学与生命科学系,安徽宿州234000;2.安徽农业大学农学院,安徽合肥230036)
小麦生产在我国国民经济中占有重要地位,其中面制食品是我国人民的主食之一。而在面制食品的加工和储藏过程中经常会出现褐变现象。有不少研究表明,小麦中多酚氧化酶(Polyphenol Oxidase,PPO)是影响褐变的主要原因[1~3]。
PPO是一类广泛分布于植物体内能催化多酚类氧化成醌类的质体金属酶,它的底物(酚类物质)存在于液泡中,且这种酶与底物的区域分布使得PPO在完整细胞内的生理功能难以确定。生物体内的PPO分布是不均匀的,具有时间和空间特异性。在小麦中,从幼苗到植株以及成熟籽粒中都含有多酚氧化酶,但种类及活性有所差异。一些研究表明,小麦籽粒中的PPO主要存在于麸皮层中,面粉中PPO活性随着出粉率的增加而提高[4],且不同小麦类型和品种间PPO均有一定差异;对同一品种而言,发育成熟的大籽粒PPO高于发育不完全的小籽粒。硬粒小麦多酚氧化酶活性最低,普通白粒小麦多酚氧化酶活性低于硬红冬、硬红春及软红冬小麦,但是硬红冬和软红冬小麦、硬红冬和硬红春小麦间多酚氧化酶活性差异较小[5]。大量研究表明,成熟籽粒PPO主要存在于种皮中,胚中无PPO[6,7],但小麦籽粒发育及萌发过程中PPO动态性的变化规律还不是很清楚。
本研究选取不同类型小麦品种,对籽粒发育及萌发过程中PPO活性进行研究,以期找出小麦籽粒PPO活性变化规律,为小麦PPO遗传改良提供理论依据。
1 材料和方法
1.1 试验材料
发育期供试材料为:安农95081-8、安农95083-6-1、安农 0309、郑麦 9023、安农 9267 和烟农19 6个品种,于2006—2007年种植于安徽农业大学试验田。
萌发期供试材料为:宿麦553、徐麦856、皖麦 50、皖麦 52、烟农 19、邯 6172、连麦 2号 7个品种,于2007—2008年种植于宿州市农科所试验田。
以上材料均采用小区撒播种植,田间管理与大田一致。
1.2 试验方法
1.2.1 样品处理
1.2.1.1 发育期籽粒的处理 各品种在盛花期选取同时开花且大小一致的200穗挂牌标记。4月28日第1次取样,每品种分别取15穗放于冷冻冰箱(-70℃)中待测。以后每隔5 d取样1次,直至成熟收获。
1.2.1.2 萌发期籽粒的处理 (1)每个品种称取相同质量的籽粒21份,每份1.000 g。(2)将上述样品浸于一个培养皿里,于25℃、空气湿度95%的人工可编程气候箱内培养,且要定时翻动籽粒。(3)萌发期分 7 个阶段取样,即 0,12,24,36,48,60,72 h(每隔 12 h取样1次)。将培养好的小麦籽粒冰浴研碎备用。
1.2.2 PPO活性检测方法
1.2.2.1 发育期籽粒PPO活性检测 参照Anderson[8]和Morris[9]的方法。未成熟籽粒(干质量为0.300 0 g)放于研钵中冰浴研碎后转入50 mL小烧杯中;成熟籽粒用瑞典产旋风磨制备全麦粉(过0.5 mm筛)。称取0.300 0 g全麦粉放入50 mL小烧杯中,加入7.5 mL反应试剂(50 mmol/L,pH=6.5的MOPS缓冲液;10 mmol/L L-DOPA,左旋多巴作为PPO反应底物),恒温水浴振荡器上振荡5 min(振荡器速度设为100 r/min,温度设为37℃),样品充分暴露在空气中,之后迅速将反应后的样品放在冰块上终止反应(1 min),并迅速混匀样品,用中速定量滤纸进行过滤。以反应试剂(空白L-DOPA/MOPS,左旋多巴与MOPS的混合液)为对照,在475 nm下测定滤液的吸光度ΔA(ΔA为5 min内吸光值的变化),每克籽粒每分钟吸光值上升0.001定义为一个酶活单位(单位AU,absorbance unit)。PPO的活性表示为ΔA×103AU/(min·g)。
1.2.2.2 萌发期籽粒PPO活性检测 在比色皿中依次加入2.8 mL磷酸缓冲液,1 mL 0.1 mol/L邻苯二酚。用移液管加入0.3 mL粗酶液,混匀,迅速放入37℃水浴锅中,水浴5 min后测OD420。每克籽粒每分钟吸光值上升0.001定义为一个酶活单位(单位 AU,absorbance unit)。PPO的活性表示为ΔA×103AU/(min·g)。
1.3 数据分析
运用Excel和SAS统计分析程序对数据进行分析处理。
2 结果与分析
2.1 PPO活性变异方差分析
由表1可知,基因型与发育时期互作PPO活性变异的方差分析中,籽粒发育的不同阶段PPO活性差异极显著,不同基因型和基因型与发育时期互作PPO活性差异都不显著。因此,基因型对籽粒发育过程中PPO活性不具有显著影响,基因型与发育时期互作对PPO活性也不具有显著影响,而籽粒发育的不同阶段对PPO活性有显著影响,且发育时期间的PPO活性差异远大于品种间的差异。这表明籽粒发育的不同时期是影响PPO活性的主要因素。
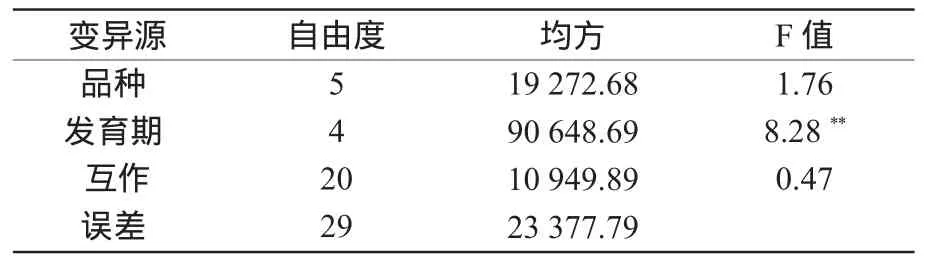
表1 基因型与发育时期互作PPO活性变异的方差分析
从不同品种与萌发期互作PPO活性变异方差分析(表2)可看出,品种间PPO活性差异极显著,不同萌发阶段PPO活性差异也达到极显著水平,而品种与萌发期互作PPO活性差异不显著。这表明在小麦籽粒萌发过程中,品种和萌发期对PPO活性都有显著影响。
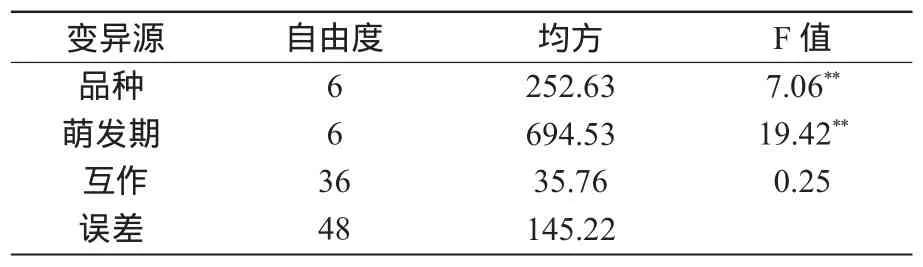
表2 基因型与萌发期互作PPO活性变异方差分析
2.2 PPO活性的变化
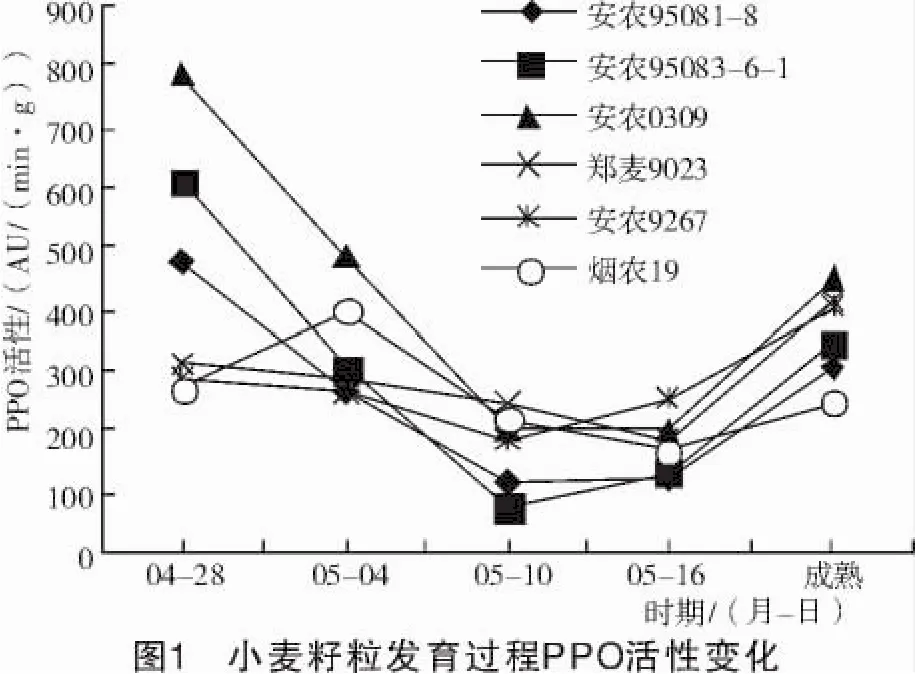
图1结果表明,籽粒发育过程PPO活性变化大致趋势是先降低后升高,但品种间变化幅度不同。安农95083-6-1和安农0309 2个品种开始时PPO活性较高然后大幅度下降,下降后又渐渐升高;安农95081-8、安农9267、烟农19和郑麦9023这4个品种PPO活性的变化趋势较为平缓。
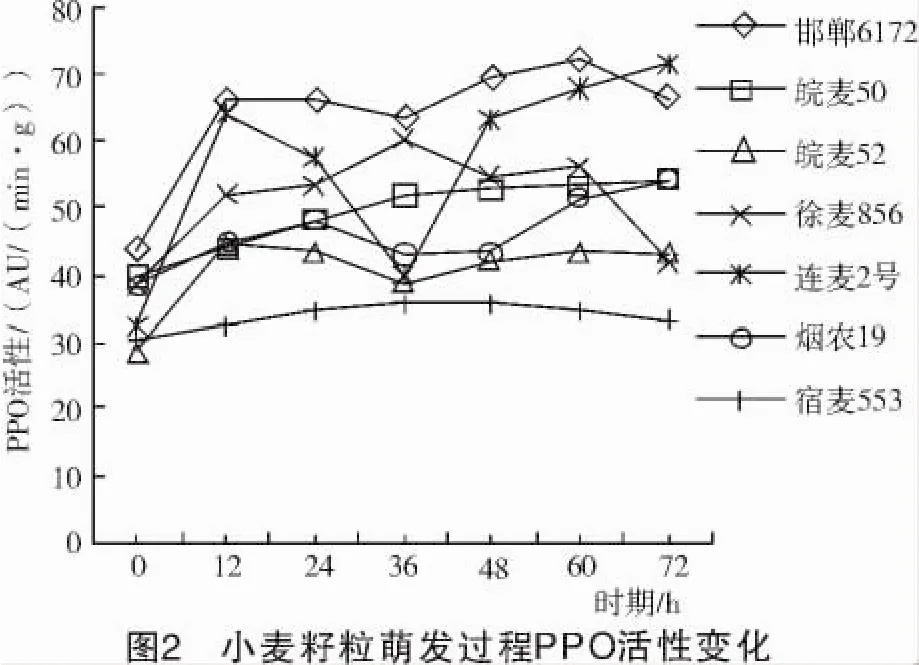
由图2可知,各品种PPO活性的变化趋势和幅度不尽相同,宿麦553变化幅度较小,其余6个品种变化幅度较大;徐麦856 PPO活性变化呈先升高后降低的趋势;连麦2号、邯郸6172、皖麦52 3个品种PPO活性呈升高后降低接着再升高又降低的变化。这说明小麦籽粒萌发过程中PPO活性是不稳定的,但小麦籽粒萌发过程中成熟干籽粒(0 h)PPO活性最低。
3 结论与讨论
小麦籽粒发育及萌发过程中PPO活性呈动态变化趋势,存在着极其复杂的表达调控机制。通过对不同品种PPO活性的研究,不同发育期间的PPO活性差异远大于品种间的差异,籽粒发育过程中不同品种的不同发育时期间PPO活性变异水平不同,其PPO活性变化是开始时较高然后降低接着又升高,不同品种间这种变化幅度不同,一些品种变化幅度较大;萌发过程中PPO活性也是不稳定的,各品种PPO活性的变化趋势和幅度不尽相同,在小麦籽粒萌发过程中品种和萌发期对PPO活性都有显著影响。现已知道PPO是一种质体酶,存在于叶绿体、白色体等质体中,生理状态下与底物严格隔离[10],但在小麦籽粒萌发过程中,PPO易于释放进而与底物接触,这可能会导致萌发过程PPO活性较高。
一些研究发现,在植物组织或器官中,幼嫩部位的PPO活性较高,而成熟或衰老部位的PPO活性低,但PPO的生理功能还不清楚[11,12]。由于PPO主要位于正常细胞的质体中,其作为氧化还原酶被认为与呼吸链末端电子传递有关,能消除氧自由基的伤害与催化植物或动物的色素形成[13,14]。小麦植株PPO活性因感染病虫而升高,因此PPO可能与植物自身防御功能有关,但缺乏直接的证据。此外,PPO与植物的生长发育可能有关,可促进乙烯的代谢。因此,本研究所得结果的原因可能有2个方面:一是籽粒本身抗性的需要,二是不同品种的小麦表达PPO的水平不同。
大量研究表明,PPO与植物抗病性密切相关,PPO活性升高是小麦抵抗病原侵入和扩展的一种保护反应。然而面制食品需要的是低PPO活性的小麦,以减轻面制食品的褐变,因而,在选育品种时,应选择籽粒发育期PPO活性高成熟后PPO活性低的品种。至于小麦籽粒发育和萌发期PPO活性变化是否存在内在关系,这还有待于进一步研究。但本研究得出的籽粒发育的不同时期是影响PPO活性的主要因素,籽粒萌发过程中品种和萌发期对PPO活性都有显著影响,这一结论可为小麦品质改良提供重要信息。
[1] Baik BK,Czuchajowska Z,Pomeranz Y.Discoloration of dough for oriental noodles[J].Cereal Chemistry,1995,72:198-205.
[2] Bhattacharya M,Luo Q,Corke H.Time-dependent changes in dough color in hexaploid wheat landraces differingin polyphenol oxidase activity[J].Journal of Agricultural and Food Chemistry,1999,47(9):3579-3585.
[3] Feillet P,Autran J C,Verniere C L.Pasta brownness:an assessment[J].Journal of Cereal Science,2000,32:215-233.
[4] Hatcher DW,Kruger JE.Distribution of polyphenoloxidases in flour mill streams of Canadian common wheat classes milled to threeextraction rates[J].Cereal Chemistry,1993,70:51.
[5] Lamkin WM,Miller BS,Nelson SW,et al.Polyphenol oxidase activities of hard red winter,soft red winter,hard red spring,white common,club and durum wheat cultivars [J].Cereal Chemistry,1981,58(1):27-31.
[6] Kruger JE.Changesin thepolyphenol oxidases of wheat during kernel growth and maturation[J].Cereal Chem,1976,53(2):201-213.
[7] Taneja SR,Abrol Y P,Sachar RC.Modulation of o-diphenolase and monophenolase enzymes during wheat grain development[J].Cereal Chemistry,1974,51(2):457-465.
[8] Anderson JV,Morris CF.An improved whole-seed assay for screening wheat germplasm for polyphenol oxidase activity[J].Crop Science,2001,41:1697-1705.
[9] Morris CF,Anderson JV.Distribution of PPOactivity amonga large number of hexaploid wheat genotypes using an improved L-DOPA assay[J].Cereal Foods World,1998,43:518-520.
[10] W J,Shelton D R,Martin T J,et al.Variation in polyphenol Oxidase Activite and Quality Characteristic Among Hard White and Hard Winter Wheat Sample[J].Cereal Chem,1997,74(1):7-11.
[11] 金善宝.中国小麦学[M].北京:中国农业出版社,1996.
[12] 盖均益.作物栽培学 [M].北京:中国农业出版社,1994:98-123.
[13] 薛俊杰,王永琳,张淑改,等.泡桐丛枝病过氧化物酶和多酚氧化酶的研究[J].山西农业科学,2000,28(1):62-64.
[14] 云兴福,崔世茂,霍秀文.黄瓜组织中几种酶活性与其对双霉病抗性的关系[J].华北农学报,1995,10(1):92-98.
