以二氧化硅为硅源制备纯硅的方法
2010-09-08李勇辉明大增李志祥王智娟杜璐杉
李勇辉明大增李志祥王智娟杜璐杉
(1.云南云天化国际化工股份有限公司,昆明 650113;2.昆明理工大学化学工程学院,昆明 650224;3.曲靖师范学院化学化工学院,云南 曲靖 655011)
以二氧化硅为硅源制备纯硅的方法
李勇辉1,2明大增1李志祥1王智娟3杜璐杉1,2
(1.云南云天化国际化工股份有限公司,昆明 650113;2.昆明理工大学化学工程学院,昆明 650224;3.曲靖师范学院化学化工学院,云南 曲靖 655011)
介绍了纯硅材料的类型及其主要用途,叙述了国内外以二氧化硅为硅源,热还原法(包括金属、非金属和耦合热还原法)、熔盐电解法(包括氟化物、氯化物和耦合熔盐电解法)等制备纯硅的方法,评叙了各种方法的优缺点。指出氯化钙熔盐电解法工艺简单、产品纯度高、能耗小、成本低、经济效益好、环境友好、市场潜力与前景较好。
硅;二氧化硅;制备方法;熔盐电解法;评价
硅(Si)材料是微电子工业和太阳能发电的基础材料,随着光伏产业的迅速发展,纯硅的需求量急剧增加。按照晶型,纯硅可分为无定形硅和晶体硅。无定形硅(α-Si)又称非晶硅,主要用于提炼纯硅,制造太阳电池、薄膜晶体管、复印鼓和光电传感器等;晶体硅包括单晶硅和多晶硅,单晶硅主要用于制作集成电路、半导体分立器件和光伏太阳能电池,多晶硅是生产单晶硅的直接原料,是当代人工智能、自动控制、信息处理、光电转换等半导体器件的电子信息基础材料。按照纯度,可分为工业硅(也称金属硅、冶金级硅、化学级硅)、太阳能级硅、电子级硅和超纯硅等。其中,工业硅的纯度一般为98.70%~99.60%;目前超纯硅可达到11N以上。
制备纯硅的方法较多,其硅源多为二氧化硅、氟硅酸盐、卤硅烷及其衍生物等。硅在自然界分布极广,地壳中质量分数约为25.8%,主要以二氧化硅和硅酸盐的形式存在[1]。因此,工业上通常以硅石(其主要成分为二氧化硅)而制得工业硅,如需得到高纯度的硅,则需要进行进一步的提纯(精制)处理。目前,以二氧化硅为硅源制备纯硅的方法主要有热还原法和熔盐电解法等。其中,依据还原剂的不同,热还原法又可分为金属热还原法和非金属热还原法等;依据共晶熔盐的不同,熔盐电解法可分为氟化物电解法、氯化物电解法等。
1 热还原法
1.1 金属热还原法
在实验室中,可将金属镁与二氧化硅的微细粉末混合加热而制得纯硅,其主要反应式[2]:

反应得到一种多孔的块状物体,用盐酸来处理,将氧化镁转化为氯化镁:
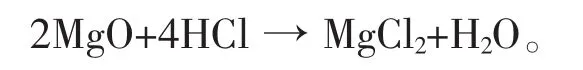
洗涤、过滤分离后,滤渣(不溶于盐酸的固态物)即是硅和未反应完全的二氧化硅。用氢氟酸处理此滤渣,氢氟酸与二氧化硅起作用形成四氟化硅与水:
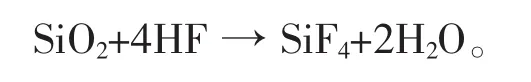
四氟化硅是无色的气体,很易挥发,剩下的暗褐色的残渣即是无定形硅。
另外,用铝、锌还原二氧化硅也可制得无定形硅,其原理与镁热还原二氧化硅基本相同。德国Heliotronic/Wacker公司引入CaO-SiO2液相助熔剂,在1 600~1 700℃下进行铝热还原石英砂[3]:

CaO-SiO2液相助熔剂既可以溶解副产物氧化铝,又可作为液-液萃取介质,助熔剂与硅不互熔,从而可将硅分离开来。
该方法多用于实验室,其成本主要取决于原料成本,而镁、铝、锌金属粉的价格较高,资源能效较低,经济效益不明显,故难以实现工业化。
1.2 非金属热还原法
工业上,以含SiO2的矿物(硅石或石英等)为原料,以碳质物(木炭、石油焦、煤等)为还原剂,在矿热炉内熔炼制得工业硅,通常称为碳热还原法或电热法[4]。 复杂 Si—O—C 体系由 Si、O、C 这 3种元素构成, 主要存在 SiO2、SiO、Si、SiC、C、CO 等 6 种物质,副反应较多,主要反应式为[5]:
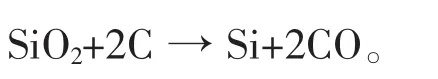
生产的工艺过程都可大体分为原料准备、配料、熔炼、出炉铸锭、产品破碎包装、回收硅灰等几个部分,工艺流程如图1。
该方法多用于工业生产,工艺相对成熟,原料易得且成本较低,产品纯度较高,通常硅的质量分数可达到97.00%~99.00%,但能耗较大,属高能耗产业。
20世纪70年代起,德国Simens、挪威Elkem、Sintef等公司分别改良碳热还原法,研究采用高纯C还原高纯SiO2制备太阳能级硅[3,6]。
另外,以氢气为还原剂、热还原二氧化硅制得纯硅,称为氢热还原法。马文会等在石英光纤废料的综合利用方面采用氢热还原法制得纯硅[7-8]。复杂Si—O—H体系由Si、O、H这3种元素构成,主要存在SiO2、SiO、Si、O2、H2O、H2等 6 种物质, 副反应较多,主要反应式[5]:
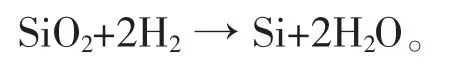
与碳热还原法相比,该方法没有中间产物SiC的生成,硅的收率较高;采用氢气作还原剂,氧化产物清洁无污染,环境效益较好;可以直接制备高纯太阳能级硅,不需要纯化过程,生产成本较低,市场潜力较好。
1.3 耦合热还原法
所谓耦合热还原法,即采用2种及以上的不同还原剂(金属或非金属)在高温条件下还原二氧化硅制得纯硅的方法,多为金属、非金属的耦合。
最初,工业硅不是采用碳热还原法,而是采用碳化钙热还原法生产的,即由硅石与碳化钙(CaC2)混合物在电炉中加以煅烧制得纯硅,主要反应式[9-10]:
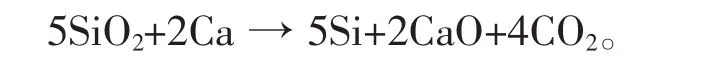
碳化钙热还原法其实质为碳、钙耦合热还原法,其主要反应式可分解为:
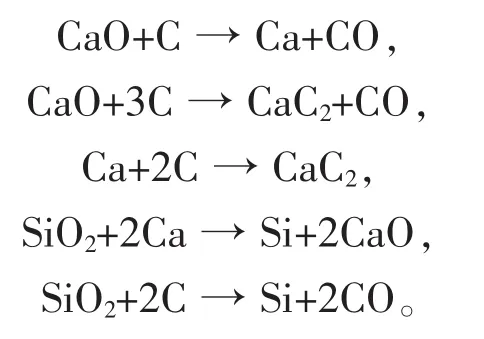
20世纪初碳热还原法发明后,该方法就逐渐被淘汰了,原因在于电石的化学性质非常活泼,不易保存,增加了原料存放成本,与碳热还原法相比,生产成本较高,经济效益较低。
此外,还有铝热法,即由硫、硅石、金属铝的混合物在电炉中加以煅烧制得纯硅,主要反应式[9-10]:

与金属热还原法相比,该方法反应温度较低,能耗较低,但是,副产物二氧化硫属有毒气体,需作吸收处理,增加了副产物处理成本,与碳热还原法相比,环保压力较大,经济效益较低。
2 熔盐电解法
2.1 氟化物电解法
碱金属氟化物常用作电解沉积的溶剂,其优点在于不吸潮,可以直接溶解氧化物。D Elwell等研究了NaF或KF与BaF2或CaF2或MgF2的共晶熔盐,实验发现在Na3AlF6体系、NaF-CaF2二元系、KFCaF2二元系、LiF-NaF-KF(FLINAK)三元系共晶熔盐中电解SiO2制得纯硅是可行的[11-12]。
与热还原法相比,该方法工艺流程简单、投资成本低、操作成本低、环境友好,不足之处在于氟化物熔点较高,腐蚀性较强,严重限制了电极材料与电解槽材质的选择。
2.2 氯化物电解法
氯化物也可用作电解沉积的溶剂,与氟化物相比,优点在于操作温度低,电极材料与电解槽材质的范围较广;不足之处在于氯化物极易潮解,操作条件相对严格。2003年Toshiyuki Nohira等采用CaCl2为熔盐体系,由SiO2直接电解制得纯硅。后来该研究小组对新工艺开展了深入、系统的研究,对该方法的可行性、机理、影响因素等方面进行了进一步的研究和论证[13-17]。
电解前SiO2中硅原子与氧原子以Si—O键结合,电解时Si—O键断裂,氧原子脱出,形成热力学稳定性较弱的Si自由键,迅速与临近的Si原子以Si—Si键形式结合生成非晶体硅,在电解设定高温下,非晶体硅发生晶形转变,重排形成晶体硅。其电极反应为:
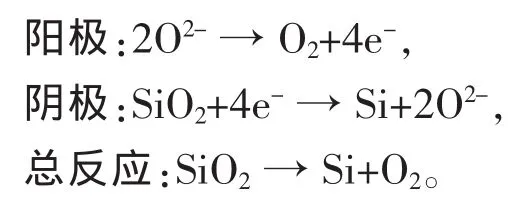
实验发现,以石墨为阳极,采用特制阴极,将高纯SiO2置于2个单晶硅板中,并用钼丝绑紧,电解时钼丝不浸入电解质中,以避免污染产品,在温度为1 123 K、分解电压为1.25 V的条件下,采用CaCl2为熔盐体系,能够由SiO2直接电解制得纯硅。其工艺如图2。
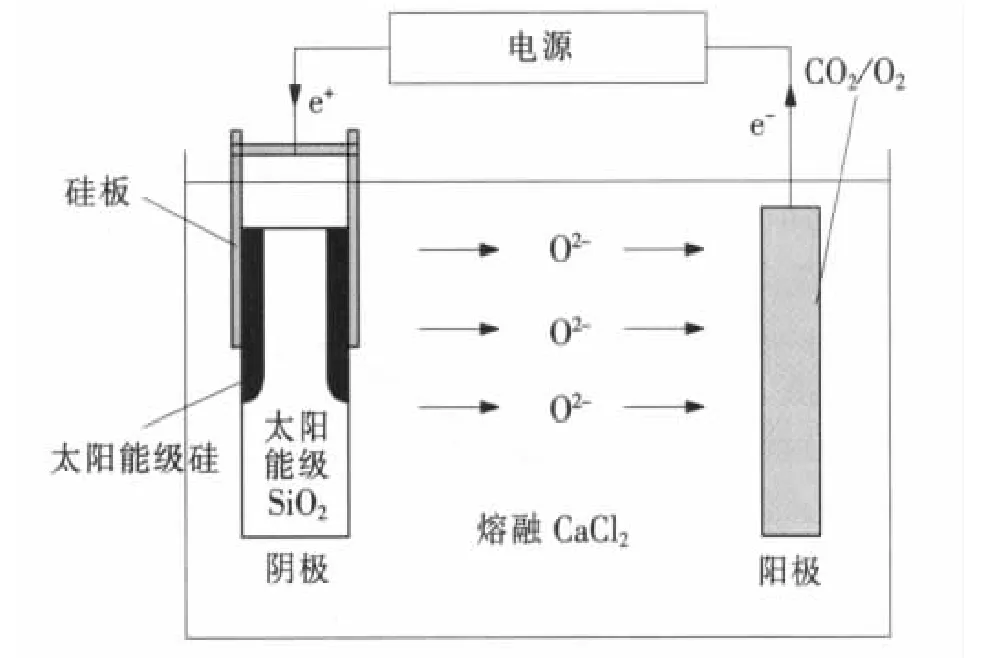
图2 CaCl2熔盐体系直接电解固体SiO2制备纯硅Fig 2 Diagram for Direct Electrolytic Reduction of Solid SiO2to Si in molten CaCl2
电解后,将阴极置于1 772 K下进行真空处理,利用熔点差别,使沉积的Si与未电解的SiO2分离,所得Si的纯度约为99.80%。
2005年Kouji Yasuda等在CaCl2熔盐电解的基础上,又采用LiCl-KCl-CaCl2熔盐体系,直接电解SiO2制得纯硅[18]。与CaCl2熔盐电解相比,LiCl-KCl-CaCl2熔盐电解最大的特点就是电解温度、分解电压大幅度降低(温度降至773 K、分解电压降至0.5 V),电解温度能耗更小;所得产品为无定形硅、微晶硅,粒度小于50 nm。
O E Kongstein等采用NaCl-CaCl2-CaO熔盐体系,直接电解SiO2制得纯硅[19]。与CaCl2熔盐电解相比,NaCl-CaCl2-CaO熔盐电解最大的特点是分解电压大幅度降低(温度仍为1 123 K,分解电压降至0.2 V),能耗更小。
该方法工艺简单、生产效率高、产品纯度高、成本低、能耗小、经济效益好、环境友好、潜力大、前景好,因此,引起各国学术界和工业界的普遍关注。
马文会等以废弃的石英光纤废料为原料,以CaCl2熔盐电解法为主体技术,制备了太阳能级硅[20-22]。将干燥的分析纯CaCl2置于反应器中的石墨坩埚内,在氩气气氛下升温到反应所需温度并在该温度下保持2 h,使CaCl2成熔融态并除去无水CaCl2中残留的结晶水和自由水;选用坩埚炉作为试验加热装置;在废弃的光纤预制棒上缠绕几十圈的钼丝(纯度在99%以上),然后与外接直流稳压电源连接好,铜丝为导线;把制作好的电极插入熔融盐内,通电反应1 h,即可得到太阳能级硅。
廖勇等在熔盐电解法的基础上直接采用二氧化硅粉体为原料进行了电解实验的尝试,并对阴极连接方式这一关键环节进行了改进,首次在熔盐电脱氧制备多晶硅的实验中引入了“液态阴极”方法。具体做法是直接使用SiO2粉体进行电解,在其上层铺置1层金属颗粒,从而保证颗粒间的导电性[23-24]。
陈政等采用二氧化硅粉体为原料的电解实验也获得了成功,将二氧化硅粉末压制在电极上,以二氧化硅作为阴极,插入熔融CaCl2电解液中;以石墨棒为阳极,以钨丝连接电极形成回路,氩气作保护气体,电解温度为850℃,电解电压为2.8 V,电解4 h。电解中新生硅可以作为导体,使Si-SiO2-CaCl2界面得以保留,反应得以继续,电解得到纯硅。实验证明,通过熔盐电解还原可将二氧化硅粉末直接电解还原得到硅粉,反应试样生成的硅粉厚度达到了0.5 mm[25-26]。
2.3 耦合熔盐电解法
所谓耦合熔盐电解法,即采用2种及以上不同熔盐(氟化物、氯化物)的共晶熔盐体系,电解二氧化硅制得纯硅的方法。
李运刚等在KCl-NaCl-NaF-SiO2熔盐体系中,以铂丝为参比电极、研究电极,高纯石墨坩埚为辅助电极,电解制得纯硅[27-28]。实验发现,在KCl-NaCl-NaF熔盐体系中,溶解的SiO2以Na2SiF6形式存在,即在熔盐中硅以Si4+存在;硅离子的还原为扩散控制的不可逆电极过程,还原过程为:
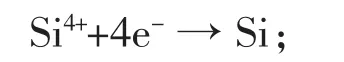
实验温度下Si4+的扩散系数D为1.33×10-3cm2/s(c(Si4+)=0.121 mmol/mL,T=1 073 K)。
该方法采用的硅源虽为二氧化硅,但实质是电解Na2SiF6制备纯硅的过程,电解与电解氟硅酸盐(Na2SiF6和K2SiF6等)制备纯硅的原理相同。与氟化物、氟化物电解法相比,其溶解机理不同,发生了化学反应:

即溶解的SiO2以Na2SiF6形式存在;电解原理不同,阴极反应为:
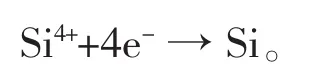
该方法流程简单,投资成本低,操作成本低,环境友好,但同样存在氟化物熔盐电解的缺点,即腐蚀性较强,严重限制了电极材料与电解槽材质的选择;不同之处在于,KCl-NaCl-NaF形成共晶熔盐,熔点有所降低,能耗较小。
此外,也有BaO-BaF2、CaCl2-CaO等熔盐体系中电解SiO2的方法相关研究报道[6]。
3 总结与建议
硅材料作为微电子工业和太阳能发电的基础材料,随着光伏产业的迅速发展,纯硅的需求量急剧增加。然而,目前生产纯硅的方法虽然技术成熟,但成本过高且降低潜能不大。因此,为了满足微电子、太阳能电池工业等的发展需求,必须在发展超纯硅的同时,降低成本,研究和开发生产廉价纯硅的新技术。
自然界以二氧化硅为主要成分的矿物储量丰富,科学合理地开发利用硅质矿产资源生产廉价纯硅是高新科技的发展要求;稻壳、粉煤灰、煤矸石等农业、工业生产废料排量巨大,且二氧化硅含量较高,如能将废料中二氧化硅转化为纯硅,既可使企业带来丰厚的环境效益及经济效益,也可产生明显的社会效益;虽然熔盐电解法尚处于实验室探索研究阶段,生产能力不大,无法实现连续化工业生产,但是,与热还原法相比,熔盐电解法(尤其是氯化钙熔盐电解法)具有工艺简单、生产效率高、产品纯度高、成本低、能耗小、经济效益好、环境友好等优势,充分开发与利用熔盐电解法制备纯硅将是未来硅材料行业的发展方向。
因此,今后应加大纯硅生产新技术的研究力度与深度,积极广泛地开发低成本、高纯度的硅材料,向产业链的横向和纵深发展,以有限的资源,获得最大的经济利益,是我们今后发展与努力的方向。
[1]何允平,王恩慧.工业硅生产[M].北京:冶金工业出版社,1996.
[2]Dr Oleg,S Fishman.Solar Silicon[J].Advanced Materials&Processes,2008(9):39-40.
[3]于站良,马文会,戴永年,等.太阳能级硅制备新工艺研究进展[J].轻金属,2006(3):43-47.
[4]《实用工业硅技术》编写组.实用工业硅技术[M].北京:化学工业出版社,2005.
[5]陈肇友.化学热力学与耐火材料[M].北京:冶金工业出版社,2005.
[6]龙桂花,吴彬,韩松,等.太阳能级多晶硅生产技术发展现状及展望[J].中国有色金属学报,2008,18(专辑1):386-392.
[7]马文会,杨斌,王华,等.从石英光纤废料中制备硅新工艺的实验研究[J].中国稀土学报,2004(增刊1):607-610.
[8]Ma Wenhui,Masaru Ogura,Takeshi Kobayashi,et al.Thermodynamicanalysisandexperimentalstudyonpreparation of solar grade silicon using hydrogen as reductant[C].Proceedings of JSES/JWEA Joint Conference,2003:361-364.
[9]К С叶夫斯特罗比耶夫,Н А托罗波夫.硅化学与硅酸盐物理化学:下册[M].汪仲钧,译.北京:高等教育出版社,1957.
[10]Г И柯留考夫斯基,Л А马奴伊诺夫.物理化学及硅化学[M].汪德熙,译.北京:中国工业出版社,1961.
[11]D Elwell.Electrowinning of silicon from solutions of silica in alkali metal fluoride/alkaline earth fluoride eutectics[J].Solar Energy Materials,1981,5(2):205-210.
[12]RBoen,JBoteillon.Theelectrodepositionofsiliconinfluoride melts[J].Journal of Applied Electrochemistry,1983,13 (3):277-288.
[13]Toshiyuki Nohira,Kouji Yasuda,Yasuhiko Ito.Pinpoint and bulk electrochemical reduction of insulating silicon dioxide to silicon[J].Nature Mater,2003(2):397.
[14]Kouji Yasuda,Toshiyuki Nohira,Yasuhiko Ito.Effect of electrolysis potential on reduction of solid silicon dioxide in molten CaCl2[J].Journal of Physics and Chemistry of Solids,2005,66(2/4):443-447.
[15]Kouji Yasuda,Toshiyuki Nohira,Koji Amezawa,et al.Mechanism of Direct Electrolytic Reduction of Solid SiO2to Si in Molten CaCl2[J].Journal Of The Electrochemical Society,2005,152(4):69-74.
[16]Kouji Yasuda,Toshiyuki Nohira,Rika Hagiwara,et al.DiagrammaticRepresentationofDirectElectrolyticReduction of SiO2in Molten CaCl2[J].Journal Of The Electrochemical Society,2007,154(7):95-101.
[17]Kouji Yasuda,Toshiyuki Nohira,Rika Hagiwara,et al.Direct electrolytic reduction of solid SiO2in molten CaCl2for the production of solar grade silicon[J].Electrochimica Acta,2007,53(1):106-110.
[18]Kouji Yasuda,Toshiyuki Nohira,Yukio H Ogata,et al.Direct Electrolytic Reduction of Solid Silicon Dioxide in Molten LiCl-KCl-CaCl2at 773 K[J].Journal Of The Electrochemical Society,2005,152(11):208-212.
[19]O E Kongstein,S Sultana,G M Haarberg.Electrorefining of Silicon in Molten Calcium Chloride[C].ECS 210th Meeting,2006,3(35):357-361.
[20]Liu Yike,Ma Wenhui,Yang Bin,et al.Investigation of Direct Electrolytic Reduction of Solid SiO2to Siwith High Purity[J].Acta Scientiarum Naturalium Universitatis Sunyatseni,2007,46:333-334.
[21]刘仪柯,马文会,戴永年,等.融盐电解法直接制备太阳能级硅新工艺的探讨[J].有色金属:冶炼部分,2008(2):31-33.
[22]刘仪柯.低温熔盐电解石英光纤废料制备太阳能级硅的研究[D].昆明:昆明理工大学,2008.
[23]栗晓,张胜涛,廖勇,等.太阳能级硅制备工艺的研究进展[J].材料导报网刊,2009,4(3):19-21.
[24]廖勇,张胜涛,白晨光,等.熔盐电脱氧制多晶硅过程电流效率的影响因素[J].材料导报,2009,23(8):81-83.
[25]Jin Xianbo,Gao Pei,Wang Dihua,et al.Electro-chemical preparation of silicon and its alloys from solid oxides in molten calcium chloride[J].Angewandte Chemie International Edition,2004,43(6):733-736.
[26]Xiao Wei,Jin Xianbo,Deng Yuan,et al.Rationalisation and optimisation of solid state electro-reduction of SiO2to Si in molten CaCl2in accordance with dynamic threephase interlines based voltammetry[J]. Journal of Electroanalytical Chemistry,2010,639(1/2):130-140.
[27]何小凤,李运刚,田薇,等.SiO2在KCl-NaCl-NaF体系中的溶解度及溶解机理[J].中国有色金属学报,2008,18(5):929-933.
[28]何小凤,李运刚,李智慧.KCl-NaCl-NaF-SiO2熔盐体系中硅离子的还原机理研究[J].有色金属:冶炼部分,2010(2):24-26,41.
Preparation of Silicon from Silicon Dioxide
Li Yonghui,Ming Dazeng,Li Zhixiang,Wang Zhijuan,Du Lushan1,2
(1.Yunnan Yuntianhua International Chemical Co.,Ltd.,Kunming 650113;2.The Faculty of Chemical Engineering,Kunming University of Science and Technology,Kunming 650224;3.The College of Chemistry and Chemical Engineering,Qujing Normal University,Qujing,Yunan 655011)
The application and the types of silicon and its preparation ways both at home and abroad were introduced in the paper including the method of reduction and fused salt electrolysis process.Compared with other methods,direct electrolytic reduction of silicon dioxide in molten CaCl2had more advantages for high purity,low energy consumption,low cost,good economic returns,friendly to environment and had better market potential.
silicon;silicon dioxide;preparation;molten salt electrolysis;review
TQ127.2
A DOI10.3969/j.issn.1006-6829.2010.06.009
2010-09-20
