洞庭湖沉积物腐殖酸的配位性与酸碱性研究*
2010-09-06周崇文
曾 蕾,易 诚,周崇文,陈 科
(湖南环境生物学院,湖南衡阳421005)
洞庭湖沉积物腐殖酸的配位性与酸碱性研究*
曾 蕾,易 诚,周崇文,陈 科
(湖南环境生物学院,湖南衡阳421005)
通过电位滴定研究了从洞庭湖沉积物中分离得到的腐殖酸(HA)的酸碱性和配位性,采用修正格兰函数进行了数据拟合。表征了六类可滴官能团含量和分布,pKa数值在2.35~10.50之间,羧基占可电离中心总数的62%,利用铜离子选择电极和汞齐电极(Pb、Cd和Zn)研究了腐殖酸与Cu2+、Pb2+、Cd2+和Zn2+配位性质,借助Scatchard方法对数据进行了处理,显示铜和铅为二配体,镉和锌为单配体。平均稳定常数顺序为:logKHA-Pb>logKHA-Cd>logKHAtZn,配位能力顺序为:Pb>Cu>Cd≈Zn。
腐殖酸;酸碱滴定;配位能力;稳定常数
近三十年来,由于工业的快速发展,各种重金属离子通过河流、大气沉降和人为倾倒等方式大量涌入河流与湖泊,严重威胁到水生生物的生存。重金属离子在自然环境中的降解速度取决于重金属离子浓度、水体沉积物性质、可溶性无机盐类型、水生生物的组成以及水流情况等因素。水体沉积物在消除重金属离子影响过程中起着重要的作用。从沉积物构成来看,主要包括有机质、碳酸盐、铁锰氧化物水合物和硅铝酸盐。腐殖酸是一种结构和组成非常复杂的大分子有机物质,是自然界有机质的主要构成部分,这些物质通过动植物和微生物的降解在水体和陆地环境中形成。腐殖质根据结构和性质上的差异可分为:富里酸(Fulvic acid)、棕色胡敏酸(Brown hum ic acid)和灰色胡敏酸(Grey hum ic acid),三类腐殖酸结构上均含有大量可离解官能团,如羧基和酚羟基。这些基团具有较强的配位能力,能与许多重金属离子形成稳定的络合物。据文献报道,腐殖质对重金属离子的捕获容量很大,1克腐殖质往往能够与数克金属离子络合。腐殖质也能够与矿物质结合,形成一类配位能力和吸附能力更强的微球囊,因此,腐殖酸对重金属离子的捕获是消除重金属离子污染的主要途径[1-5]。
洞庭湖是我国四大淡水湖之一,几经岁月变迁,如今的水域面积已经不足其原来的二分之一。随着湖南工业化速度的加快,洞庭湖也日益受到重金属的污染,这些离子多来源于湘江及其支流。本文主要是研究洞庭湖淤泥中的腐殖酸对Pb2+、Cu2+、Zn2+、Cd2+的配位能力,从而为评估洞庭湖重金属离子的污染状况提供参考。
1 实验
1.1 装置与试剂
电位差计、酸度计和自动电位滴定仪。
A g/A gCl复合玻璃电极、A g/A gC参比电极和滴汞电极。
微量滴管、恒温循环水浴锅。
752N型紫外-可见光分光光度计、元素分析仪(C、H、N)
AA 320火焰原子吸收分光光度计。
所有的试剂均选用分析纯、实验用水为二重蒸馏水。
配备的标准溶液:Cu2+,Pb2+,Cd2+和Zn2+标准溶液;氢氧化钠标准溶液等。
1.2 样品采集与腐殖酸制备[6-7]
沉积物样品从位于洞庭湖湖区的益阳、岳阳两市八个乡镇三十余个点位采集(河口乡、双丰乡、团洲乡、磊石乡、岩汪湖镇、茶盘洲镇、麻塘乡和中洲乡),点位距湖岸50~500 m,采集后的样品封装在聚乙烯瓶中,保存温度为4~6°C。腐殖酸分离和提纯按照国际腐殖酸协会(H ISS)提出的标准方法操作:将样品混合,并在室温下风干5天,称取已干燥的沉积物样品1 kg,装入聚乙烯容器中,首先加入10L 0.1mol·L-1HCl,调节pH值至1~2之间。悬浮液在振荡器中摇动1小时,然后澄清12小时。上层清液丢弃,用1mol·L-1N aOH调节固体残留物pH值到7.0,为防止腐殖酸氧化,在氮气保护下,加入10L 0.1mol·L-1N aOH,容器中充入氮气后密封,水平摇动4小时,然后静置12小时。离心分离20m in,得到清液8 kg,固相丢弃。加入6 mol·L-1HCl溶液至pH=1.0,溶液中的腐殖质沉淀,放置15 h,液相丢弃,在氮保护气氛下,腐殖酸沉淀溶解在适量的0.1 mol·L-1KOH溶液中,通过添加KCl调节离子强度到0.3 mol·L-1,促使胶体凝结,通过离心作用与部分矿物质沉淀分离。调节溶液的pH到1.0,通过离心作用腐殖酸被分离的出来。保存在0.1mol·L-1HCl和0.3mol·L-1HF溶液中,放置12 h,促使硅石与硅酸盐溶解。最后,通过膜透析分离出腐殖酸,直至渗析袋外面的水溶液电导率不发生变化。悬浮液在容量瓶中稀释,并存储在4°C环境中,浓度约为3.96 g·L-1。
1.3 表观摩尔质量测定[8-9]
表观摩尔质量分布通过凝胶渗透色谱法测定,用Sephadex G-100作固定相、含1×10-3mol·L-1硼酸缓冲溶液(pH=9.20)的0.1 mol·L-1N aCl溶液作洗脱液。层析柱长90 cm、内径1.5 cm,用于分子量标定的球状蛋白质为:5.0 mg·mL-1牛白蛋白(66,000D),2.0 mg ·mL-1碳酸酐酶(29,000D),2.0 mg·mL-1细胞色素C(12,400D)、3.0 mg·mL-1抑肽酶(6,500D),用蓝葡聚糖2000检测柱子的空体积(V0)和满体积(V)·流动相流速恒定在0.718±0.006 mL·m in-1,在280 nm处测量光密率变化。按照与球蛋白质相同的冲洗条件,腐殖酸悬浮液(1 mg·mL-1)用含有1×10-3mol·L-1硼酸缓冲溶液和0.1 mol·L-1N aCl洗脱液冲洗。
1.4 酸碱滴定[9-10]
在滴定腐殖酸之前,用H+浓度代替活度校准玻璃电极,将腐殖酸悬浮在50.00mL离子强度为0.1 mol·L-1N aCl溶液中,腐殖酸含量约为1.105 g·L-1,用含相同N aCl浓度的0.100 mol·L-1N aOH标准溶液滴定。也可以将30mg腐殖酸悬浮在50.00mL离子强度为0.02 N aNO3溶液中,用相同离子强度的0.005 mol·L-1N aOH标准溶液滴定。
1.5 配位滴定法[11-12]
滴定操作和仪器校正在25.0±0.1°C环境下进行,离子强度为0.02mol·L-1N aNO3和pH为6.00±0.05。为了研究腐殖酸与Pb2+,Cd2+和Zn2+的配位能力,需准备配有滴汞电极的高阻抗电位差计,实验试剂、溶液必须充入超纯氮气以脱出溶解氧,滴定操作也必须在氮气保护下进行。测定Cu2+需再准备一只铜离子选择电极。
配腐殖酸溶液,浓度在20至30 mg·L-1之间,取20.00 mL腐殖酸悬浮液进行滴定,从滴定管中滴加参考量20μL的滴定剂(5.00×10-3mol·L-1Cu+2,Pb+2,Cd+2或者Zn+2)。通过从另一支滴定管中滴加足够量的2×10-3mol·L-1N aOH溶液以保持pH在6.00±0.05,滴定剂和N aOH溶液均含0.02 mol·L-1N aNO3。当滴定进行时,滴定剂的用量增加到100uL,以便记录30个点体积消耗值和相应的电位值同样,取20.00 mL 0.02 mol·L-1N aNO3溶液进行标定。在加入滴定剂和补偿pH之后,平衡5m in后,记录电位值,直至电位漂移小于0.555 mV·m in-1。
1.6 洞庭湖沉积物和腐殖酸络合物中金属离子的测定[13-15]
沉积物经消解后,测定其中的铁、铜、锰、铝、锌、镉和铅成分。操作如下:称取1.0 g干燥的沉积物,首先加4mL浓HNO3消煮30 m in,再加2 mL 30%(w/w)双氧水和1mL浓HNO3一起消煮,直到有机物质完全分解。溶液用0.50μmM illex膜过滤,用1%HNO3稀释至50 mL容量瓶中,然后通过火焰原子吸收光谱法分析各金属含量,加入KCl以避免电离干扰作用。腐殖酸络合物分析与沉积物分析方法相同,只是取样为0.1 g。
2 结果与讨论
2.1 元素组成与灰分含量
表1给出了元素成分和灰分含量,焚化后的腐殖酸灰分含量较低,表明在提取与纯化过程中较好地去除了矿物质,对来源于不同地点的多种腐殖酸元素测定,其结果差别不大,C/ H、C/N和C/O平均比率分别为0.94、11.80和1.87。与土壤和水体中的腐殖酸相比较,沉积物腐殖酸的N/C比率较高,原因是它们形成的机理和前体材料不同,沉积物腐殖酸主要由浮游生物和水生植物在死亡后经一系列生化过程转化而来,这些前体材料的N/C元素比通常在0.11~0.16之间。从西洞庭湖水域提取的腐殖酸其元素比为:C:H:O:N=38:40:18: 3,C/H平均比率为0.93,高于土壤中腐殖酸的C/H,表明含有较多的芳环结构。

表1 洞庭湖沉积物腐殖酸元素组成、灰分含量与摩尔比率Table 1 Elemental compositions,ash contents and molar elemental ratios of hum ic acids in sedi ments from Dongting Lake
2.2 摩尔质量分布
图1为腐殖酸洗脱曲线与球状蛋白凝胶渗透色谱比较图(扫描波长280 nm),腐殖酸分
子量分布非常宽,最大分布区域在3,701±117D,部分腐殖酸分子量甚至达到65000。
2.3 酸碱特性[16-18]
表2给出部分数据的计算结果和电离平衡常数pK值,根据修正Gran函数,可以确定在0.1mol·L-1N aCl介质中腐殖酸有六种可滴定形体。洞庭湖沉积物腐殖酸的羧基和酚基含量比土壤和水中的低,而羰基含量高。腐殖酸中羧基含量在2.68 mmol·g-1,质子化有机胺和酚羟基总量在1.42 mmol·g-1。根据腐殖酸酸性官能基总量在4.2±0.1 mmol· g-1,可推测腐殖酸每一个可离子化结构单元的摩尔质量在208~216 g·mol-1。与棕黄酸和从土壤获得的腐殖质相比,沉积物中的腐殖酸可离解羧基官能团的含量明显偏低,暗示在腐殖酸分子结构中存在未电离的游离羧酸官能团,这可能与腐殖酸分子量大、结构复杂有关,造成空间位阻较高、妨碍了质子的电离。
为了研究腐殖酸的酸碱性,仿照配位滴定法相似条件,选择0.02mol·L-1N aNO3溶液作介质,进行碱量滴定操作,腐殖酸浓度为30 mg·L-1,结果见表,在这一条件下,只有五种形体可以被滴定。化学计量数据小于在0.1mol·L-1N aCl介质中测得的数据。其中HA 1为一强酸,无法得到相应的pKa数据,这一现象无法解释。

图1 凝胶渗透色谱洗脱曲线Fig.1 GPC elution curves

表2 腐殖酸悬浮物电位滴定线性回归拟合Table 2 L inear regression f ittings for acid base potentiometric titration of hum ic acids extracted from suspendedmaterials
2.4 络合特征
表3给出了条件稳定常数的数值(lgK)和根据Scatchard曲线得到的腐殖酸配位能力数据,[ML]/[M2+]与[ML]曲线关系见图2,其中[M2+]表示Cu2+、Pb2+、Cd2+、或Zn2+浓度, [ML]为金属络合物浓度。Cd2+、Zn2+形成单配体络合物,lgK数据是络合物离解平衡常数平均值,而Cu2+和Pb2+形成双配体络合物,lg1K、1Cc和lg2K、2Cc不仅是数据平均值,而且反映了两级络合能力的差异。根据Scatchard曲线上的曲度情况,可以看出Cu和Pb形成的络合物较稳定,Cu的一级稳定常数lgK在7.6±0.1,比它形成的二级络合稳定,一级络合容量大约是二级络合容量的一半,络合总量大约为1250μmol·g-1,根据以0.1 mol·L-1N aCl溶液为介质、腐殖酸浓度为1.010 g·L-1获得的电位分析数据,在pH=6.0时,大约有2.365 mmol·g-1羧基没有参与络合,可以推测每个铜离子与腐殖酸分子中的两个可离解基团形成双齿结构的螯合物,1250 umol·g-1铜离子与95%的未电离部位结合。另一方面,在离子强度为0.02 mol·L-1N aNO3,腐殖酸浓度为30mg·L-1,获得的电离常数pKa数据显示在pH=6.0时,有2080 mol·g-1的未络合羧化物中心存在。因此,在形成络合结构中,两个羧基参与的形式不一样,一个羧基以盐的形式结合,另一个形成配位键,而酚羟基和氨基在pH =6的酸性介质中,没有参与络合。相比空白对照,腐殖酸在滴定过程中,需要加入大量的2 mmol·L-1N aOH溶液,才能保持pH在6.00±0.05,额外增加的OH-,相当于从未分离的结合部位释放的H+,每克腐殖酸释放的质子总量见表3。然而,与所有研究的四种金属离子的配位容量相比,释放的质子数量非常少,暗示已离解的羧酸根、羰基、醇氧或氮原子在螯合物形成过程中参与了螯合键的形成,铅也是含两个不同键合部位的原子,但是不像观察到的铜原子,两级离解常数差(lgK)仅仅0.6个单位。在离子强度为0.1mol·L-1N aCl溶液中测定的Pb2+络合总容量为2260mol·g-1,说明在pH=6.0时82.5%为自由离解的官能团。考虑到在离子强度为0.02 mol·L-1N aNO3,腐殖酸浓度为30mg·L-1时测定的pKa数据,羧基中心总容量在2260mol·g-1,或羧酸根在2040mol·g-1。Pb2+与腐殖酸构成的双齿螯合物一定有近一半的配位键是与羰基或醇氧原子或者氮原子形成。当观察铜原子时,在pH= 6.0,未解离官能基释放质子,但仅仅是配位容量总量的小部分。
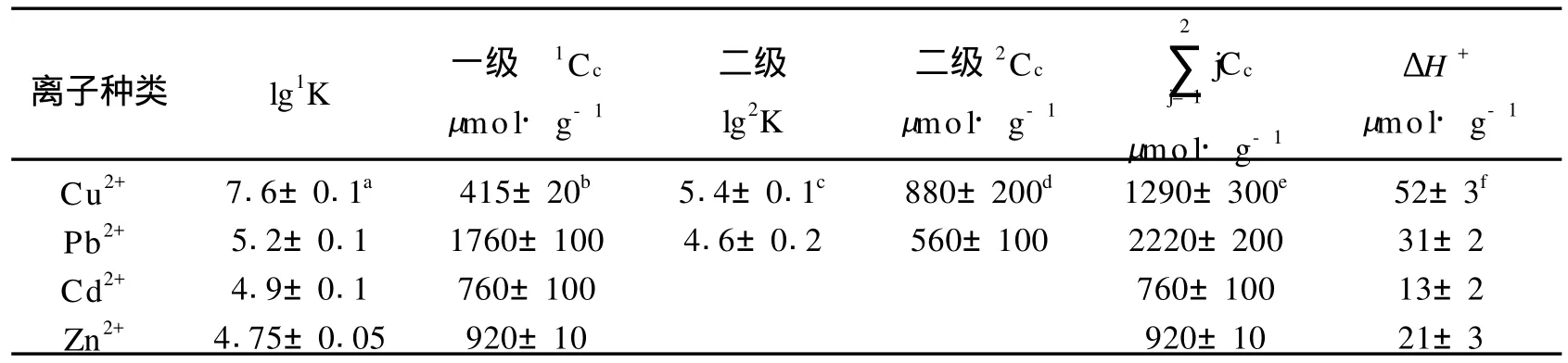
表3 络合物稳定常数(jK)和络合容量(jCc)Table 3 Stability constants(jK)and complexing capacity(jCc)of complex compound

表4 沉积物及腐殖酸中金属离子含量Table 4 M etallic ion contents extracted from sedi ments and hum ic acids
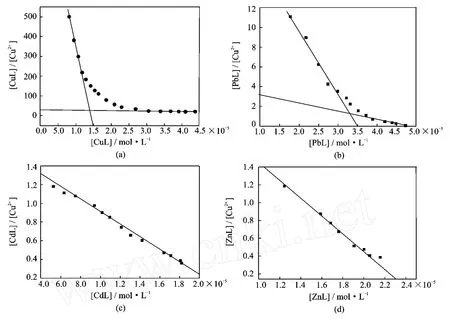
图2 洞庭湖沉积物中提取的腐殖酸配位分析Scatchard曲线(a=Cu,b=Pb,c=Cd,d=Zn)Fig.2 Scatchard curves of coordinate analysis of hum ic acids extracted from sedi ments of Dongting L ake(a=Cu,b=Pb,c=Cd,d=Zn)
镉和锌的结果相似,形成不稳定络合物,与铜铅相比,而且配位容量低。络合物的稳定性顺序与金属阳离子关系为Cu>Pb>Cd≈Zn。结果与Slavek等得到的结果一致,他在研究用浓N aCl溶液和络合剂从腐殖酸上选择提取金属阳离子时,证实铜的保留时间大于铅的保留时间。盐溶液仅仅提取50%的铜和铅,而络合剂(EDTA和DTPA)可以提取90%的金属离子,镉和锌与腐殖酸结合较弱,近80%的镉和锌能被浓盐溶液抽提出来。Slavek保留时间顺序为Cu>Pb>Cd>Zn。
2.5 腐殖酸和沉积物中的金属及有机碳含量
表4表示了通过HNO3/双氧水处理从沉积物中提取的金属含量,以及经分离和提纯后保持在腐殖酸中金属含量。在实验中,铅和镉没有被检出,而在沉积物和腐殖酸中检出铜和锌,且铜的量比锌多,与络合滴定法测定的稳定常数一致。洞庭湖沉积物中金属离子的保留情况说明这些金属离子与天然有机物质分子中的某些基团具有较强的亲和能力,铜锌这两种金属元素的存在进一步解释了它们作为微量营养元素对浮游生物和其它生物体起着重要作用,在沉积物样本中,有机碳含量较低可以通过粒度分析的结果来解释,仅仅24%的粒度<63μm(被抽提浓缩的有机物质部分的粒度<20μm),如果把这部分有机物质计算在内,有机碳含量也只有12%。
铝和铁是沉淀物主要成分,在腐殖酸中含量相当高,说明这些金属与天然有机物存在较强的作用,铁和铝对于腐殖酸三级结构的形成起着非常重要的作用。
3 结论
IHSS抽提程序适用于湖底沉积物中腐殖质的分离,洞庭湖沉积物腐殖酸分子量较大,灰分含量较低,湖底沉积物腐殖酸分子结构中存在未电离的羧基和酚羟基,而羧基和酚羟基是络合物主要的键合点,不同重金属离子与腐殖酸配位能力存在差异,铜、铅、镉和锌离子与腐殖酸络合物稳定性顺序为:Cu>Pb>Cd>Zn,配位容量顺序为:Pb>Cu>Cd≈Zn。因此,反映Cu、Pb、Cd和Zn对洞庭湖污染程度也不一样,其中Cu和Pb与腐殖酸结合稳定,不易解离,因此不会对洞庭湖产生长期性污染,而Cd与腐殖酸结合较弱,容易造成污染,应加强对Cd的排放管制。
[1] 李光林,魏世强,青长乐.腐殖酸与几种重金属离子的相互作用及影响因素研究[R].西南农业大学, 2001年博士论文.
[2] 刘小虎,贾庆宇,高春丽.土壤胡敏酸与铜、锌离子的络合特征及生物有效性的研究[J].植物营养与肥料学报,2006,12(5):681-68.
[3] 余贵芬,蒋新和,文祥.腐殖酸对红壤中铅镉赋存形态及活性的影响[J].环境科学学报,2002(4):508-513.
[4] 徐启杰,张果,崔元臣.腐殖酸的吸附性能及其金属络合物的应用[J].天中学刊,2007(5):22-24.
[5] 王晶,张旭东,李彬,等.腐殖酸对土壤中Cd形态的影响及利用研究[J].土壤通报,2002,33(3):185-187.
[6] 袁忠伟,孙力平,路远.草炭腐殖酸的提取研究[J].市政技术,2008,26(2):155-158.
[7] 李丽,冉勇.泥炭土连续碱抽提腐殖酸的分子结构特征[J].分析化学,2002(2):1304-1307.
[8] 李丽,于志强.Pahokee泥炭腐殖酸的相对分子量分布特征及其对菲的吸附影响[J],环境科学学报, 2004(4):587-590.
[9] 曲风臣,陈硕,赵慧敏.土壤腐殖酸SDS,凝胶分级及表观分子量的测定[J].环境化学,2006(4):495-499.
[10]陈盈,张满利,张威,等.不同来源腐殖酸与M n2+和Zn2+络合稳定常数的确定[J].辽宁工程技术大学学报(自然科学版),2008(3):478-481.
[11]彭朝辉,严永涛,朴明世,等.天然水体中腐殖酸的分析方法[J].东北水利水电,2008(8):59-63.
[12]Gulm ini,M.,Zelano,V.,Daniele,et al.Characterization of ligand sites on natural sedi ment particles[J].A nal.Chi m.A cta 1998,358:195-204.
[13]叶舟.分光光度法测定污泥中腐殖酸的含量[J].环境科学与技术,1989(1):34-37.
[14]罗道成,刘俊峰.腐殖酸树脂处理含Pb2+、Cu2+、N i2+废水的研究[J].环境污染治理技术与设备,2005 (10):246-249.
[15]陶澍,崔军.水生腐殖酸分子量分布研究[J].环境科学学报,1990(10)2:190-194.
[16]孙伟亚,何广平,吴宏海,等.珠江河口水体沉积物中腐殖酸的提取与表征[J].应用化工,2006,35(1): 64-67.
[17]刘保峰,王强,孟威,等.酸度对胡敏酸与镉和锌离子络合反应的影响[J].西南农业大学学报(自然科学版)2005(4):451-453.
[18]孙又宁,封朝晖,余梅玲.腐殖酸类物质凝聚及沉淀特性的研究[J].腐植酸,2005(1):12-15.
Study on coordination properties and acidity-basicity of hum ic acids extracted from sedi ments of Dongting Lake
ZEN G Lei,YICheng,ZHOU Cong-wen,CHEN Ke
(H unan Environm ent&B iolog ic Poly technic,H engyang421005,China)
The acidity-basicity and coordination property of hum ic acids isolated from sediments of Dongting L ake by using of potentiometric titration method and the data fitting by using of modified Gran function are studied.The contents and distribution of six classes of titratable groups are characterized,the pKa values are varied between 2.35~10.50,the carboxyl groups are accounted for 66%of total ionizable sites.The coordination properties of hum ic acids w ith Cu2+,Pb2+,Cd2+and Zn2+by using of Cu-ion selective electrode or amalgam electrode(Pb,Cd and Zn)are discussed.The data treatment by the Scatchard method reveals a double coordination for copper and lead and a single coordination for cadm ium and zinc.The average stability constants are in the follow ing order:logKHA-Pb> logKHA-CdlogKHA-Zn,while the coordination capacity order is:Pb>Cu>Cd≈gZn.
hum ic acid;acid-basetitrimetry;coordination properties;stability constants
book=136,ebook=31
O 636.9
A
1671-4814(2010)02-136-08
2009-07-30
国土资源部科技司自由选题项目(编号992008)资助。
曾 蕾(1965~)男,湖南祁东人,硕士,副教授,从事仪器分析和环境化学研究。
