磺胺间甲氧嘧啶-镉复合污染对作物种子发芽的影响
2010-09-04金彩霞刘军军鲍林林周庆祥周启星河南师范大学化学与环境科学学院河南省环境污染控制重点实验室黄淮水环境与污染防治省部共建教育部重点实验室河南新乡453007南开大学环境科学与工程学院天津30007
金彩霞,刘军军,鲍林林,周庆祥,周启星(.河南师范大学化学与环境科学学院,河南省环境污染控制重点实验室,黄淮水环境与污染防治省部共建教育部重点实验室,河南 新乡 453007;.南开大学环境科学与工程学院,天津 30007)
磺胺间甲氧嘧啶-镉复合污染对作物种子发芽的影响
金彩霞1*,刘军军1,鲍林林1,周庆祥1,周启星2(1.河南师范大学化学与环境科学学院,河南省环境污染控制重点实验室,黄淮水环境与污染防治省部共建教育部重点实验室,河南 新乡 453007;2.南开大学环境科学与工程学院,天津 300071)
测定了黄潮土中常用兽药磺胺间甲氧嘧啶(SMM)与重金属镉(Cd)单一及复合污染对小麦和西红柿种子发芽(根伸长、芽伸长和发芽率)的影响,分析了土壤中药物浓度与作物生长抑制的剂量-效应关系及复合污染的毒性效应.结果表明,在单一污染物作用下,根伸长抑制率和芽伸长抑制率与药物浓度显著相关(P<0.05),发芽抑制率与药物浓度不相关(P>0.05);药物对根伸长及芽伸长的抑制高于对种子发芽的抑制;SMM对2种作物的毒性效应明显强于Cd,SMM对小麦和西红柿根伸长的IC50(抑制率为50%时污染物浓度)分别为33.7,49.3mg/kg,而Cd为507.3,599.8mg/kg.SMM和Cd复合污染时,在低Cd(200mg/kg)的胁迫下,联合作用主要体现为协同作用,但随着SMM浓度的增加,协同效应不显著(P>0.05);在高Cd(500mg/kg)作用下,二者的联合效应中Cd起主要作用.
磺胺间甲氧嘧啶;镉;复合污染;生态毒性;抑制率
Abstract:The single and joint effects of sulfamonomethoxine(SMM) and cadmium (Cd) on seed germination rate and shoot/root elongation of wheat (Triticum aestivum L.) and tomato (Solanum lycopersicum) in yellow fluvo-aquic soil were investigated. In the single-factor experiments, there was a dose-response relationship between the concentration of SMM or Cd and the inhibitory rate of crop root elongation and shoot elongation (P<0.05), but no correlation was found between the concentration of each pollutant and the inhibitory rate of crop seed germination (P>0.05). The inhibitory effect of each pollutant on root and shoot elongation was much stronger than those on seed germination. SMM showed a much higher toxic effect on crops than did Cd. The IC50(half inhibition concentration) values of SMM on root elongation of wheat and tomato were 33.7, 49.3 mg/kg, respectively, the corresponding values of Cd were 507.3, 599.8 mg/kg, respectively. In the joint effect tests, SMM and Cd showed a synergic effect on root and shoot elongation when the concentration of Cd was at 200 mg/kg. However the synergic effect was not significant with the increase of SMM concentration (P>0.05); At the high concentration of Cd (500 mg/kg), joint toxicity of SMM and Cd was more dependent on Cd.
Key words:sulfamonomethoxine;cadmium;combined pollution;ecotoxicology;inhibitory rate
随着集约化、规模化养殖业的快速发展,大量兽药被用来防治各种畜禽疾病.研究表明,大约有60%~90%兽药随动物粪便排出体外[1].2003年我国磺胺类药物年产量突破2万t[2],如果这些药物都用于养殖业,则每年进入环境中的磺胺类药物就可达1.2万~1.8万t,并且这些兽药很可能在土壤中积累,进而影响动植物和微生物的正常生命活动,最终影响人类的身体健康[3-6].因此,近年来,兽药对生态环境的影响成为研究热点[7-8].
磺胺类药物(SAs)是一类以对氨基苯磺酰胺为基本化学结构的合成抗菌药物,是我国生产量和使用量最大的兽药之一.新鲜猪粪中磺胺药物可高达20~40mg/kg,每亩农田每年将有高达几百克的磺胺药物施入[9].Cd是环境中常见的重金属元素之一,可以通过工业排放、化肥施用、污水灌溉、污泥农用等多种途径进入农田生态系统,影响作物的生长、发育[10].因此,农田生态系统中磺胺类药物-镉的复合污染较普遍.而目前针对此类复合污染开展的生态毒理学研究较少.
本研究以黄潮土作为供试土壤,研究了磺胺间甲氧嘧啶(SMM)、镉单一及复合污染对小麦和西红柿种子发芽、根伸长和芽伸长的影响.通过作物幼苗生长受抑制程度,评价SMM与Cd复合污染的生态毒性及可能对农业生产产生的环境风险.
1 材料与方法
1.1材料
SMM原药,纯度≥92%,购自北京博亚华牧业科技有限公司; CdCl2·2.5H2O分析纯,广州化学试剂厂生产.
小麦(Triticum aestivum L.) 泛麦5号,发芽率为98%;西红柿(Solanum lycopersicum)合作908,发芽率为80%,均购自新乡市种子公司.供试土壤采自河南师范大学校内生物实验田0~20cm表土,pH值为8.31,有机质含量为2.01%,总氮、总磷、总钾、总镉的含量分别为0.09,0.04,0.18g/kg及0.66mg/kg, CEC含量为12.26cmol/kg.
1.2实验方法
1.2.1预备试验 称取50g风干土壤于90mm直径的玻璃培养皿中,加入不同剂量的SMM和Cd,并用去离子水调节土壤含水量至田间最大持水量的60%,将其置于恒温培养箱中25℃下平衡48h后,用镊子将植物种子均匀播种于土壤中(小麦种子放置时,保持种子胚根末端和生长方向呈直线),盖好玻璃培养皿,置于恒温培养箱中25℃暗处培养.当对照种子发芽率>90%,根长度为20mm时,实验结束.确定种子根和芽伸长抑制浓度(IC),使其抑制率在10%~60%之间,开始正式试验.抑制率(IR)可通过式(1)计算:式中: A为对照根或芽的伸长,mm; B为处理浓度下根或芽的伸长, mm.

1.2.2正式试验 根据预备实验结果,在种子发芽和根伸长IC达到抑制率10%~60%范围内,设置6个不同处理浓度,SMM的6个处理浓度分别为2,5,10,20,40,60mg/kg;Cd的6个处理浓度分别为100,200,300,400,500,600mg/kg;复合污染实验中,为了与单一污染实验相对应,SMM浓度同样设定为2,5,10,20,40,60mg/kg,Cd的浓度设置为0,200,500mg/kg,每个处理20粒种子,3次重复.在与预备试验相同的温度和水分条件下,进行作物种子发芽与生长培养试验.实验结束时,测定各处理种子的根伸长、芽伸长(根长的测定以胚轴与根之间的过度点开始),计算根长度和芽长度的平均值及标准偏差,并以浓度-抑制率绘制曲线,进行回归分析,并根据回归方程计算出药物对作物生长抑制率为50%时药物的浓度(IC50).
1.3数据分析
采用SPSS13.0对数据进行方差分析及回归分析,计算出IC50.
2 结果与讨论
2.1SMM对小麦和西红柿种子发芽的影响
由图1可以看出,土壤中SMM浓度与小麦和西红柿根伸长和芽伸长抑制率具有显著相关性 (P<0.05),且呈线性相关.无论是小麦还是西红柿,SMM对根伸长的抑制作用都强于对芽伸长的抑制.由图1线性回归方程可以求出SMM对2种作物根的IC50值(小麦为33.7mg/kg,西红柿为49.3mg/kg),小麦根较西红柿根更敏感.方差分析表明,小麦和西红柿种子发芽抑制率与土壤中SMM浓度之间没有相关性(P>0.05).
磺胺类药物对小麦和西红柿根和芽伸长产生较强的毒害效应.其毒性主要是植物体内该污染物与叶酸相互竞争的结果,叶酸与嘌呤合成有关,而嘌呤是细胞分裂素和脱落酸的前体,因此植物吸收兽药而降低了对叶酸的吸收,从而影响了其正常的生理功能[11].在SMM的胁迫下,作物可能因吸收药物,体内缺乏细胞生长所需的叶酸,故根和芽伸长受到较强的抑制,但其具体作用机制有待于进一步研究.

图1 SMM对小麦和西红柿的根伸长和芽伸长抑制率的影响Fig.1 Inhibitory rates of SMM on root/shoot elongation of wheat and tomato
2.2Cd对小麦和西红柿种子发芽的影响
由图2可见,Cd对小麦和西红柿的根伸长和芽伸长有极显著影响(P<0.01),2种作物根和芽伸长抑制率与Cd浓度显著线性相关(P<0.01).当土壤中Cd的浓度为100mg/kg,小麦的根和芽伸长抑制率分别为-4.2%和-5.3%,西红柿的根伸长抑制率为-6.3%,即对作物的生长有一定的促进作用.而在高浓度Cd胁迫下,作物受害症状明显,根伸长及芽伸长受到显著抑制,土壤中Cd浓度为600mg/kg时,小麦的根伸长和芽伸长抑制率分别为65.9%和68.7%,西红柿的根伸长和芽伸长抑制率为42.5%和54.4%.与SMM对作物种子发芽与根伸长抑制率影响相同,在试验浓度范围内,土壤中Cd的浓度对小麦和西红柿种子发芽抑制率无显著影响(P>0.05).
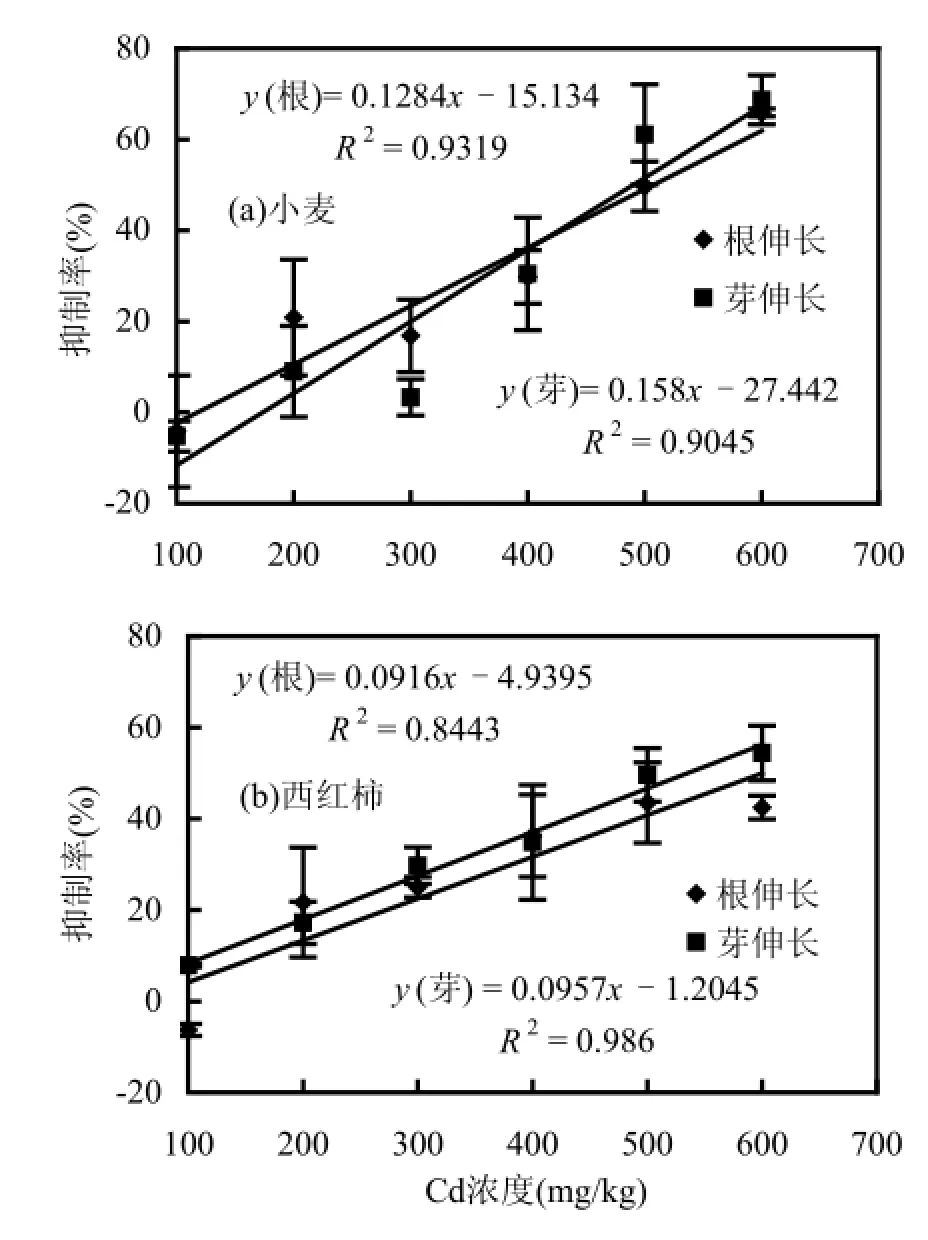
图2 Cd对小麦和西红柿的根伸长和芽伸长抑制率的影响
Fig.2 Inhibitory rates of Cd on root/shoot elongation of wheat and tomato
以往有关Cd对植物毒性的研究多在水培条件下开展,而在土壤环境中的胶体、有机质等物质对重金属离子有吸附、络合、固定等作用,所以,土壤中重金属的存在形态和生物有效性与溶液中差别很大[12].王晓蓉等[13]研究显示,小麦幼苗对土壤Cd的耐性很强,当土壤Cd的浓度达到33 mg/kg时,小麦幼苗未出现明显的毒害症状,且对植物的鲜重和株高有一定的刺激作用.在本实验的土壤条件下,当Cd的浓度为100mg/kg时,对小麦和西红柿的根伸长抑制率分别为-4.2%和-6.3%,促进了作物的生长.但目前对其作用机制尚不完全清楚[12].有学者把低浓度毒物刺激生长的现象与“毒物兴奋效应”相联系,即由生物体对胁迫响应的“过度补偿”引起的.研究表明,低剂量Cd对细胞分裂与增殖有促进作用[14-15]. Sobkowiak等[16]认为,低剂量Cd对细胞增殖的刺激作用,可能与Cd2+能部分代替Zn2+的功能有关,Cd与细胞内的Zn结合位点具有更强的亲和性,可以介导多个转录因子结合到基因的调控区域上,并且还作为转录和复制过程中的关键酶的辅助因子发挥作用.
在土壤受到SMM、Cd单一污染时,土壤中污染物的含量与小麦和西红柿的根伸长及芽伸长抑制率显著相关(P<0.05),而与其发芽抑制率相关性不显著(P>0.05).这可能与种子发芽和根伸长的生长过程有关.通常种子发芽过程除了受外界环境影响外,还可从胚内得到养分供应,土壤污染对种子发芽的毒害作用在一定浓度范围内仅表现为部分抑制,只有土壤受到严重污染时,种子发芽才能完全被抑制.而根从一开始就完全暴露于土壤中,其生长和发育全过程受土壤条件的影响较大,因此,根对土壤污染的反应更敏感.这一结果与对其他污染物研究的结果相似[17-18].
从2种作物的IC50值可知,无论是在SMM还是Cd的胁迫下,药物对小麦的生态毒性效应要强于西红柿.另外,SMM对作物的生态毒性远大于Cd.Cd对小麦根伸长的IC50值是SMM的15倍;Cd对于西红柿根伸长的IC50值是SMM的12倍.兽药抗生素作为新型的环境污染物对生态环境可能造成的危害应引起重视.
2.3SMM-Cd复合污染对小麦和西红柿种子发芽的影响
由图3,图4可见,SMM-Cd复合污染与小麦根伸长和芽伸长抑制率之间有显著相关性(P<0.05),当Cd的浓度分别为0,200,500 mg/kg时,小麦的根伸长和芽伸长抑制率与土壤中SMM的浓度线性相关;而对于西红柿,当Cd的添加浓度为200mg/kg时,土壤中SMM的含量与西红柿根和芽伸长抑制率之间具有相关性(P<0.05),但当Cd的浓度为500 mg/kg时,SMM含量与西红柿根和芽伸长抑制率之间没有相关性(P>0.05).
由图3可以看出,在低浓度SMM的胁迫下,随着Cd投加量的增加,其对小麦根伸长和芽伸长抑制率也相应的增加,且差异较大.但随着SMM浓度的增加,在较高浓度SMM的胁迫下,虽然Cd投加量增加,但对小麦根和芽伸长抑制率的差异逐渐减小.由回归方程可知,在Cd的浓度分别为0,200,500mg/kg,小麦根伸长抑制率为50%时,土壤中SMM浓度随Cd的增加而显著降低,其IC50分别为33.7,25.2,8.02mg/kg.
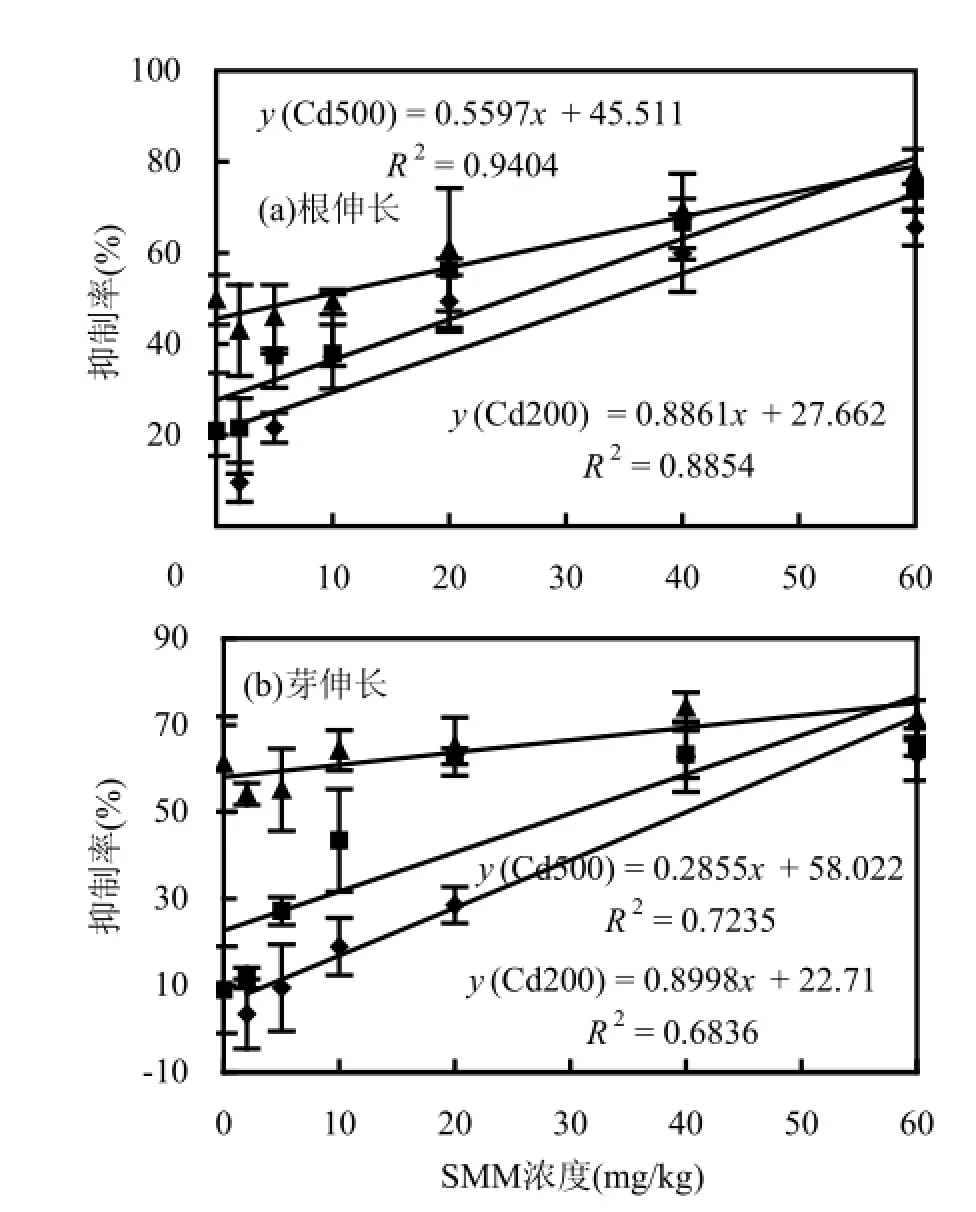
图3 SMM与Cd复合污染对小麦根伸长和芽伸长的抑制效应Fig.3 Joint toxic effect of SMM and Cd on root elongation and shoot elongation of wheat
由图4可见,同SMM-Cd对小麦的根伸长及芽伸长影响一致,在低浓度SMM的胁迫下,随着Cd投入量的增加,其对西红柿根伸长和芽伸长抑制率也相应的增加,且差异较大.而在高浓度SMM的胁迫下,亦表现出随Cd投加量的增加对西红柿根和芽伸长抑制率的差异逐渐减小.
由图4可以看出,随着Cd浓度的增加,SMM浓度与西红柿根和芽伸长之间的相关性越来越差.当Cd的浓度分别为0,200,500mg/kg时,西红柿根伸长抑制率与土壤中SMM浓度间的R2分别为0.8911、0.9237、0.4926;芽伸长R2分别为0.9042、0.7155、0.0166.另外,Cd的浓度分别为0,200, 500mg/kg,西红柿根伸长抑制率达到50%时,土壤中SMM浓度(IC50)分别为49.3,41.6,4.39mg/kg.可以看出,随着土壤中Cd浓度的增加,SMM对西红柿的IC50呈现出明显减小的趋势.
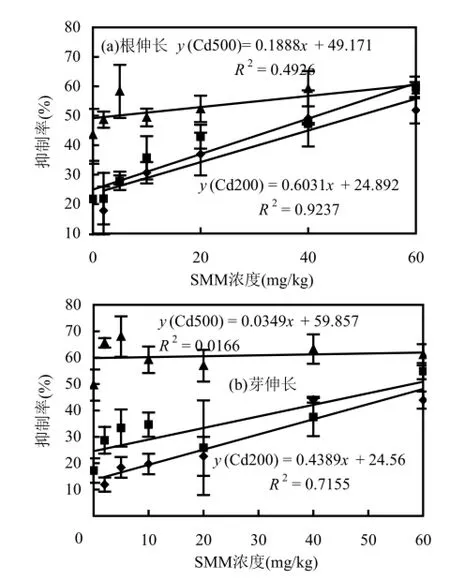
图4 SMM与Cd复合污染对西红柿根伸长和芽伸长的抑制效应Fig.4 Joint toxic effect of SMM and Cd on root elongation and shoot elongation of tomato
在含有SMM的土壤中添加Cd,随着Cd含量的增加,其对小麦和西红柿的根伸长和芽伸长的抑制率也相应增加,说明Cd的加入是毒性增加的主要原因.Sun等[19]研究表明,农药氯氰菊酯(CPM)与Cu复合污染对白菜根伸长的影响要小于单一Cu的作用.这与本实验研究结果不同,本实验中SMM-Cd复合污染对小麦和西红柿的根(芽)伸长抑制作用整体上要强于SMM或Cd的单一作用,这可能与药物对作物的作用机制有关.Cd对植物生长发育的毒害作用与其对养分代谢影响有关,高浓度的Cd能够降低燕麦根中的ATP酶活性,进而阻碍作物根对K的吸收[20],作物可能因缺K其生长受到抑制;SMM可能通过阻止植物体内叶酸的合成,抑制细胞的生长和繁殖,从而对作物的根(芽)伸长产生抑制作用.
周启星等[21]研究了水溶液中染料活性红X-3B与Cd复合污染对小麦的生态毒性效应,研究结果表明,当Cd浓度较低时(≤10mg/L)时,联合毒性较强,对小麦根伸长抑制作用强,但随着Cd浓度的升高,联合毒性减弱,当活性红X-3B与Cd的浓度都较高时,对小麦根伸长产生拮抗作用,这可能是因为2种污染物的交互作用.在本实验中,低镉(200mg/kg)作用下, SMM-Cd联合对作物的毒害较SMM或Cd单一强,联合作用体现为协同效应,但随着SMM浓度的增加,3个Cd处理对作物根(芽)伸长的差异逐渐减小,协同效应不显著.这可能与药物之间的交互作用有关.一方面,有机污染物与重金属的复合污染可能会降低重金属活性[22-23],在高浓度SMM的胁迫下,土壤因吸附/解吸SMM一些表面特性发生改变,比如有机质等,土壤可能吸附更多的Cd而降低其生物有效性,减少了作物根对SMM和Cd的吸收,从而降低了二者复合污染对作物的毒害作用.另一方面,磺胺类药物可与Cu2+生成盐沉淀[24],所以当土壤中存在较高浓度的SMM与Cd2+时,二者可能部分反应生成磺胺镉盐沉淀,降低了Cd与SMM的生物有效性.
在高镉(500mg/kg)的胁迫下,当SMM的浓度较低(<10mg/kg)时,SMM-Cd对小麦的根和芽伸长抑制率低于Cd单一作用(图3),二者对小麦的根和芽伸长产生了一定的拮抗作用,但其影响差异并不显著,这可能是因为SMM的加入致使Cd的生物有效性降低.另外,在高Cd作用下,不同处理的SMM对2种作物的根(芽)伸长影响较小,这说明在此条件下,二者联合毒性主要依靠Cd而不是SMM的作用.总之,有机化学物质与重金属间的联合作用机制很复杂,其毒性一般由药物的交互作用和物质间的浓度组合以及污染物本身的化学性质来决定,在一定条件下,污染物暴露的浓度组合关系甚至起决定作用[25-26].
3 结论
3.1SMM或Cd单一污染时,土壤中药物浓度与小麦和西红柿根伸长和芽伸长抑制率有显著相关性(P<0.05),但与小麦和西红柿种子发芽抑制率不具有相关性(P>0.05),药物对2种作物的根伸长及芽伸长抑制率大于种子发芽抑制率.
3.2从药物对作物生长抑制的强弱及IC50值来看,SMM对2种作物的生态毒性效应远强于重金属Cd;在本实验中,小麦相对于西红柿更敏感些.
3.3SMM和Cd复合污染对作物生长的影响较复杂,在低Cd(200mg/kg)的胁迫下,联合作用主要体现为协同作用,但随着SMM浓度的增加,协同效应不显著;在高Cd(500mg/kg)作用下,二者的联合效应主要依靠于Cd的作用.
[1] Halling-Sørensen B, Nors Nielsen S, Lanzky P F, et al. Occurrence, fate and effects of pharmaceutical substances in the environment-a review [J]. Chemosphere, 1998,36(2):357-393.
[2] 李云开,刘世荣,张克强,等.磺胺类药物在农田生态系统中迁移转化过程的研究进展 [J]. 中国畜牧兽医, 2007,34(12):141-144.
[3] 孔维栋,朱永官.抗生素类兽药对植物和土壤微生物的生态毒理学效应研究进展 [J]. 生态毒理学报, 2007,2(1):1-9.
[4] Nicole Kemper. Veterinary antibiotics in the aquatic and terrestrial environment [J]. Ecological Indicators, 2008,8(1):1-13.
[5] Luciana Migliore,Salvatore Cozzolino,Maurizio Fiori. Phytotoxicity to and uptake of enrofloxacin in crop plants [J]. Chemosphere, 2003,52(7):1233-1244.
[6] Spaepen K R I, Van Leemput L J J, Wislocki P G,et al. A uniform procedure to estimate the predicted environmental concentration of the residues of veterinary medicines in soil [J]. Environ. Toxicol. Chem., 1997, 16:1977-1982.
[7] Boxall A B A, Kolpin D W, Halling-Sorensen B, et al. Are veterinary medicines causing environmental risks? [J]. Environ. Sci. Technol., 2003,37:286-294.
[8] Thiele S. Pharmaceutical antibiotic compound in soils—a review [J]. J. Plant Nutr. Soil. Sci., 2003,166:145-167.
[9] Burkhardt M, Stoob K, Stamm C, et al . Veterinary antibiotics in animal slurries-A new environmental issue in grassland research [J]. Grassl .Sci. Eur., 2004,9:322-324.
[10] 周启星,孔繁翔,朱 琳.生态毒理学 [M]. 北京:科学出版社, 2004.
[11] Migliore L, Civitareale C, Cozzolino S, et al. Laboratory models to evaluate phytotoxicity of sulphadimethoxine on terrestrial plants [J]. Chemosphere, 1998,37:2957-2961.
[12] 林仁漳,杜文超,王晓蓉,等.土壤外源Cd胁迫对小麦幼苗生长自由基代谢及抗氧化酶活性的影响 [J]. 农业环境科学学报, 2008,27(1):23-29.
[13] Lin R Z, Wang X R, Luo Y, et al. Effects of soil cadmium on growth, oxidative stress and antioxidant system in wheat seedlings (Triticum aestivum L.) [J]. Chemosphere, 2007,69:89-98.
[14] Von Zglinicki T, Edwall C, Ostlund E, et al. Very lowcadmium concentration stimulate DNA synthesis and cell growth [J]. J. Cell. Sci., 1992,103:1073-1081.
[15] Beyersmann D, Hechtenberg S. Cadmium, gene regulation,and cellular signaling in mammalian cells [J]. Toxicol. Appl. Pharm., 1997,144:247-261.
[16] Sobkowiak R, Deckert J. Cadmium-induced changes in growth and cell cycle gene expression in suspension-culture cells of soybean [J]. Plant Physiol. Biochem., 2003,41:767-772.
[17] 鲍艳宇,周启星,谢秀杰.四环素类抗生素对小麦种子芽与根伸长的影响 [J]. 中国环境科学, 2008,28(6):566-570.
[18] 万寅婧,占新华,周立祥.土壤中芘、菲、萘、苯对小麦的生态毒性影响 [J]. 中国环境科学, 2005,25(5):563-566.
[19] Liu T F, Wang T, Sun C, et al. Single and joint toxicity of cypermethrin and copper on Chinese cabbage(Pakchoi) seeds [J]. J. Hazard. Mater., 2009,163:344-348.
[20] 何振立,周启星,谢正苗.污染及有益元素的土壤化学平衡 [M].北京:中国环境科学出版社, 1998.
[21] Cheng Y, Zhou Q X. Ecological toxicity of reactive X-3B red dye and cadmium acting on wheat(Triticum aestivum) [J]. J. Environ. Sci., 2002,14:136-140.
[22] Chao L, Zhou Q X, Chen Su, et al. Single and joint stress of acetochlor and Pb on three agricultural crops in Northeast China [J]. J. Environ. Sci., 2007,19:719-724.
[23] Wang M E, Zhou Q X. Single and joint toxicity of chlorimuron-ethyl, cadmium, and copper acting on wheat Triticum aestivum [J]. Ecotoxicology and Environmental Safety, 2005, 60:169-175.
[24] 霍燕兰.药物分析技术 [M]. 北京:化学工业出版社, 2005.
[25] Teisseire H, Couderduet M, Vernet G. Toxic responses and cotalase activity of Lemna minor L. exposed to flopet, copper, and their combination [J]. Ecotoxicol. Environ. Saf., 1998,40: 194-200.
[26] 周启星,程云,张倩茹,等.复合污染生态毒理效应的定量分析关系 [J]. 中国科学(C辑), 2003,33(6):566-573.
Joint toxicity of sulfamonomethoxine and Cd on seed germination and root elongation of crops in soil.
JIN Cai-xia1*, LIU Jun-jun1, BAO Lin-lin1, ZHOU Qing-xiang1, ZHOU Qi-xing2(1.Henan Key Laboratory of Environmental Pollution Control, Key Laboratory for Yellow River and HuaiHe River Water Environmental and Pollution Control, Ministry of Education, College of Chemistry and Environmental Science, Henan Normal University, Xinxiang 453007, China;2.College of Environmental Science and Engineering, Nankai University, Tianjin 300071, China). China Environmental Science, 2010,30(6):839~844
X503.231
A
1000-6923(2010)06-0839-06
金彩霞(1976-),女,黑龙江延寿人,副教授,博士,研究方向为环境毒理学.发表论文20余篇.
2009-11-17
国家自然科学基金资助项目(20877022);河南省科技厅基础与前沿技术研究计划项目(092300410090)
* 责任作者, 副教授, heartjin0509@yahoo.com.cn
