大鼠局灶性脑缺血/再灌注后血脑屏障通透性改变时相的研究
2010-08-25史秀丽
杨 莹, 史秀丽, 何 玮, 傅 佳
脑缺血/再灌注损伤是一个复杂的病理过程,包括缺血期原发性损伤和再灌注期的继发性损伤。由于缺血过程中已造成线粒体损伤,再灌注时不能提供足够的电子起到还原作用,因而产生大量的自由基,过量的自由基可通过各种机制破坏 BBB,使 BBB通透性增加、产生脑水肿等一系列脑损伤[1]。本实验通过对大鼠脑缺血/再灌注后氧自由基和血脑屏障通透性的动态变化以及脑组织 MMP-2的表达,探讨氧自由基在血脑屏障损伤中的作用及其机制。
1 资料与方法
1.1 动物分组 健康成年 SD大鼠,雌雄各 70只,体重 270~350g,普通级,由安徽医科大学动物中心提供。根据文献[2]报道的方法,建立大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)模型。结扎大鼠右侧颈总和颈外动脉,自颈总动脉分叉处向颈内动脉插入栓线约(18.5±0.5)mm,阻断大脑中动脉血流,造成大脑中动脉梗阻,缺血 2h后在麻醉状态下轻拔线栓,使得大脑中动脉血流再灌注。假手术组手术过程与模型组相同,结扎大鼠右侧颈总和颈外动脉,但不插线。
根据文献[3]对造模大鼠进行神经功能评分,无功能障碍为 0分;不能伸展对侧前肢为 1分;向对侧旋转为 2分;向对侧倾倒为 3分;无自主活动伴意识障碍为 4分;死亡为 5分。选取苏醒后评分在 1~3分的大鼠模型为栓堵成功者进行下一步实验。将造模成功大鼠随机分配到脑缺血/再灌注后 7个时间点 ,即再灌注后 3h、9h、24h、48h、72h、96h及 120h。
1.2 BBB通透性评价 再灌注后各观察点前2h,将大鼠麻醉,经股静脉注射 2%EB(生理盐水配置,2ml/kg)[4],2h后断头取脑,取脑后左右大脑半球分开并称重,每克脑组织加入 2ml甲基酰胺后,置于 50℃恒温水浴箱,加盖遮光水浴 72h,然后 3000r/min离心 10min,取上清液,置可见分光光度计(波长620nm)测光密度(optical density,OD)值,以蒸馏水作空白比色。以 OD/g脑组织作为统计指标,数值越大,表示从血液经 BBB渗入脑组织中的 EB越多。
1.3 血清 SOD、MDA测定 再灌注后各观察点取脑前,一次性注射器腹主动脉取血 4ml,置一次性试管中,4000r/min离心 15min后,取上清液作为测定标本。SOD测定采用黄嘌呤氧化酶法,按照SOD测试盒(武汉博士德公司)的说明配制检测试剂,测各管吸光度值。MDA测定采用硫代巴比妥酸(TBA)法,按照 MDA测试盒(武汉博士德公司)的说明配制检测试剂,测各管吸光度值。
1.4 脑组织 MMP-2表达 分别于再灌注后各观察点麻醉大鼠,开胸,经心脏升主动脉灌注 4%多聚甲醛(pH7.4的 PBS配制),直到右心房流出的液体无色为止,取脑,于 10%甲醛液内固定 24h。将固定后的脑组织进行石蜡包埋后,切成 4μm厚的石蜡切片。石蜡切片行常规 HE染色,显微镜下观察确定组织结构未被破坏,再进行免疫组化染色。步骤遵循试剂盒说明书中 SABC法进行(武汉博士德公司),梯度酒精脱水,二甲苯透明,中性树胶封固。
2 实验结果
2.1 脑组织 EB含量变化 脑缺血/再灌注 3h后脑组织 EB含量显著增加,再灌注后 24h和 72h变化最明显,与正常组及假手术组比较差异有统计学意义(P<0.05),再灌注 96h后基本恢复正常(见表1)。
2.2 血清 SOD活性和 MDA含量的变化 脑缺血再灌注 3h后,血清 SOD活力降低,MDA生成增多并且于再灌注 24h时变化最明显,与正常组及假手术组比较差异有统计学意义(P<0.05),随后与正常组及假手术组的差异逐渐减小,但仍具有统计学意义,再灌注 96h后基本恢复正常(见表2、表3)。
2.3 脑组织 MMP-2表达变化 脑缺血再灌注后 3h、9h、24h、48h和 72h损伤侧脑组织均见明显的MMP-2阳性表达(阳性反应为以细胞膜或浆出现棕黄色颗粒为阳性),主要位于脑血管壁内皮细胞、神经细胞和胶质细胞;再灌注 96h和 120h血管内皮细胞和神经细胞未见明显阳性表达,只是少量胶质细胞仍可见表达。正常组和假手术组均未见 MMP-2阳性表达。
表1 脑组织 EB含量变化 (n=6,±s)

表1 脑组织 EB含量变化 (n=6,±s)
与正常组比较*P<0.05;与假手术组比较 ΔP<0.05
正常组假手术组L/R 0.020±0.0020.022±0.0030.048±0.018*Δ 0.021±0.0010.022±0.0030.067±0.014*Δ 0.021±0.0030.021±0.0020.075±0.015*Δ 0.020±0.0030.022±0.0030.048±0.14*Δ 0.020±0.0020.022±0.0030.063±0.013*Δ 0.021±0.0020.022±0.0020.024±0.0040.020±0.0020.021±0.0020.021±0.002
表2 血清超氧化物岐化酶SOD活性变化(n=6,±s)
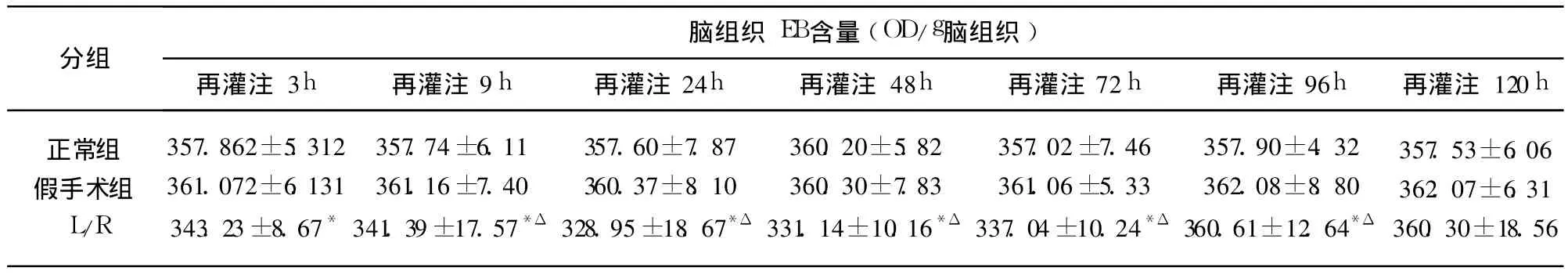
表2 血清超氧化物岐化酶SOD活性变化(n=6,±s)
与正常组比较*P<0.05;与假手术组比较:ΔP<0.05
分组脑组织 EB含量(OD/g脑组织)再灌注 3h 再灌注9h 再灌注24h 再灌注 48h 再灌注72h 再灌注96h 再灌注 120h正常组假手术组L/R 357.862±5.312361.072±6.131343.23±8.67*357.74±6.11361.16±7.40341.39±17.57*Δ 357.60±7.87360.37±8.10328.95±18.67*Δ 360.20±5.82360.30±7.83331.14±10.16*Δ 357.02±7.46361.06±5.33337.04±10.24*Δ 357.90±4.32362.08±8.80360.61±12.64*Δ 357.53±6.06362.07±6.31360.30±18.56
表3 血清 MDA含量(mmol/ml)变化(n=6,±s)
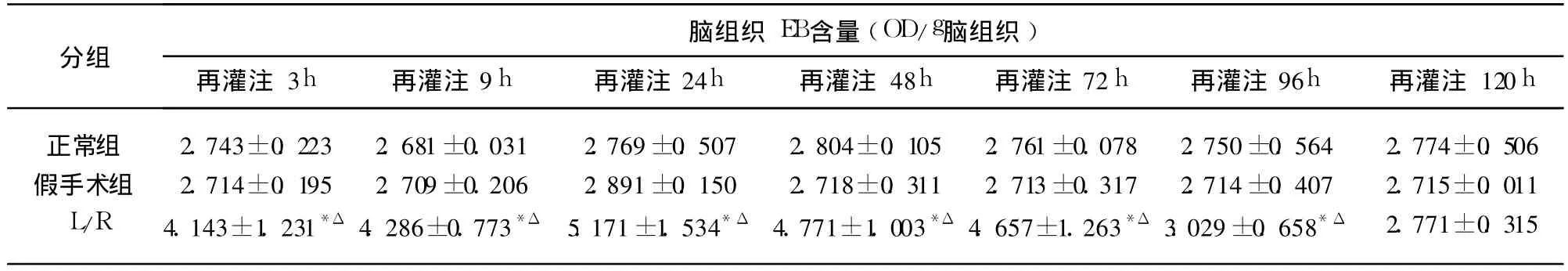
表3 血清 MDA含量(mmol/ml)变化(n=6,±s)
与正常组比较*P<0.05;与假手术组比较 ΔP<0.05
正常组假手术组L/R 2.743±0.2232.714±0.1954.143±1.231*Δ 2.681±0.0312.709±0.2064.286±0.773*Δ 2.769±0.5072.891±0.1505.171±1.534*Δ 2.804±0.1052.718±0.3114.771±1.003*Δ 2.761±0.0782.713±0.3174.657±1.263*Δ 2.750±0.5642.714±0.4073.029±0.658*Δ 2.774±0.5062.715±0.0112.771±0.315
3 讨 论
血脑屏障(BBB)是脑与血液及脑脊液之间的一种屏障,与中枢神经系统的变性、损伤密切相关。脑缺血/再灌注后 BBB通透性增高,造成血管源性脑水肿等一系列脑损伤。EB法作为判断 BBB通透性变化已被逐渐采用。正常情况下,EB不能透过BBB,在脑缺血/再灌注时,BBB通透性增高,EB可通过 BBB,因此脑组织 EB含量值越大表明 BBB通透性越高。本实验观察到 EB含量在再灌注 3h后明显增加,与正常组及假手术组相比差异有显著性(P<0.05),再灌注 24h和 72h两次达到高峰,再灌注96h基本恢复正常(P>0.05)。与刘一沉等通过测量脑组织 EB含量对大鼠 MCAO 2h再灌注后 BBB通透性研究的结果基本上一致,本实验 BBB通透性两次达到高峰的时间分别是再灌注 24h和 72h,与Rosenberg[5]及王社军[6]认为 BBB两次达到高峰的时间分别是再灌注 24h和 48h不一致,有可能是检测方法或实验条件不同所致。
目前认为再灌注所致的 BBB破坏与 OFR密切相关。自由基又称游离基(free radicals),包括氧自由基(OFR)系列和脂质自由基系列。正常生理条件下,机体内可产生少量的氧自由基,并且能被体内存在的超氧化物岐化酶(SOD)、谷胱甘肽过氧化物酶等迅速消除。当脑组织在缺血/再灌注及出血等病理条件下,使体内氧化系统和抗氧化系统平衡失调,引起自由基连锁反应,产生大量的 OFR[7]。OFR寿命很短,仅为 10-9-10-5秒,很难检测其含量的变化,所以通常观察血清 SOD活力及脂质过氧化物产物MDA含量来反映氧自由基的代谢情况,血清 SOD活力降低以及 MDA含量增加均可反映氧自由基生成增多。本实验观察到脑缺血再灌注 3h后,血清 SOD活力降低,MDA生成增多,与正常组及假手术组比较差异有显著性(P<0.05),再灌注 24h时两者变化最明显,随后与正常组及假手术组的差异逐渐减小,但仍具有统计学意义,再灌注 96h后基本恢复正常(P>0.05)。以上结果可以看出 OFR增多与 BBB通透性增高有着密切的关系,两者有相同的时相变化趋势,呈正相关性,表明过量 OFR的产生参与了BBB通透性增高的整个过程,尤其参与其通透性增高的第一次高峰(再灌注 24h)。
脑缺血/再灌注时 OFR损伤 BBB的机制认为是引发脂质的过氧化反应,最终使膜功能受损,从而导致 BBB结构和功能受损[8]。有研究表明再灌注后生成的活性 OFR通过各种信号转导途径上调包括MMP-2在内的多种蛋白酶 mRNA的转录,使它们表达增加[9~11]。MMP-2又称为明胶酶 A,是 MMPs家族的一个亚型,它可以降解 IV型胶原、明胶等,可以广泛降解细胞外基质,破坏血管结构的完整性[12],导致 BBB通透性增高。本实验观察到脑组织 MMP-2的表达伴随着 OFR生成增多和 BBB通透性增高的整个过程,在再灌注 3h、9h、24h、48h和 72均可观察到 MMP-2的表达,96h后表达逐渐减少,正常组和假手术组均未观察其表达,提示 MMP-2的激活与OFR和 BBB通透性增高有着密切的关系。因此,我们认为过量的 OFR还可能通过激活 MMP-2,降解BBB的细胞外基质,引起 BBB通透性增高。
大鼠脑缺血/再灌注时过量 OFR的生成参与了BBB损伤的整个过程,是导致 BBB通透性增高的重要因素,尤其在其通透性增高的早期发挥重要作用,而 MMP-2的激活可能是 OFR损伤 BBB的机制之一。
[1] 徐 运.氧化应激与脑缺血再灌注损伤[J].中国卒中杂志,2008,3(3):195-197.
[2] 陈佳俊,石岩殊,韩雪梅.线栓法大鼠局灶性脑缺血模型(PMCAO)的实验研究[J].吉林医学,2004:25(10):16-17.
[3] Wang CX,Yand Y,Yang T,et al.A focal embolic model of cerebral ischemia in rats:introduction and evaluation[J].Brain Res Protoc,2001,7(2):115-120.
[4] Belayev L,Busto R,Zhao W,et al.Quantitative evaluation of bloodbrain barrier permeability following middlecerebral artery occlusion in rats[J].Brain Res,1996,739(1~2):88-96.
[5] Rosenbery GA,Estrada EY,Encoff JE.Matrix metalloproteinase and TIMPsare associated with BBB opening after reperfusion in rat brain[J].Stroke,1998,29(10):2189-2195.
[6] 王社军,蒋传路,康 军,等.大鼠脑缺血/再灌注后血脑屏障通透性的改变及转移生长因子 β1的表达[J].中华神经外科杂志,2003,19(1):51-54.
[7] 徐 运.氧化应激与脑缺血再灌注损伤[J].中国卒中杂志,2008,3(3):195-197.
[8] 王建峰,刘艳丽 .脑缺血再灌注后影响血脑屏障通透性的因素[J].国际脑血管病杂志,2006,14(12):930-932.
[9] Yong VW,Power C,Forsyth P,et al.Metalloproteinases in biology and pathology of the nervous system[J].Nat Rev Neurosci,2001,2(7):502-511.
[10] Liu S,Liu M,Peterson S,et al.Hydroxyl radical formation is greater in striatal core than in penumbra in a rat model of ischemic stroke[J].JNeurosci Res,2003,71(6):882-888.
[11] Gürsoy-Ozdemir Y,Can A,Dalkara T.Reperfusion-induced oxidative/nitrative injury to neurovascular unit after focal cerebral ischemia[J].Stroke,2004,35(6):1449-1453.
[12] 徐 群,张 毅,苏 敏,等.缺血再灌注脑内 MMP-2、MMP-9与血脑屏障的关系[J].中风与神经疾病杂志,2006,23(2):146-148.
