氧化应激对尿毒症大鼠脑缺血再灌注损伤的影响
2010-08-21孙珉丹宋志宇
陈 志,孙珉丹,宋 东,宋志宇
(吉林大学第一医院,吉林 长春 130021)
氧化应激对尿毒症大鼠脑缺血再灌注损伤的影响
陈 志,孙珉丹,宋 东,宋志宇*
(吉林大学第一医院,吉林 长春 130021)
*通讯作者
近年来慢性肾脏病(CKD)和脑血管病的发病率呈逐年增高趋势,已成为人类面临的严重公共卫生问题[1]。尿毒症是各种原发或继发的慢性肾脏疾病不断恶化、进展的最终阶段,其中心脑血管系统受累最重,是影响尿毒症患者预后的主要因素;在中枢神经系统,尿毒症病人脑血管病的发病率较高,其死亡率即使在透析病人中也占据很大比率。然而,有关尿毒症病人发生脑缺血再灌注损伤后的病理生理变化及其机制尚未见报道。本文以尿毒症大鼠为研究对象,动态观察其发生脑缺血再灌注后脑组织中自由基含量、抗氧化能力的变化以及病理改变,从而明确尿毒症体内长期存在的氧化应激对中枢神经系统的影响,为临床治疗尿毒症合并缺血性脑血管病提供新的理论依据。
1 材料与方法
1.1 实验动物 清洁级健康雄性Wistar大鼠30只,体重250-280 g,实验室条件适应性喂养1周,术前自由进食饮水,随机分为单纯尿毒症组(CRF组)6只、尿毒症合并脑缺血再灌注组(CRF+I/R组)24只,制备尿毒症模型,成模后,再取同样大鼠30只,随机分为正常对照组(N组)6只、单纯脑缺血再灌注组(I/R组)24只。所有4组大鼠中,除N组和CRF组外,其余两组大鼠再制作大脑中动脉栓塞模型。脑缺血2小时后再灌注,按再灌注后不同时间点(0 h 、2 h、12 h、24 h)I/R 组 、CRF+I/R 组又分为4个亚组,每个亚组6只。参照文献方法[2,3],制备5/6肾切除尿毒症大鼠模型及大鼠大脑中动脉栓塞再灌注(MCAO)模型。实验过程中,手术不成功、造模失败及24 h内死亡的大鼠均弃之不用。用同一批次的大鼠制成合格模型后补足数目。
1.2 取材 每个亚组及N组、CRF组各取6只大鼠,在冰水浴中用玻璃匀浆器制成10%的脑匀浆,用离心机3 000 r/min,离心15 min,取上清液用于检测丙二醛(MDA)、超氧化物歧化酶(SOD)。
1.3 比色法检测脑组织匀浆中MDA、SOD 严格按试剂盒说明书操作(购自南京建成生物工程研究所),并按公式计算MDA含量和SOD活力。
1.4 统计学方法 采用SPSS16.0版统计软件进行资料分析,所有数据以±s表示,多样本均数比较用方差分析,两两比较采用SNK法,两样本均数比较用t检验,P<0.05作为显著性差异的界值。
2 结果
2.1 MDA、SOD的变化 与N组相比,CRF组大鼠脑组织中SOD活力降低,MDA含量升高,但无统计学差异(P>0.05);与I/R组各时间点相比,CRF组大鼠SOD活力均升高,MDA含量下降,且均有显著差异(P<0.05)。发生再灌注损伤的两组大鼠脑组织在再灌注后0-24 h之间SOD活力均呈逐渐下降趋势,MDA含量则呈上升趋势,CRF+I/R组各时间点SOD活力均较其余三组明显下降,MDA含量明显升高(P<0.05)。(见表1、2)
3 讨论
表1 各组大鼠不同时间点 MDA的变化(μ mol/g,±s,n=6)
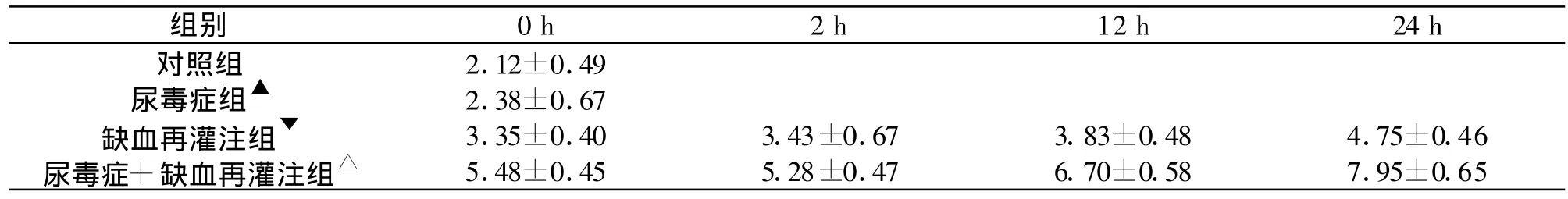
表1 各组大鼠不同时间点 MDA的变化(μ mol/g,±s,n=6)
▲尿毒症组与对照组相比,无显著差异(P>0.05);▼缺血再灌注组各时间点与尿毒症组相比,有显著差异(P<0.05);△尿毒症+缺血再灌注组各时间点与各组相比,均有显著性差异(P<0.05)。下同。
组别 0 h 2 h 12 h 24 h对照组 2.12±0.49尿毒症组▲ 2.38±0.67缺血再灌注组▼ 3.35±0.40 3.43±0.67 3.83±0.48 4.75±0.46尿毒症+缺血再灌注组△ 5.48±0.45 5.28±0.47 6.70±0.58 7.95±0.65
大量动物实验和临床资料都证实,氧自由基(ROS)参与了脑缺血再灌注的损伤过程[4,5]。生理条件下,ROS的生成和清除能保持平衡,机体产生的少量自由基可被机体较强的防御系统所抑制,不致引起病理效应。这些防御系统包括:自由基生成抑制剂,如过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)等及清除自由基的抗氧化物,如维生素C、维生素E等。病理情况下,自由基产生增多,而自由基清除酶活性下降,抗氧化物减少,使增多的自由基通过一系列的过氧化反应造成组织细胞的损伤,这些损伤包括脂质、蛋白质、核酸的过氧化,其中主要损害是产生脂质过氧化物,再经过氧化物酶分解成丙二醛(MDA),MDA可使磷脂、蛋白质、核酸发生交联、变性,产生脂褐素堆积在细胞,促使细胞结构和功能的破坏[6]。由于MDA是细胞内脂质过氧化反应的最终产物,化学性质稳定,且其含量能够体现组织细胞中的含量,因此常用来反映脂质过氧化损伤的程度。在自由基防御体系,SOD是主要存在于细胞浆和线粒体内的一种金属蛋白酶,对机体的氧化与抗氧化平衡起着至关重要的作用,被认为是防御自由基的第一道防线[7],能催化O2-◦转变为H2O2的歧化反应,清除引发自由基连锁反应的起始基O2-◦。GSH-PX几乎在所有组织中分布,是机体内广泛存在的一种重要的催化H2O2分解的酶,它特异地催化还原型谷胱甘肽对H2O2的还原反应[8]。H2O2是半衰期最长的,被认为是ROS主要的氧化信号介导者。有实验证实[9],外源性GSH能完整通过血脑屏障进入脑组织,一般认为它在细胞内能清除有害的过氧化物代谢产物,阻断脂质过氧化链锁反应,从而起到保护细胞膜结构和功能完整的作用。在脑内含有高浓度的GSH-PX,几乎不含过氧化氢酶,因此,主要通过GSH-PX来清除脑内的H2O2。发生脑缺血再灌注后,氧一方面在黄嘌呤氧化酶作用下产生新的氧自由基,同时又使原来因氧耗竭而停滞的氧自由基向脂质过氧化物转化的过程得以继续,从而加重了细胞损伤[10]。本研究中,除正常对照组外,其余三组大鼠脑组织中MDA含量均不同程度升高,并且与再灌注的时间呈正相关,相应的SOD、GSH-PX活性在三组中都下降。其中,单纯尿毒症组大鼠发生的氧化反应最轻,单纯脑缺血再灌注组次之,而尿毒症合并脑缺血再灌注组的氧化应激反应最重。尿毒症患者体内长期处于高氧化水平已经是一个不争的事实,由于尿毒症病人肾小球滤过功能、肾小管重吸收功能均不同程度丧失,导致体内氧化产物过多积聚,氧化产物和还原物质之间固有的平衡被打破,氧化过程相对占优势,其后果之一就是动脉粥样硬化加重,从而发生严重的心脑血管事件,这也是尿毒症病人易发生脑血管疾病的原因之一,也是尿毒症病人合并脑血管病高死亡率的原因之一。但对于尿毒症合并脑缺血再灌注损伤后的病理生理改变目前尚未查到文献报道。在我们的研究中,单纯尿毒症组大鼠的脑组织中过氧化物的含量高于正常,其抗氧化物质减少,活性降低,表明尿毒症大鼠体内长期存在的氧化应激对神经系统的影响,只是氧化应激的强度较脑缺血再灌注组弱;而尿毒症并脑缺血再灌注损伤组大鼠脑组织受到的过氧化损害明显重于单纯脑缺血再灌注组和单纯尿毒症组,自身的抗氧化能力下降明显,提示尿毒症的氧化应激加重了脑缺血再灌注损伤,表明对尿毒症患者长期给予抗氧化治疗的必要性和重要性。
表2 各组大鼠不同时间点 SOD的变化(U/mg)(±s,n=6)

表2 各组大鼠不同时间点 SOD的变化(U/mg)(±s,n=6)
组别 0 h 2 h 12 h 24 h对照组 239.83±16.79尿毒症组▲ 239.50±13.05缺血再灌注组▼ 119.83±10.65 114.67±10.17 102.67±8.09 95.17±6.71尿毒症+缺血再灌注组△ 93.00±5.93 92.17±5.31 80.83±6.49 67.67±5.16
[1]Schiepptai A,Remuzzi G.Chronic renal disease as a public health problem:Epidemiology,social and economic implications[J].Kidney Int Suppl,2005,98:S7.
[2]Node M.Effect of candesartan cilexetil in rats with chronic renal failure[J].Kidney Int,1999,56(3):898.
[3]Longa EZ,Weinstain PR,Carlson S,et al.Reversible middle cerebral artery occlusion without cranietony in rats[J].Stroke,1989,20(1):84.
[4]Iadecola C,Alexander M.Cerebral ischemia and inflammation[J].Curr Opin Neurol,2001,14(1):89.
[5]Matsumoto K,Lo EH,Pierce AR,et al.Secondary elevation of extra cellular neuro transmitter aminoacids in the reperfusion phase following focal cerebral ischemia[J].J Cereb Blood Flow Metab,1996,16(1):114.
[6]Vilan N,Castillo J,DavalosA,et al.Proinflammatory cytokines and early neurological worsening in ischemic stroke[J].Stroke,2000,31(10):2325.
[7]Vaziri ND.Role of oxidative stress and antioxidant therapy in chronic kidney disease and hypertension[J].Currop in Nephrol Hypertens,2004,13:93.
[8]Margaill I,Plotkine M,Lerouet D.Antioxdent strategies in the treatment of stroke[J].Free Radic Bio Med,2005,39:429.
[9]Sakanak M,WenTC,Matsuda S,et al.In vivo evidence that erythropoietin protects neurons from ischemic damage[J].Proc Natl Acad Sci USA,1998,95:4635
[10]方舒东,朱也森.脑缺血再灌注损伤的病理生理研究进展[J].医学综述,2006:12(18):4111.
1007-4287(2010)09-1384-02
2009-11-18)
