模拟高住低练对大鼠外周血内皮祖细胞增殖能力的影响
2010-08-20龚晓明郑澜瞿树林雷志军凡婷陈伊琳
龚晓明 郑澜 瞿树林 雷志军 凡婷 陈伊琳
湖南师范大学体育学院(湖南长沙 410012)
低氧训练可促进心肌血管新生,这种改变可能是有氧运动能力提高的重要原因[1]。目前低氧运动促进血管新生的机制尚不清楚。前期研究已证实,低氧训练后心肌组织呈现丰富套叠式血管新生的形态学特征[2],由于成熟的血管内皮细胞(endothelial cells,ECs)分裂、增殖能力有限,因此推测是具有分化为血管ECs功能的某些干细胞,如内皮祖细胞(endothelial progenitor cells,EPCs)参与了作用。通过对大鼠进行低氧训练,发现其心肌血管壁上的AC133(又称CD133)蛋白表达较对照组多[3],AC133是早期EPCs的特异性表面标记物,晚期EPCs和ECs不表达[4],而EPCs在某些生理、病理状态下可通过骨髓释放入血或自身复制的方式,黏附于血管内皮,不断增殖、分化形成单层内皮结构,参与微血管再生[5-7],因此提示有较多的EPCs归巢于心肌血管壁。本研究通过探讨低氧和运动复合刺激是否可以促进循环中的EPCs增殖,从而提高血管内皮修复能力和血管再生能力,为低氧训练心肌组织血管新生机理的研究提供实验资料。
1 材料与方法
1.1 动物及分组
健康雄性2月龄Sprague-Daw ley大鼠24只,每只体重约200g(由湖南农业大学提供)。用国家标准啮齿类动物饲料饲养,生活期间室温保持20℃~23℃,相对湿度45~55%,每天光照12h。适应性喂养1周后,随机分为4组,即常氧居住组(LL)、低氧居住组(LH)、常氧训练组(LLTL)和高住低练组(LHTL),每组6只。LL组和LLTL组常氧环境下居住(训练),LH组和LHTL组低氧环境居住,12h/d。
1.2 运动训练安排
采用杭州立泰科技有限公司动物实验跑台,对训练大鼠进行递增负荷跑台运动训练,坡度为10%。每周训练6天,共持续8周(训练方案见表1)。
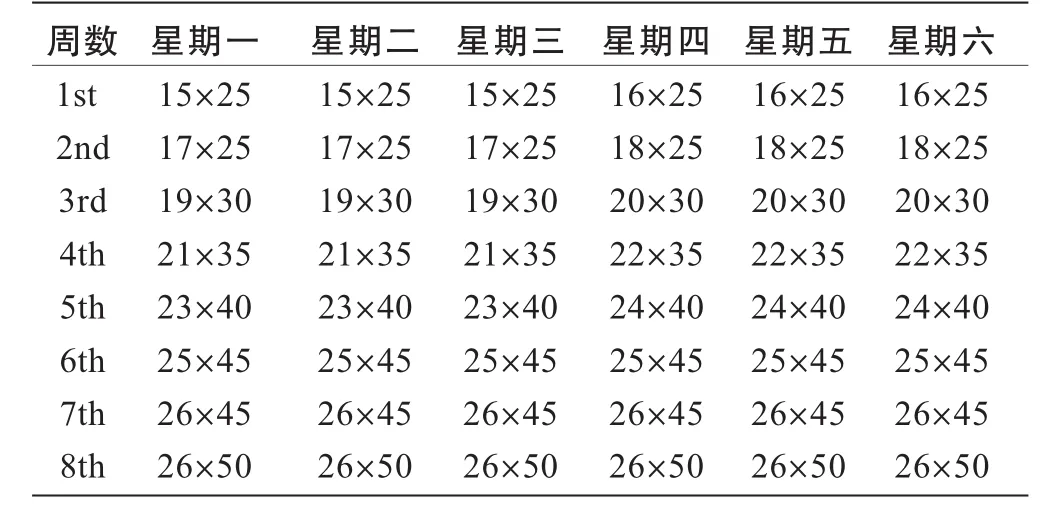
表1 大鼠训练方案(速度m/min×持续时间min)
1.3 低氧处理
采用美国Hypoxico公司的低氧装置,用美国产TOXIRAE PGM-36型氧气监测仪实时监测低氧舱中氧含量的变化。根据所需高度对应的氧浓度调整氧气监测仪,从第1周至第7周,氧浓度依次为17.0%、16.5%、15.8%、15.3%、14.5%、14.0%、13.5%,分别对应海拔1800m、2100m、2400m、2700m、3000m、3300m、3600m,第8周与第7周相同。
1.4 实验取材
训练结束后12h,用0.4%水合氯醛lm l/100g体重麻醉大鼠后,70%的酒精中浸泡1min(除头部),将大鼠呈仰卧位固定于超净工作台内,暴露胸腔;从后腔静脉近心端插入内壁涂有1%肝素钠的无菌引流管,管的另一端接内壁涂有1%肝素钠的注射器(5m l),快速抽吸血液5m l,再将血液移入无菌试管。
1.5 EPCs分离培养及诱导分化
将以上获得的血液用PBS1∶1稀释,以2∶3比例在离心管内依次加入大鼠淋巴细胞分离液(中国医学科学院生物工程研究所)和血液混合液,22℃下2000r/min离心20min,用吸管收集中间白膜层的单个核细胞(Mononuclear cells,MNCs)。0.01mol/L PBS 液洗涤 2次,依次以2000r/min及1500r/min室温离心10min。用含M199培养基(Gibco,美国)、20%FBS(杭州四季青),血管内皮生长因子(VEGF,Pepro Tech,美国)10ng/m l,成纤维细胞生长因子 (bFGF,Pepro Tech,美国)2ng/m l,青霉素100U/m l,链霉素100μg/m l的M199条件培养液调整细胞密度至3×106/m l接种于培养瓶,置于5%CO2、饱和湿度、37℃培养箱中培养48h后更换培养液,去除未贴壁细胞,之后每3天换液一次,应用相差倒置显微镜(Olympus,日本)连续观察体外培养EPCs的形态及增殖情况。
1.6 EPCs的双荧光染色鉴定
培养约7d后,细胞与2.4μg/m l DiI标记的乙酰化低密度脂蛋白(Dil-ac-LDL,Invitrogen公司,美国)在37℃下孵育12h以检测EPCs对Dil-ac-LDL的摄取。然后用2%多聚甲醛固定细胞10min,再用PBS液洗涤2次,再将10μg/m l FITC 标记荆豆凝集素 1(FITC-UEA-1,简称lectin,Sigma公司,美国)加于上述标本 37℃下孵育1h,用PBS液洗涤2次。在荧光显微镜(Nikon,A lpha Innotech Corporation,日本)下观察,显示红色荧光的细胞为ac-LDL阳性,显示绿色荧光的细胞为UEA-1阳性,染色双阳性细胞呈黄色荧光为正在分化的EPCs。
1.7 EPCs增殖能力检测
贴壁细胞计数:细胞培养48h后换液,每个样本随机取5个视野,倒置显微镜下计数贴壁细胞数目(×100),绘制柱状图。
细胞集落计数:细胞培养至第7天,每个样本随机取3个视野,倒置显微镜下计数细胞集落数目(×100),绘制柱状图。
1.8 统计学分析
所得数据用SPSS17.0统计软件处理。每组样本测得数据均进行正态分布检验(One-Sample Kolmogorov-Smirnov Test)。服从正态分布(P>0.1)的数据以平均值±标准差()表示,组间的两两比较采用单因素方差分析(One-Way ANOVA),方差齐性用 LSD检验,方差不齐用Tamhane’s T2检验;不服从正态分布的数据,根据其特点进行数据变换,变换后数据服从正态分布按正态分布数据进行统计分析(方法同前),变换后仍不服从正态分布则采用中位数±四分位数表示,组间比较采用多样本秩和检验(K-Related Samples)。差异显著性水平α=0.05,P<0.05为有显著性差异,P<0.01为有高度显著性差异。
2 结果
2.1 形态学观察结果
外周血分离后获得的单个核细胞于100m l培养瓶中呈较密集的多层圆形悬浮颗粒(图1a)。在接种48h后半量换液,见大部分细胞已贴壁,并有少量贴壁的梭形细胞,表明细胞开始进入贴壁生长阶段(图1b)。第5~7天开始,贴壁细胞形成大小不一的多个细胞克隆,即集落生成单位(colony-forming unit,CFU)出现(图 1c箭头所示),此时细胞增殖开始活跃。第10天细胞克隆明显增多,彼此相连并聚集于培养瓶中间区域生长(图1d)。第12天观察细胞克隆与第10天在克隆细胞形态及贴壁梭形细胞密度 上大致相似,此阶段细胞增殖缓慢,进入平台期。

2.2 双荧光染色鉴定结果
荧光显微镜下见Dil-ac-LDL染色细胞发红色荧光,FITC-UEA-1发绿色荧光,两者双染阳性为正在分化的EPCs,呈黄色荧光(图 2)。

2.3 EPCs增殖能力检测结果
培养48h换液后,LH、LLTL和LHTL组贴壁细胞数量与 LL组相比均显著增加(P<0.05,P<0.01),LHTL组贴壁细胞数量显著多于LH、LLTL组(P<0.01),而LH组和LLTL组之间无显著性差异(P>0.05)(图3)。

培养至第7天,LH、LLTL和LHTL组与LL组相比,细胞形成的早期集落数目更多(P<0.01);而LHTL组集落数目显著多于LH、LLTL组(P<0.01)。另外,LLTL组形成的集落数多于LH组(P<0.01)(图4)。

3 讨论
机体EPCs有两种类型,早期EPCs来自外周血单个核细胞,呈梭形,在培养到2~3周时达到生长高峰,第4周时逐渐死亡消失;晚期EPCs主要来源于骨髓单个核细胞,少量存在于外周血中,呈鹅卵石形,在培养的第2~4周时其细胞集落出现在早期EPCs中间,在4~8周呈指数生长,于第12周时逐渐死亡消失[5]。本研究通过形态学和双荧光染色鉴定,证明我们阐述的应当是早期EPCs,至于其中是否含有骨髓释放入血的晚期EPCs,有待进一步研究。
本实验证实了运动可使健康大鼠外周血EPCs增殖能力增强,数量增多,这与Steiner等人的研究结果有相似之处。他们研究发现体力训练可以增加冠心病患者和有心血管病危险因素者的 EPCs 数量[8],但 Christian[9]等通过采用流式细胞术检测人外周血EPCs的CD34和CD133表达阳性率证实,运动并不会使外周血EPCs数量增多,这可能与模型建立有关。本实验大鼠进行的跑台训练长达8周,而Christian等人是抽取每周锻炼时间低于3h和高于3h的人群作为对照组和实验组,对于受试者锻炼的时程、频率和方式等并未提及。另有学者研究发现,低氧可以诱导EPCs增殖并向ECs分化,从而促进血管生成[10]。姜萌[11]等在人外周血 EPCs中导入人低氧诱导因子 -1α(HIF-1α)基因,发现经体外 HIF-1α 转染后的EPCs扩增及迁移功能改善,在体内可促进缺血下肢的局部血管新生。这与本实验发现的低氧促进EPCs的增殖相吻合。而运动对EPCs增殖能力的提高在EPCs体外培养较短时间内与低氧对其增殖的影响是没有区别的,随着时间延长,运动引起EPCs的增殖较单纯低氧刺激明显,可能是运动对EPCs影响的作用时间更长,也可能是低氧导致 HIF-1α 聚集促进了 EPCs的凋亡[12-14]。本研究结果还表明,在对EPCs进行体外培养的14天内,低氧与运动复合刺激对EPCs增殖能力的影响最明显,一方面证明了高住低练模型建立的科学性,另一方面为高住低练促进血管新生的机制研究提供了部分证据。
此外,本实验还发现,低氧组和训练组细胞出现CFUs要比对照组早1~2天,尤其是LHTL组细胞一般在培养至第5天就出现了,提示低氧和运动可能会促进EPCs的黏附,促使内皮结构更早形成。另外,在前期预实验中的第20天左右,贴壁细胞大量融合,晚期集落形成,管腔样结构出现,低氧组和训练组的管腔样结构明显比常氧居住组多,空泡样细胞(死亡细胞)少,这可能跟低氧和运动引起细胞分泌的生长因子数量及活性有关。低氧与运动复合刺激虽然比单纯的低氧或运动更能促进EPCs增殖,但它对EPCs的分化、衰老、凋亡等一系列直接反应内皮功能的因素有何影响,仍需进一步研究。
4 总结
持续8周的递增负荷运动与间隙性低氧刺激都能促进EPCs的增殖;低氧或运动单纯刺激对EPCs增殖的影响作用在体外培养短时间内(48h)是无差别的,随着培养时间的延长(7d内),运动对EPCs增殖能力的促进作用优于低氧刺激;另外,低氧和运动复合刺激下,EPCs表现出较单纯低氧或单纯运动时更强的增殖能力。
(特别感谢湖南师范大学生命科学院吴秀山教授、湖南师范大学医学院杨华中和任翔老师、中南大学湘雅医学院中心实验室祝和成教授及吴尚辉老师在作者实验过程中给予的指导和支持!)
[1]郑澜,陆爱云,周志宏.低氧训练促进大鼠心肌组织血管生成的体视学研究.体育科学,2005,25(9):49-52.
[2]郑澜.低氧运动促进肌组织血管生成的机制.北京:北京体育大学出版社,2006,94-96.
[3]郑澜,杨小波,刘铭,等.低氧训练对大鼠心肌组织血管内皮祖细胞标记AC133表达的影响.中国运动医学杂志,2009,28(2):139-141.
[4]Yin AH,miraglia S,Zanjani ED,et al.AC133,a novelmarker for human hematopoietic stem and progenitor cells.Blood,1997,90:5002-5012.
[5]Jin H,Chang Hwan Y,Hyo Soo K,et al.Characterization of two types of Endothelial progenitor cells and their different contribution to neovasculogenesis.Arterioscler Thromb Vasc Biol,2004,24(2):288-293.
[6]Sandri M,Adams V,Gielen S,et al.Effects of exercise and ischemia on mobilization and functional activation of bloodderived progenitor cells in patients w ith ischemic syndromes results of 3 randomized studies.Circulation,2005,111:3391-3399.
[7]Arbab AS,Pandit SD,Anderson SA,et al.MRI and confocal microscopy studies of magnetically labeled endothelial progenitorcells trafficking to sites of tumor angiogenesis.Stem Cells,2006,24(3):671-678.
[8]Steiner S,Niessner A,Richter B,et al.Exercise training increases the number of endothelial progenitor cells in patients w ith coronary hear.JACC,2004,3:445A.
[9]Jung C,Fischer N,Fritzenwanger M,et al.Endothelial progenitor cells in adolescents:impact of overweight,age,smoking,sport and cytokines in younger age.Clin Res Cardiol,2009,98:179-188.
[10]Fong GH.Mechanisms of adaptive angiogenesis to tissue hypoxia.Angiogenesis,2008,11:121-140.
[11]姜萌,王彬尧,王长谦,等.低氧诱导因子修饰内皮祖细胞促血管新生的研究.心脏杂志,2007,19(5):497-501.
[12]Matsushita H,Morishita R,Nata T,et al.Hypoxia-induced endothelial apoptosis through nuclear factor-kappa B(NF-kappa B)-mediated bcl-2 suppression:in vivo evidence of the importance of NF-kappa B in endothelial cell regulation.Circ Res,2000,86(9):974-981.
[13]Zhang H,Semenza GL.The expanding universe of hypoxia.JMol Med,2008,86:739-746.
[14]Ikeda Y,Fukuda N,Wada M,et al.Development of angiogenic cell and gene therapy by transplantation of umbilical cord blood w ith vascular endothelial grow th factor gene.Hypertens Res,2004,27(2):119-128.
