胃癌根治术后肠内营养与肠外营养的早期临床效果比较
2010-08-08李雪飞
李雪飞
胃体及胃上部癌全胃切除术手术范围广,手术创伤大,饮食恢复晚,术后营养支持对患者围手术期康复和并发症控制至关重要[1]。我科将2006年1月至2009年12月收治的60例行胃癌根治术的患者随机分为肠内营养(EN)组及肠外营养(PN)组,比较两种营养支持措施对其早期临床恢复的影响。现将结果报道如下。
1 临床资料
1.1 筛选标准 纳入标准:(1)经胃镜及病理检查证实为进展期胃癌患者;(2)接受胃癌根治术。排除标准:①术前根据营养状况评定法测定为恶病质的患者;②存在明显肝肾功能障碍;③合并代谢性疾病,如糖尿病等。2006年1月~2009年12月我科收治胃癌患者97例,符合上述标准患者共60例。
1.2 一般资料 将60例患者随机分为两组,EN组30例,其中男18例,女12例,平均年龄为(56±14.6)岁;PN组30例,其中男20例,女10例,平均年龄为(57±13.7)岁。60例患者者均接受了手术治疗,其中20例行D1手术,Ⅰ式吻合; 40例行D2手术,Ⅱ式吻合。EN组30例均接受空肠造瘘术。两组病例在年龄、性别、体质量、手术吻合方式、病理分期等方面差异无统计学意义(P>0.05)。
1.3 营养支持方法
1.3.1 PN组 手术后第1天开始通过中心静脉及外周血管,连续密闭输液法24h均匀输入营养液。营养液在无菌条件下配制,2000ml营养液内含有葡萄糖、复方氨基酸、电解质、微量元素及多种维生素,同时每日输入250ml20%英托利匹特脂肪乳剂。通过营养液每天每公斤体重提供1.2g蛋白质,105~126KJ的热量,同时监测各项参数以保证输入液的质量适合病人的需要。
1.3.2 EN组 术后第一天采用全肠外营养治疗,术后第二天患者生命体征稳定,肠功能恢复,经空肠造瘘管滴注生理盐水或5%葡萄糖200~500ml,若无不适,于次日停用肠外营养,营养物质由经空肠造瘘管供应,短肽型肠内营养混悬液(商品名百普力,无锡纽迪希亚公司生产),每天滴入1000~1500ml,并辅以米汤500ml、20%~25%果汁500ml,每天每公斤体重提供1.5g蛋白质,105~126kJ的热量。营养液温度控制在37.0℃左右,营养液以20~100ml/h的速度持续滴入,以先慢后快、先稀后浓为原则,容量及热量根据患者的耐受性调节。在输注营养液期间,每3日测1次血糖、尿糖、电解质、尿素氮的变化,以便及时调整营养液的成分、浓度及滴入速度,确保肠内营养(EN)治疗的顺利进行。一周后开始经口进少量流食、半流饮食并逐渐增加口服量,减少经空肠造瘘管输注量,直到停止,完全由口服维持营养。
1.4 观察评价指标及测定时间 分别于术前、术后10d测定体重、血红蛋白、血清白蛋白、前白蛋白和转铁蛋白等营养指标。观察两组患者术后胃肠道功能恢复情况,评估手术并发症 (切口感染、吻合口瘘等)和切口愈合情况,比较两组患者的住院时间。
1.5 统计学方法 对所得数据应用SAS统计软件分析,计数资料比较采用x2检验,计量资料的组间比较采用t检验。P<0.05为差异有统计学意义。
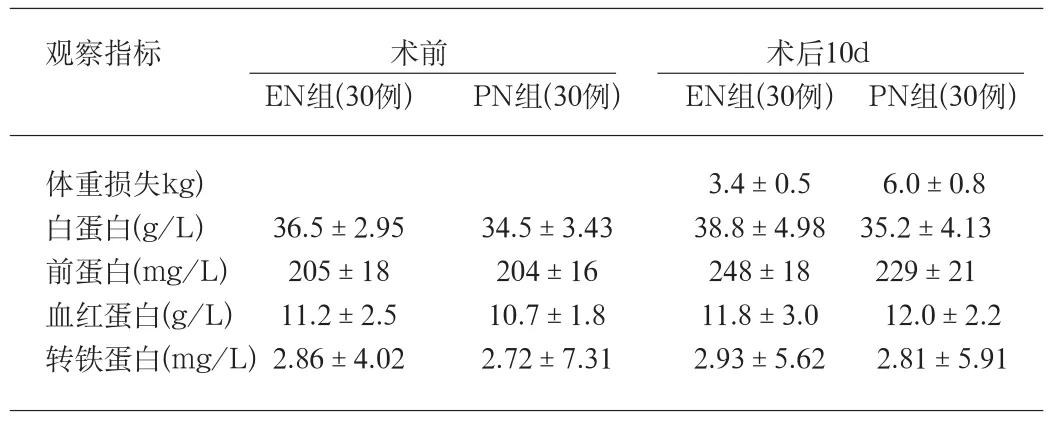
表1 两组营养支持前后患者营养状况指标的变化

表2 两组患者术后恢复情况及手术相关并发症比较
2 结果
2.1 营养指标 两组患者均按计划完成治疗。EN组术后10d体重损失较TPN组明显减少(P<0.01)。术前两组的血红蛋白,血清白蛋白,前白蛋白和转铁蛋白的含量无统计学差异。术后10d 4种蛋白水平较术前均升高,且EN组升高更为显著。10d时,EN组血清蛋白和前蛋白平均水平均显著高于PN组(P<0.05)。EN组血红蛋白,平均水平亦高于PN组,但差异无统计学意义(P>0.05) (表1) 。
2.2 术后恢复情况及手术相关并发症 术后肛门排气时间,EN组为(54.2±7.2)h,PN组为(74.8±16.8)h,两组比较差异显著(P<0.01);术后住院时间EN组为(16.25±6.12)d,PN组为(23.16±16.28)d,两组比较差异显著(P<0.01);TPN组的深静脉导管的感染率较EN组明显升高,组间差异有统计学意义(P<0.05);两组间其他并发症的发生率差异无统计学意义(P>0.05),见表2。
3 讨论
胃体及胃上部癌为了达到根治的目的常需施行全胃切除术。全胃切除术手术范围大,食管-空肠吻合口漏的发生率相对较高,因此在手术后到完全经口饮食之间,提供足够的营养物质以满足创伤代谢需要,使其顺利度过手术应激期,促进吻合口愈合非常重要[2]。传统观念认为只有胃肠道功能恢复正常以后才能对患者进行肠内营养支持,有研究证明胃的功能在术后1~12天恢复正常,大肠的功能于术后3~5天恢复正常,而小肠的蠕动、消化、吸收功能在腹部手术后6~12小时已经恢复[3-4]。另有研究表明禁食1周后消化道质量将减少50%,即使行全肠外营养(TPN)亦表现为肠黏膜萎缩、活动度降低,其细胞蛋白质、DNA和RNA含量降低,肠黏膜屏障功能受损,肠内菌群失调。本研究中,于胃癌术后24h即早期应用EN,结果表明,所有病人均能耐受并完成试验,无严重并发症发生,而且肠道功能恢复比较对照组显著提前(P<0.01),提示术后早期肠内营养是可行且安全的。
能否改善机体的营养状态是衡量营养支持是否有效的重要指标[5-6]。术后早期肠内营养能满足术后应激时营养物质的需要,防止因吸收功能障碍而进一步加重营养不良,纠正已存在的营养缺乏。手术创伤后病人易合并代谢受损,EN治疗能提供充足而均衡的热量和蛋白质等营养底物,经肠道和门静脉吸收,满足术后恢复的代谢需要,减少了对机体自身蛋白质以及其他组织成分的分解,有利于促进患者蛋白质合成增加和功能恢复[7]。我们在研究中分别测定了两组病人支持前后的体重、血红蛋白、血浆总蛋白、白蛋白等营养指标的变化情况,结果显示两组的术后营养指标较术前有所增加,但EN组的增加程度较对PN高,说明术后早期肠内营养支持更能有利于维持机体营养状态,补充手术创伤后所需的能量, 减少体重、蛋白的丢失幅度。
综上所述,行根治性全胃切除术后的胃癌病人,早期应用EN是安全的,而且比PN更能够改善营养状况,减少并发症的发生率,减少住院时间。早期EN是胃癌根治术后理想的营养支持方式,值得临床推广应用。
[1]黎介寿.围手术营养支持的需要性[J].肠外与肠内营养,2006,13(3):129-131.
[2]许剑民.胃肠道肿瘤患者术前肠内营养支持[J].中华消化杂志,2005,25(1):19-22.
[3]李宁,黎介寿.肠内营养近20年的进展和展望[J].中国实用外科杂志,2002,22(1):628.
[4]Chen da W,Wei Fei Z,Zhang YC,et al. Role of enteral immunonutrition in patients with gastric carci-noma undergoing major surgery[J].Asian J Surg,2005,28(2):121-124.
[5]曹景玉,吴力群,郭卫东,等.早期肠内营养对肝切除患者术后恢复情况的影响[J].中国普通外科杂志,2009,18(1):103-105.
[6]邓鑫,赵毅,崔钊,等.早期肠内营养在全胃切除术后的应用[J].中国实用外科杂志,2008,28(9):76.
[7]黎介寿.围手术营养支持的需要性[J].肠外与肠内营养,2006,13(3):129-131.
