灵丹菌质双向发酵工艺及药效品质研究*
2010-08-08许晓燕郑林用余梦瑶
许晓燕,郑林用,李 艳,江 南,余梦瑶,罗 霞**
(1.四川省中医药科学院中药细胞与分子生物学实验室,四川 成都 610041;2.四川省农业科学院,四川 成都 610066;3.成都市经济信息中心,四川 成都 610041)
灵芝(Ganoderma lucidum)是一种广泛应用的药、食兼用真菌,具有促进睡眠、缓解机体疲劳、抗肿瘤、调节免疫、抗HIV等功效[1]。近年来,庄毅等提出用现代生物技术来改造灵芝等药用真菌,即 “药用真菌新型固体发酵工程”,在发酵基质中增用具有活性成分的各种中药材作为药性基质,使发酵的作用不仅是提供营养成分,而且因真菌的分解和合成作用产生新的成分,使其性质发生变化,从而使药用真菌和中药材原有功效增强,甚至可以产生新的性味、功能,这就具有双向性,其发酵产物称为菌质[2]。
丹参,为唇形科鼠尾草属丹参 (Salvia miltiorrhiza Bge.)的干燥根及根茎,始载于 《神农本草经》,列为上品,具有活血调经、祛瘀生新、镇静安神、凉血消痛、消肿止痛等功效。在丹参采摘、加工过程中,除去入药的部分,会产生大量的废弃。现代研究表明,边角料中具有与药材相似的化学成分,只是含量较低,将其直接废弃,不仅对环境造成污染,而且浪费了大量具有潜在价值的资源。
本论文采用新型(双向性)固体发酵工程技术,以灵芝为发酵菌株,在其培养基中增添丹参边角料,通过培养基优化,初步建立灵丹菌质的生产工艺,并检测灵丹菌质的理化指标(蛋白质、多糖、三萜等),开展其活血化瘀的药效学研究,旨在为现代菌物药的研发提供一种新材料。
1 材料与方法
1.1 试验材料
1.1.1 试验菌株
美国大灵芝(Ganoderma sp.),中国农大生物学院食用菌研究室提供。
1.1.2 试验药材
丹参边角料,购自四川省中江县;丹参药材,购自四川省成都市中药材市场。
1.1.3 试验动物
昆明种小鼠,由四川省中医药科学院实验动物中心提供(川实质第2002-33号)。
1.1.4 主要试剂
蒽酮(上海化学试剂采购供应五联化工厂);考马斯亮蓝G-250(上海朗瑞精细化学品有限公司);丹参酮ⅡA、齐墩果酸(中国药品生物制定鉴定所)。
1.1.5 主要仪器
智能光照培养箱,型号:ZGX-300C,杭州钱龙仪器设备有限公司;紫外分光光度计,型号:T6新世纪,北京普析通用仪器有限责任公司;HPLC系统,型号:Waters 1525,Waters公司;Syncore多样品定量浓缩仪,瑞士Buchi。
1.2 试验方法
1.2.1 发酵样品制备
灵丹菌质不同发酵组合培养基配方见表1。

表1 灵丹菌质不同发酵组合培养基配方比例
按表1配置各组合固体发酵培养基,控制含水量在60%左右,分装入袋,115℃灭菌3 h,冷却后,接入灵芝斜面菌丝(以长度1.0 cm菌丝体为标准),于恒温 (27±2)℃进行发酵培养。
1.2.2 菌丝体日平均生长速度观察
从菌丝体萌发起,记录发酵过程中灵芝菌丝体在各组合培养基质上的平均生长速度。
1.2.3 灵丹菌质多糖、蛋白质和三萜测定
多糖含量测定采用2005版药典规定方法[3]硫酸-蒽酮法,蛋白质含量测定采用考马斯亮蓝法,三萜含量测定采用草醛冰醋酸-高氯酸显色法[4]。
1.2.4 灵丹菌质丹参酮IIA含量的HPLC分析
HPLC条件为检测流动相:甲醇∶水=75∶25;检测温度:30℃; 进样量为20 μL; 流速:1 mL·min-1; 检测波长 270 nm。检测方法为取菌质粉末0.1 g,加入10 mL甲醇,封闭试管口,超声提取10 min,静置过夜,HPLC测定。
1.2.5 试药制备
(1)水提:取定量样品,加10倍蒸馏水,90℃水浴2.5 h,3000 r·min-1离心30 min,取上清;沉淀再加5倍水、3倍水,同法热提2次;收集3次热提所得上清液。
(2)醇提:向水提后的样品中加入2倍体积的95%乙醇,超声提取 3 h,3000 r·min-1离心30 min,收集上清液,旋转蒸发至结晶。
(3)将步骤(2)所得结晶溶于步骤(1)中所得提取液,挥发至所需浓度即为药效学实验给药样品。
1.2.6 对急性脑缺血缺氧小鼠的保护作用
参照 《中药药效研究思路与方法》[5]。
1.2.7 对小鼠凝血时间(CT)的影响
参照 《中药药效研究思路与方法》[5]。
1.2.8 对小鼠尾出血时间的影响
参照 《中药药效研究思路与方法》[5]。
1.2.9 对小鼠尾部血栓形成的影响
参照 《中药药效研究思路与方法》[5]。
2 结果与分析
2.1 不同培养基组合菌丝体生长速度的观察
从灵芝菌丝体萌发开始,以2 d~3 d为1个时间单位,记录菌丝体在固体发酵培养基上的生长速度,得到灵芝菌丝体生长速度曲线,如图1所示。
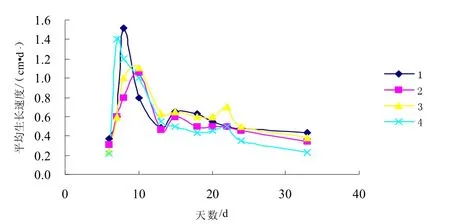
图1 灵芝在不同组合中的菌丝体生长速度
从图1可以看出,菌丝生长可分为5个阶段:适应生长期,菌丝生长较慢,菌丝较纤弱;旺盛期,菌丝活力较强,代谢旺盛,生长快;下降期,菌丝生长速度急剧下降;回升期,菌丝生长速度有所回升;衰退期,菌丝活力衰退,菌丝老龄化,开始分泌黄褐色素。结果表明,菌丝生长至接种大约15 d后,生长速度趋于平稳且缓慢下降,至30 d后,生长速度趋于平缓不变。
2.2 不同灵丹菌质组合的多糖含量
测定发酵40 d后,菌质的多糖含量,如图2所示。
从图2可以看出,发酵40 d后,菌质组合4的多糖含量最高。
2.3 不同灵丹菌质组合的蛋白含量
发酵40 d后,测定菌质的蛋白质含量,测定结果如

图2 各组合灵丹菌质多糖含量变化
图3所示。

图3 各组合灵丹菌质蛋白含量变化
从图3可以看出,发酵40 d后,菌质组合4的蛋白质含量最高。
2.4 不同灵丹菌质组合的灵芝酸三萜含量
发酵40 d后,测定菌质的三萜含量,测定结果如图4所示。
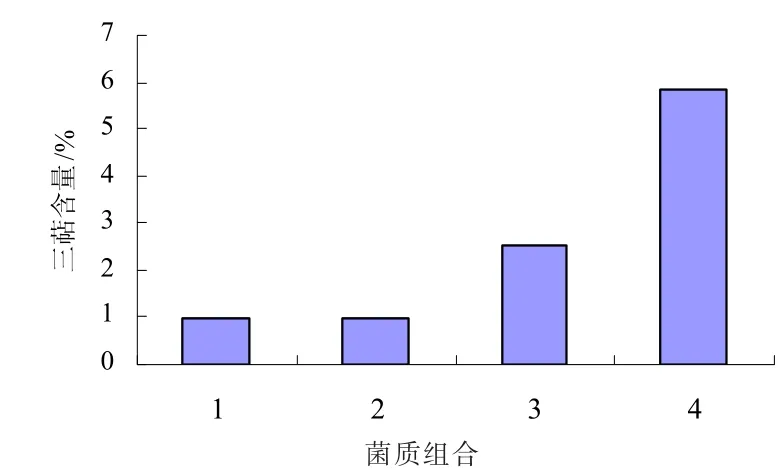
图4 各组合灵丹菌质三萜含量
随着丹参边角料添加比例的逐渐增大,三萜的含量也基本呈现逐渐增大的趋势,提示灵丹菌质中三萜的含量可能与添加的药材比例相关。
2.5 不同灵丹菌质丹参酮IIA含量
发酵40 d后,测定菌质的丹参酮IIA含量,测定结果如表图5所示。
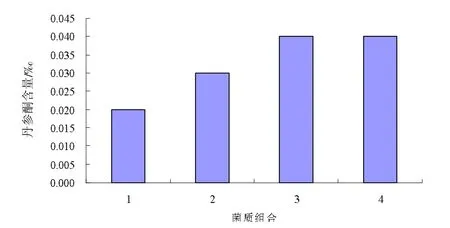
图5 各组合灵丹菌质丹参酮IIA含量
从图5可以看出,组合3和组合4的丹参酮IIA含量最高且相同。
2.6 对急性脑缺血缺氧小鼠的保护作用
从图2~图5可以看出,灵丹菌质组合4在40 d中止发酵后,发酵产物多糖、蛋白质、三萜和丹参酮IIA含量较高,因此选取组合4的发酵产物进行活血化瘀的药效学研究。
2.6.1 对急性不完全脑缺血小鼠的作用
观察灵丹菌质组合4对小鼠急性脑缺血的保护作用,实验结果如表2所示。

表2 对急性脑缺血缺氧小鼠的保护作用(x±s,n=10)
相比空白对照组,丹参药材组、组合4对急性不完全脑缺血小鼠的存活时间均无明显的延长作用,但是组合4具有一定的作用趋势。
2.6.2 对断头后小鼠喘息时间(急性脑缺氧)的影响
观察灵丹菌质组合小鼠断头后急性脑缺氧的保护作用,实验结果如表2所示,相比空白对照组,丹参组、组合4对断头后急性脑缺氧小鼠的喘气时间均无延长作用,但对小鼠断头造成的急性脑缺氧实验模型而言,短暂延长断头小鼠喘气时间数秒,仍可视为对小鼠急性脑缺氧有一定的改善作用,因此,组合4对小鼠急性脑缺氧有一定的改善作用。
2.7 对小鼠凝血时间(CT)的影响
观察灵丹菌质对小鼠凝血时间的影响。实验结果如表3所示。

表3 灵丹菌质对小鼠凝血、尾出血时间的影响(x±s,n=10)
相比空白对照组,组合4给药组的小鼠凝血时间明显长于空白对照组(p<0.05)。
2.8 对小鼠尾出血时间的影响
观察灵丹菌质组合4对小鼠尾出血时间的影响。实验结果如表3所示,相比空白对照组,组合4给药组的小鼠尾出血时间明显长于空白对照组(p<0.05)。
2.9 对小鼠尾部血栓形成的影响
观察灵丹菌质对小鼠尾部血栓形成的影响,实验结果如表4所示。
注射角叉菜胶24 h后,组合4就表现出明显的抑制血栓形成作用(p<0.01);48 h后,丹参药材组也表现出明显的抑制血栓形成的作用(p<0.01);72 h后,2个给药组均表现出一定的抑制血栓形成的作用。

表4 灵丹菌质组合4对小鼠尾部血栓形成的影响(x±s,n=10)
3 讨论
在传统的固体发酵中,基质的作用仅是单向性地为真菌生长提供所需碳、氮等营养,以获得子实体为目的,很少注意发酵过程中基质本身的变化,以及不同基质对发酵产物品质的影响。近年来,国内外的研究者已开始研究在培养基中加入药用植物,进行固体发酵来提高发酵产物的品质,如槐芪菌质[6]、韩国药性米酒[7]。本试验选用中药材为灵芝的培养基质之一,不仅观察了在培养基质中添加不同比例的丹参药材后,灵芝生长情况及菌质多糖、蛋白质、三萜、丹参酮的变化趋势,还进行了菌质提取物活血化瘀的药效学试验。试验结果表明,从菌丝体日平均生长曲线图可以看出,在组合2、组合3、组合4三个培养基中,灵芝的生长速度较快,其中在组合4中,其生长最快(0.62 cm·d-1)。从多糖、蛋白质、三萜、丹参酮的含量来看,40 d后,组合4的多糖、蛋白质、灵芝酸三萜、丹参酮含量较高。综合前面生长情况和成分分析的结果,选取组合4进行小鼠活血化瘀的药效学实验。药效试验表明,灵丹菌质在脑缺血、缺氧和活血化瘀方面具有比丹参药材更好的功效;组合4同时具有延长小鼠凝血时间、尾出血时间和抗血栓的作用,表现出良好的活血化瘀功效。
本研究表明,利用有益菌进行双向发酵能够有效提高中药基质中的药用成分,能够为菌物药研发提供一种新材料和新思路,并证实了新型固体发酵这种思路的合理性。
[1]Russell R,Paterson M.Ganoderma-A therapeutic fungal biofactory[J].Phytochemistry,2006,67(2): 1985-2001.
[2]庄毅,潘扬,谢小梅.药用真菌 “双向发酵”的起源、发展及其优势与潜力[J].中国食用菌,2007,26(2):3-6.
[3]国家药典编委会.中华人民共和国药典[S].化学工业出版社,2005.
[4]郑林用,黄小琴,曾瑾.不同灵芝菌株多糖、三萜化合物比较分析[J].四川大学学报:自然科学版,2007(5):1121-1124.
[5]陈奇.中药药效研究思路与方法[M].北京:人民卫生出版社,2005.
[6]庄毅,池玉梅,陈慎宝.药用真菌新型固体发酵工程与槐芪菌质的研制[J].中国药学杂志,2004,29(3):175-178.
[7]Kim JH,Lee DH,Lee SH.Effect of Ganoderma lucidum on the quality and functionality of Korean traditional rice wine,Yakju[J].Journal of Bioscience and Bioengineering,2004,97(1):24-28.
