20种抗菌药物对肺炎链球菌的体外抗菌活性研究
2010-08-01宋秀杰刘又宁梁蓓蓓陈桂云解放军总医院呼吸科北京00853解放军总医院临床药理研究室北京00853
宋秀杰,刘又宁,梁蓓蓓,白 楠,蔡 芸,刘 浩,陈桂云,王 睿(.解放军总医院呼吸科,北京 00853;.解放军总医院临床药理研究室,北京 00853)
肺炎链球菌(S.pneumoniae)是社区获得性呼吸道感染最常见的致病原之一,也是脑膜炎、中耳炎、鼻窦炎、菌血症的主要致病菌,近年来其对大环内酯类等药物耐药日趋严重,且不同地区差异较大,逐渐引起临床医生的重视。肺炎链球菌是苛养菌,分离和培养都比较困难。门诊治疗社区获得性呼吸道感染主要以经验性治疗为主,很少做致病原的培养和药敏试验,要想提高诊断和治疗的成功率,不仅要结合病人的临床特点和本地区致病原的流行病学情况,也要熟悉常见致病菌对常用药物的药敏试验结果,从而提高治愈率,防止抗菌药物的滥用。为了解目前临床常用的20种抗菌药物对肺炎链球菌的抗菌活性,本文对临床分离的60株肺炎链球菌进行耐药性分析。
1 材料与方法
1.1 抗菌药物
青霉素、阿莫西林/克拉维酸、苯唑西林、哌拉西林、复方新诺明、磷霉素、多西环素、头孢唑啉、头孢呋辛、头孢曲松、头孢噻肟、氧氟沙星、左氧氟沙星、加替沙星、红霉素、罗红霉素、克拉霉素、阿奇霉素、帕珠沙星(中国药品生物制品鉴定所)。莫西沙星由德国拜耳医药保健有限公司馈赠。
1.2 菌株来源
肺炎链球菌60株,来源于解放军总医院、北京医院、中国医科大学附属二院2004-2005年呼吸道感染痰和咽拭子标本。经VITEK微生物分析仪重新鉴定,15%甘油 + 脑心浸出液分装后- 80 ℃ 冰箱保存,测定前复苏传代。质控菌株采用肺炎链球菌ATCC49619。
1.3 仪器
比浊仪(法国Bio-merieux),二氧化碳孵箱(美国NAPCO),96孔板(美国COSTER),VITEK微生物分析仪(法国Bio-merieux)。
1.4 培养基
哥伦比亚血琼脂基础培养基(北京奥博星生物技术有限公司) + 5%脱纤维羊血。MH肉汤(北京奥博星生物技术有限公司) + 2%~5%裂解的马血,用于培养基的马血应反复冻融,直到完全裂解。
1.5 最低抑菌浓度(MIC)测定
采用微量肉汤稀释法[1]。(1)抗菌药物的配制和稀释:配制1280 μg·mL-1的受试药物储备液,以无菌磷酸盐缓冲液倍比稀释,每种药物均配制成128,64,32,16,8,4,2,1,0.5,0.25,0.125,0.062 5,0.031 3 μg·mL-1共13个浓度,分别取0.1 mL的不同浓度的受试药物依次加入96孔平板;(2)菌悬液制备:自5%CO2培养箱中过夜培养的血平板上挑出单个菌落,加入2 mL MH肉汤中调至0.5麦氏比浊度,再用MH肉汤稀释100倍;(3)接种:用微量加样器取0.1 mL菌液依次由低浓度到高浓度加到孔中,置于35 ℃ 5% CO2培养箱中孵育,20 h后记录MIC结果。同时设空白对照和生长对照孔。
1.6 MIC结果判读标准
判断临界值参照美国临床实验室标准化委员会(CLSI)2007版M100-S17执行,以无菌生长孔的最高浓度为该药对该细菌的MIC,全部试验均以质控菌株的MIC判断是否符合CLSI质控标准。统计并计算MIC范围、MIC50、MIC90及敏感率,敏感率比较使用χ2检验。
2 结果
2.1 20种抗菌药物对肺炎链球菌的敏感率及MIC
根据青霉素对60株肺炎链球菌的MIC结果,有青霉素敏感的肺炎链球菌(PSSP)42株(71.7%),青霉素不敏感肺炎链球菌(PNSSP)18株(28.3%);其中,青霉素耐药的肺炎链球菌(PRSP)2株(3.3%),PNSSP(MIC≥0.12 mg·L-1)的发生率为28%,高耐药株(MIC≥2 mg·L-1)为3%。青霉素对60株肺炎链球菌MIC范围是0.015~2 μg·mL-1,MIC50和MIC90分别是0.06,0.5 μg·mL-1。除青霉素外其他19种抗菌药物对肺炎链球菌的敏感率及MIC结果见表1。
2.2 20种抗菌药物对60株肺炎链球菌的累积抑菌百分率
从累积抑菌百分率曲线来看,莫西沙星和阿莫西林/克拉维酸的抑菌能力最强,分别在0.5,2 μg·mL-1的浓度抑制了100%的菌落生长。其余药物的抑菌浓度均在4 μg·mL-1以上。具体见图1~5。
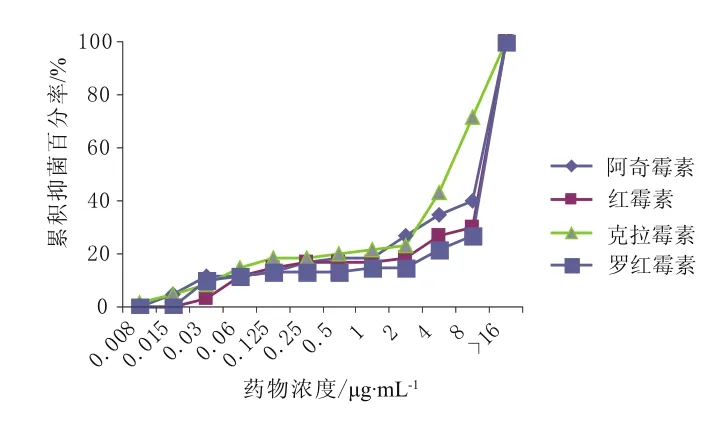
图1 阿奇霉素、红霉素、克拉霉素和罗红霉素对肺炎链球菌的累积抑菌百分率 (n = 60)Fig 1 The accumulative inhibition percentage of azithromycin,erythromycin, clarithromycin, roxithromycin against S.pneumoniae(n = 60)
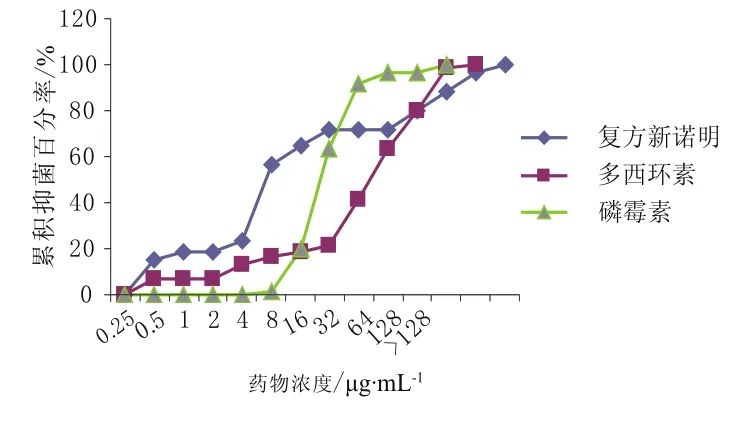
图2 多西环素、磷霉素、复方新诺明对肺炎链球菌的累积抑菌百分率 (n = 60)Fig 2 The accumulative inhibition percentage of doxycycline,fosfomycin, trimethoprim-sulfamethoxazole against S.pneumoniae(n = 60)
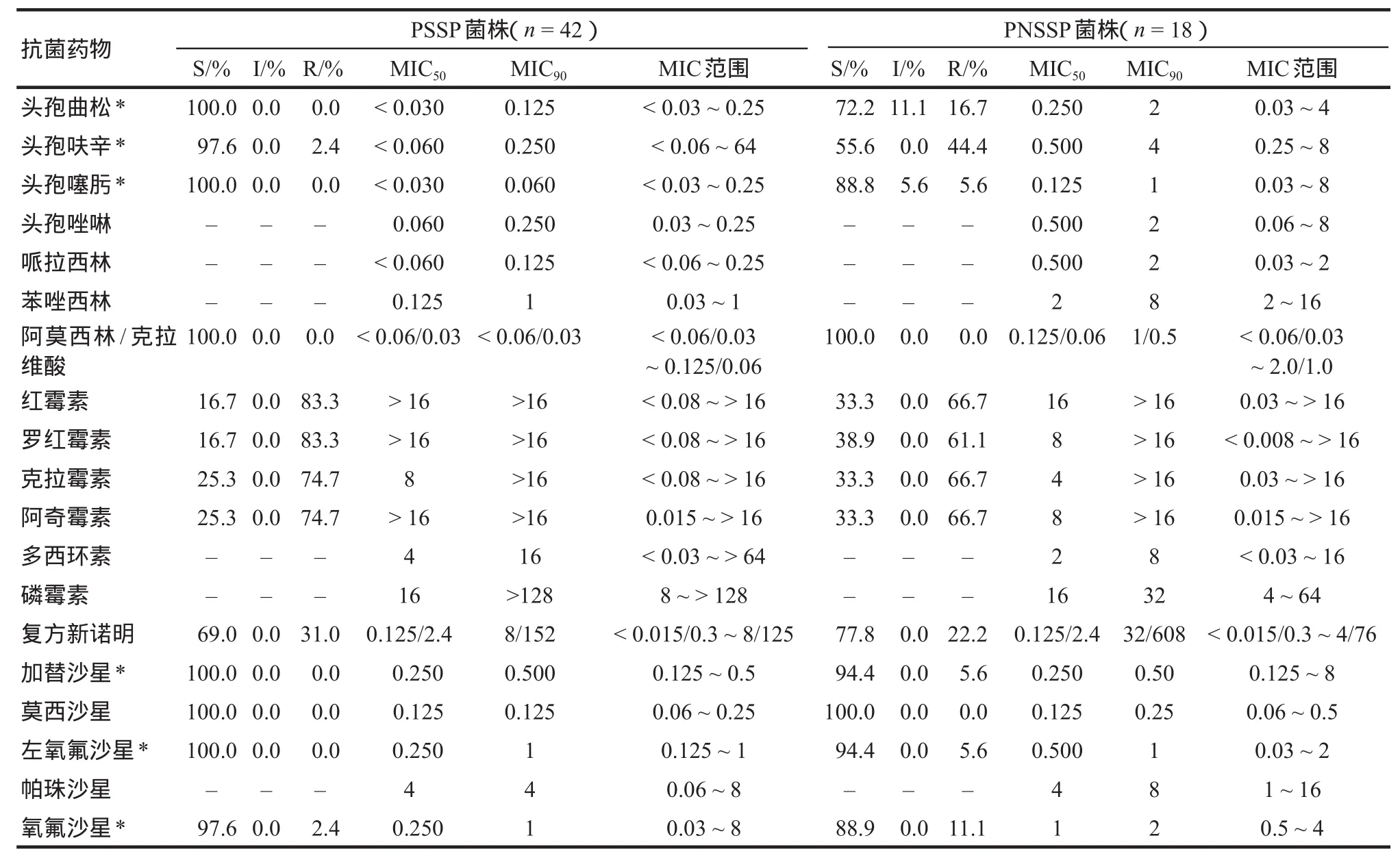
表1 60株肺炎链球菌对19种抗菌药物的敏感率(%)及MIC值(μg·mL-1)Tab 1 Susceptibility of 19 antimicrobial agents against 60 strains S.pneumoniae and MIC
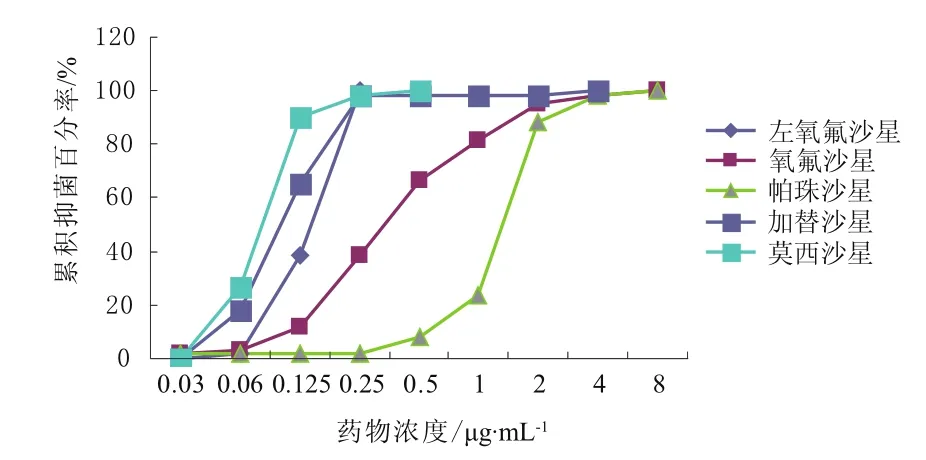
图3 左氧氟沙星、氧氟沙星、帕珠沙星、加替沙星、莫西沙星对肺炎链球菌的累积抑菌百分率 (n = 60)Fig 3 The accumulative inhibition percentage of levofloxacin,ofloxacin, pazufloxacin, gatifloxacin, moxifloxacin against S.pneumoniae (n = 60)
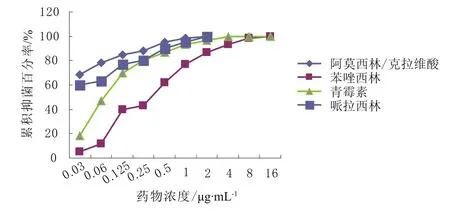
图4 阿莫西林/克拉维酸、苯唑西林、青霉素、哌拉西林对肺炎链球菌的累积抑菌百分率 (n = 60)Fig 4 The accumulative inhibition percentage of amoxicillin-clavulanic acid, oxacillin, penicillin, piperacillin against S.pneumoniae (n = 60)
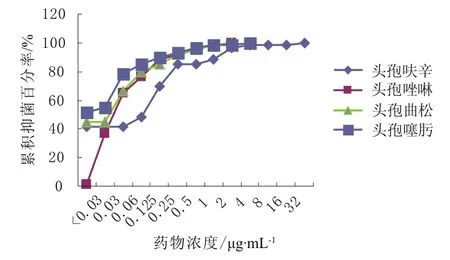
图5 头孢呋辛、头孢唑啉、头孢曲松、头孢噻肟对肺炎链球菌的累积抑菌百分率 (n = 60)Fig 5 The accumulative inhibition percentage of cefuroxime,cefazolin, ceftriaxone and cefotaxime against S.pneumoniae (n = 60)
3 讨论
肺炎链球菌对β-内酰胺类药物的耐药机制主要是青霉素结合蛋白(PBP)变异,导致抗菌药物与靶位的亲和力下降。肺炎链球菌有6种PBP,PRSP的发生主要与其中的3种相关:PBP1a, PBP2b和PBP2x。PBP基因的变异包括点突变和重组突变。多次重组事件的积累可导致菌株的耐药。刘又宁等[2]对国内7个城市665例社区获得性肺炎患者调查发现,青霉素中介株占17.4%,PRSP占2.9%。肺炎链球菌对大环内酯类药物的耐药机制主要是靶位改变和外排泵,前者导致高水平耐药,后者表现为低水平耐药。法国、西班牙和中国的耐药以靶位变异为主,美国和加拿大以主动外排机制为主[3-4]。赵铁梅等[5]研究了148株肺炎链球菌对红霉素的耐药表型,其中内在型耐药(cMLS型)占85.1 %,诱导型耐药(iMLS型)占4.1%,耐药基因以ermB介导的靶位改变多见。Alexander监测项目资料显示:世界范围内肺炎链球菌对多西环素、氯霉素、复方新诺明的耐药率分别为0.5%,11.9%,24.8%[6]。耐药肺炎链球菌所致大叶性肺炎、流行性脑膜炎一旦治疗不当,将严重威胁人类的健康,密切关注其耐药性的变化对临床治疗有重要意义。
本研究测定临床分离的肺炎链球菌对常用20种抗菌药物的敏感性,结果显示:肺炎链球菌对β-内酰胺类药物和第三、四代氟喹诺酮类药物仍保持较高的敏感性,对大环内酯类药物、复方新诺明、磷霉素、多西环素敏感性差,不适用于肺炎链球菌感染,与文献[7]报道基本一致。本研究比较了PNSSP组和PSSP组对常用药物的敏感率,结果PNSSP组对头孢呋辛、头孢曲松、头孢噻肟、加替沙星、左氧氟沙星、氧氟沙星的敏感率显著低于PSSP组;喹诺酮类药物除莫西沙星外两组敏感率均有差异,说明PRSP在对青霉素敏感性下降的同时,对氟喹诺酮类药物的敏感性也下降。同时,β-内酰胺类药物中除了阿莫西林/克拉维酸外,两组敏感率均有差异,说明β-内酰胺类药物内部存在交叉耐药。本实验中PNSSP对临床常用药物敏感性最高的为阿莫西林/克拉维酸和莫西沙星,这两种药物抗菌谱广、副作用小。对于怀疑肺炎链球菌感染的患者根据病情可优先选用阿莫西林/克拉维酸或第三代头孢菌素中的头孢曲松或头孢噻肟及第三、四代喹诺酮类药物(如左氧氟沙星、莫西沙星、加替沙星),但氟喹诺酮类药物不宜用于哺乳期妇女和儿童。
本文结果显示:肺炎链球菌对氟喹诺酮药物的耐药率在0~11%之间,仍保持较高的敏感性。但近年来随着肺炎链球菌对青霉素和大环内酯类药物的耐药率上升,其对氟喹诺酮类药物的耐药也出现上升趋势。加拿大学者发现肺炎链球菌对环丙沙星耐药率从1997年的1%上升到2005年的4.2%,同时对加替沙星、吉米沙星、左氧氟沙星、莫西沙星的耐药率也明显上升,分别为1.6%,1%,10%,1%[8]。第三、四代氟喹诺酮类药物在欧洲许多国家被推荐用于治疗社区获得性呼吸道感染,尽管处于较低的耐药水平,但线性回归分析显示氟喹诺酮类药物的使用与耐药率呈正相关(r2= 0.76)[9],提示临床医生要合理使用氟喹诺酮类药物,防止耐药的进一步加重。
[1] Murray PR, Baron EJ, Pfaller MA,et al.Antibacterial susceptibility tests: dilution and disk diffusion methods.Manual of clinical microbiology[M].9th ed.Washington DC: ASM Press, 2007:1110-1117.
[2] 刘又宁,陈民钧,赵铁梅,等.中国城市成人社区获得性肺炎665例病原学多中心调查[J].中华结核和呼吸杂志,2006,29(1):3-8.
[3] Adam D.Global antibiotic resistance inStreptococcous pneumoniae[J].J Antimicrob Chemother, 2002, 50(Suppl 1): S1-S5.
[4] Reinert RR, Reinert S, van der Linden M,et al.Antimicrobial susceptibility ofStreptococcus pneumoniaein eight European countries from 2001 to 2003[J].Antimicrob Agents Chemother,2005, 49(7): 2903-2913.
[5] 赵铁梅,刘又宁.肺炎链球菌对红霉素的耐药表型及耐药基因[J].中华内科杂志,2004,43(5):329-332.
[6] 汪复.2006年中国CHINET 细菌耐药性监测[J].中国感染与化疗杂志,2008, 8(1):1-9.
[7] Jacobs MR, Felmingham D, Appelbaum PC,et al.The Alexander project 1998-2000: susceptibility of pathogens isolated from community-acquired respiratory tract infection to commonly used antimicrobial agents[J].J Antimicrob Chemother, 2003, 52(2):229-246.
[8] Adam HJ, Schurek KN, Nichol KA,et al.Molecular characterization of increasing fluroquinolone resistance inStreptococcus pneumoniain Canada, 1997 to 2005[J].Antimicrob Agents Chemother, 2006, 51(1): 198-207.
[9] Deshpande LM, Sader HS, Debbia E,et al.Emergence and epidemiology of fluoroquinolone-resistantStreptococcus pneumoniaestrains from Italy: report from the SENTRY antimicrobial surveillance program (2001-2004)[J].Diagn Microbiol Infect Dis, 2006, 54(3): 157-164
