PEG-EPO在大鼠体内的药代动力学研究
2010-08-01郑崛村沈富兵邓念华孟延发成都医学院医学检验系四川成都60083四川大学生命科学院四川成都60064
郑崛村,沈富兵,邓念华,孟延发(.成都医学院医学检验系,四川 成都 60083; .四川大学生命科学院,四川 成都 60064)
重组人红细胞生成素(recombinant human erythropoietin, rhEPO)常用于治疗慢性肾功能不全性贫血以及肿瘤化疗、艾滋病毒感染、骨髓异常增生综合征等引起的贫血。由于其体内半衰期只有6~9 h,临床病人需每周注射3次才能达到治疗效果,并且需要长期使用。为了减少病人的痛苦和治疗费用,我们研制了聚乙二醇化重组人红细胞生成素(PEG-rhEPO),即用聚乙二醇活性酯对rhEPO进行化学修饰,使PEG与rhEPO通过共价键结合而形成PEG-EPO,增加相对分子质量,并封闭部分蛋白酶作用位点,以便延长体内循环半衰期。同时,PEG在蛋白质表面具有遮蔽分子表面抗原决定簇的作用[1],降低免疫原性,减少特异性抗体的产生,可提高药物的稳定性[2-3]。迄今已有尿激酶、水蛭素、血红蛋白、干扰素、白介素-2、粒细胞集落刺激因子等PEG化学修饰的蛋白药物面世[4]。本文拟采用放射性标记法(125I标记PEG-EPO),研究PEG修饰的EPO在大鼠体内的药代动力学,并获取体内半衰期等主要药代动力学参数,观察PEG修饰后的长效效果及相应的动力学特征。
1 材料
1.1 药品与试剂
基因重组CHO-EPO工程细胞株经大规模细胞培养和纯化,获得EPO,以分子量为20 KD的PEG对EPO进行修饰,并经分离获得PEG-EPO,纯度 >98%,11.5 mg·mL-1。临用时,以0.9%氯化钠注射液将原液稀释至低、中、高剂量所需浓度。Iodogen(Sigma公司),Na125I(无还原剂,英国Amersham公司),三氯醋酸(江苏如皋市化学试剂厂)。3 mm CHR层析纸(英国Whatman公司)。
1.2 实验动物
SPF级SD大鼠18只,雌雄各半,体重225~372 g,由上海西普尔必凯实验动物有限公司提供,生产许可证号:SCXK(沪)-2003-0002。
1.3 仪器
FH463-A型自动定标器(北京核仪器厂);BSZ-160型自动部份收集器(上海沪西仪器厂);XH-6010A型全自动γ闪烁计数仪(西安262厂);XHF-1内切式匀浆机(宁波新芝生物科技股份有限公司);LDR4-8.4C低温离心机(北京医用离心机厂);Sephadex(G-50,Pharmacia公司)。
2 测定方法的建立和验证
2.1 125I-PEG-EPO的制备、纯化、鉴定
2.1.1125I-PEG-EPO的制备 采用Iodogen法碘化标记PEG-EPO。125I-PEG-EPO的标记率在35%~38%之间,125I-PEG-EPO放射性比活度:176~192 Bq·ng-1。
2.1.2125I-PEG-EPO标记物的纯化 采用Sephadex G-50凝胶柱层析过滤法。层析柱:10.0 mm×300 mm;淋洗液:0.05 mol·L-1PBS ( pH 7.4)。方法:将标记混合液上柱后,用淋洗液洗脱并分管收集洗脱液。分管测量洗脱液的放射性强度。收集125I-PEG-EPO峰(蛋白峰)的各管洗脱液混合即为本标记所得到的目标化合物125I-PEG-EPO。
2.1.3125I-PEG-EPO的质量鉴定 (1)放射化学纯度测定:采用三氯醋酸沉淀法(TCA法)对标记物125I-PEG-EPO进行测定,平均放射化学纯度为(97.08±1.44)% (n= 5),略高于纸层析法;放射性纸层析方法(PLC)用0.9%氯化钠注射液作为展开剂,经纸层析分段测定得到放化纯度,平均放化纯度为(95.93±2.81)% (n= 5)。(2)125I-PEG-EPO贮存稳定性测试:分别在4 ℃和室温(10~12 ℃)条件下,用TCA法测定在贮存不同时间后放射性标记物125I-PEG-EPO的放射化学纯度;测量数据表明,125IPEG-EPO在4 ℃下保存5 d基本保持稳定,放化纯度> 95%,在室温下能存放24 h。结果见表1。
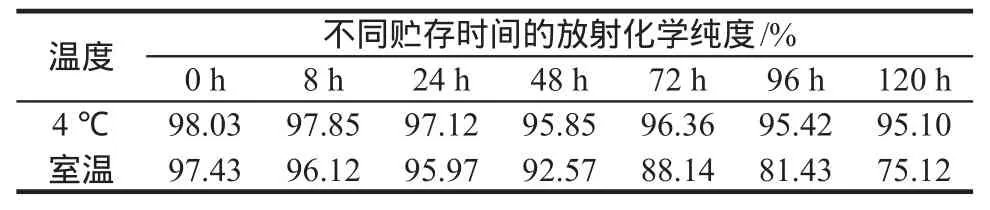
表1 125I-PEG-EPO放射化学纯度的稳定性测试(TCA法)Tab 1 Stability measurement of radiochemical purity of 125IPEG-EPO (TCA)
2.2 大鼠全血PEG-EPO原型药的分离
样品加入2倍体积20%三氯醋酸,混匀,3000 r·min-1离心10 min,弃上清,沉淀即为原型药,测定沉淀的放射计数,根据校正曲线即可得到药物浓度。
2.3 大鼠全血PEG-EPO测定的校正曲线
在方法验证和药物动力学试验中均将PEGEPO设置为低、中、高3个剂量组,分别为3,9,27 μg·kg-1的静脉注射剂量。PEG-EPO工作液(2.65×104cpm·μL-1)用大鼠空白全血制备放射性浓度为150,500,1000,5000,10 000,50 000,100 000,150 000 cpm/200 μL;其与低、中、高剂量组对应PEG-EPO浓度分别为39.075,26.050,13.025,2.605,1.302,0.260,0.130,0.039 ng·mL-1;127.505,85.004,42.502,8.500,4.250,0.850,0.425,0.128 ng·mL-1;427.527,285.018,142.509,28.502,14.251,2.850,1.425,0.428 ng·mL-1。各剂量组各浓度校正品取200 μL,用TCA法分离原型药与代谢物,在γ计数仪上测定放射性cpm,以PEG-EPO浓度对其所对应的TCA沉淀物放射性计数cpm回归,即可得到各组的校正曲线。结果显示:PEG-EPO浓度与cpm呈直线相关,低、中、高各剂量组线性方程分别为y= 0.000 26x+ 0.001(r2= 0.999 9)、y= 0.000 9x-0.007(r2= 0.997 3)、y= 0.002 8x+ 0.008(r2= 0.999 9),定量下限(LLOQ)和定量上限(ULOQ)分别是0.039,39.075;0.128,127.505;0.428,427.527 ng·mL-1,各自覆盖了该剂量组全部待测全血样品的浓度范围。
2.4 精密度测定
PEG-EPO工作液用大鼠空白全血配制理论放射性浓度为400,20 000,110 000 cpm/200 μL;400,20 000,95 000 cpm/200 μL;400,20 000,110 000 cpm/200 μL;在低、中、高剂量组中PEG-EPO浓度分别为0.104,5.210,28.655 ng·mL-1;0.340,17.001,80.754 ng·mL-1;1.140,57.004,313.520 ng·mL-1的质控样品。用TCA法测定各剂量组质控样品125I-PEGEPO的实际放射性计数值。日内每个质控样品测定5次,连续测定5 d。低、中、高剂量组的日内和日间精密度RSD分别为1.78%~5.19%,5.73%~8.48%;1.53%~4.34%,4.32%~6.62%;3.72%~5.99%,5.45%~6.69%。
2.5 回收率测定
将PEG-EPO工作液用大鼠空白全血配制成低、中、高浓度梯度的质控样品,各组浓度梯度分别为400,20 000,110 000 cpm/200 μL;400,20 000,95 000 cpm/200 μL;400,20 000,110 000 cpm/200 μL。PEGEPO浓度分别相当于0.104,5.210,28.655 ng·mL-1;0.340,17.001,80.754 ng·mL-1;1.140,57.004,313.520 ng·mL-1,用TCA法测定其125I-PEG-EPO的实际放射计数值。结果显示:在各剂量组各自定量限范围内,低、中、高剂量组的全血PEG-EPO测定平均回收率分别为95.75%~103.38%,97.88%~104.89%,99.30%~ 115.68%。
3 TCA法测定大鼠全血125I-PEG-EPO浓度
3.1 动物分组和给药
18只大鼠分为3组,每组6只,雌雄各半。包括本次及其以下的所有试验都要在给药前12 h行大鼠腹腔注射1%KI溶液1 mL,用以封闭甲状腺。设高、中、低(27,9,3 μg·kg-1)3个剂量组,给药的放射强度分别为1.214,1.357,1.476 MBq·kg-1。给药体积均为2 mL·kg-1。颈静脉推注给药,10 s内完成。分别于静脉给药后0,0.017(1 min),0.083(5 min),0.5,2,4,10,24,48,72,96,120 h 取全血约0.5 mL,抗凝,4 ℃贮存。
3.2 样品血药浓度测定
采用TCA法分离原型药,并测定其放射性,分别用各剂量组的TCA法全血PEG-EPO校正曲线求得样品的PEG-EPO浓度。放射强度衰变校正方法同“2.3”。
3.3 统计分析与结果判定
根据不同时间点的血药浓度,绘出经时血药浓度曲线图。采用统计学分析软件DASver1.0计算主要药代动力学参数。采用SPSS13.0软件进行组间方差分析,以判断受试物体内过程是否呈现剂量依赖性。
4 结果
4.1 大鼠单次静脉注射3种剂量PEG-EPO的药代动力学研究
3个剂量组大鼠全血中血药浓度-时间曲线比较见图1。
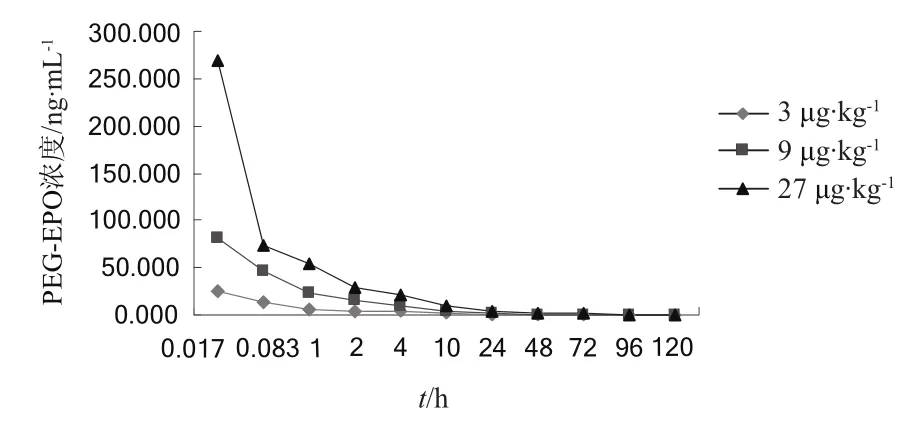
图1 不同剂量组(3,9,27 μg·kg-1)血药浓度-时间曲线Fig 1 Plasma concentration-time curves of three dose groups (3, 9,27 μg·kg-1)
4.2 药代动力学参数计算和统计学检验
实验数据用DASver1.0软件进行处理。遵循AIC最小原则,AUC、AUMC、MRT采用统计矩参数。低、中、高3个剂量组给药后0.017 h(1 min)血药浓度分别为(24.800±3.535),(80.971±16.368),(269.620±26.360) ng·mL-1,与剂量呈正相关,相关系数r= 0.999 8;动物血中药物消除半衰期T1/2β分别为(27.22±3.67),(28.40±1.61),(33.12±1.83) h,随剂量的增加无显著变化;AUC0-120h分别为(69.22±7.13),(218.77±34.57),(470.42±65.88) ng·h·mL-1,与剂量呈正相关,r= 0.990 9,表明药物在大鼠的体内过程呈线性动力学特征。统计结果见表2。
5 讨论
目前已有多家机构开发出了多种方法延长EPO体内半衰期的方法,一种是增加rhEPO 分子量如EPO分子与人白蛋白连接或与人IgG1 Fc融合[5],或通过多肽(3~17个氨基酸)连接成为同源二聚体;另一种方法是采用基因工程技术提高EPO分子糖基化程度,如Amgen公司生产的第二代重组人EPO(AranespTM),在EPO分子原有基础上另外增加2条N-连接糖链,增加含糖量[6]。我们用聚乙二醇修饰rhEPO,增加分子量并降低蛋白酶的降解,可有效延长其体内代谢,属于第一种方法。
表2 大鼠单次静脉注射PEG-EPO药代动力学参数.±sTab 2 Pharmacokinetic parameters of PEG-EPO after single intravenous injection in rats.±s

表2 大鼠单次静脉注射PEG-EPO药代动力学参数.±sTab 2 Pharmacokinetic parameters of PEG-EPO after single intravenous injection in rats.±s
药代动力学参数 低剂量组 中剂量组 高剂量组A 8.134 2±1.170 6 32.723 8±6.479 6 59.442 9±8.210 4 α 0.372 8±0.110 4 0.414 3±0.115 4 0.314 4±0.062 2 B 1.079 4±0.400 2 2.871 0±0.755 0 5.299 1±1.043 6 β 0.025 9±0.003 6 0.024 5±0.001 4 0.021 0±0.001 1 T1/2α/h 2.00±0.56 1.80±0.57 2.28±0.44 T1/2β/h 27.22±3.67 28.40±1.61 33.12±1.83 Vd/L·kg-1 4.103 6±0.484 1 1.650 8±0.693 9 0.640 3±0.065 1 V1/L·kg-1 0.329 8±0.041 3 0.120 3±0.090 5 0.047 0±0.006 0 Cl/L·h-1·kg-1 0.047 1±0.005 8 0.020 2±0.011 1 0.006 9±0.001 0 K10/h-1 0.328 4±0.083 1 0.383 5±0.111 8 0.290 5±0.056 6 K12/h-1 0.041 0±0.029 7 0.028 8±0.008 5 0.022 2±0.005 7 K21/h-1 0.029 3±0.005 4 0.026 6±0.001 7 0.022 7±0.001 3 AUC0-120/ng·h·mL-1 69.22±7.13 218.77±34.57 470.42±65.88 AUC0-∞/ng·h·mL-1 71.72±7.65 226.35±34.52 496.57±68.51 AUMC0-1201 389.53±280.87 4 072.41±899.18 9 489.43±2 060.54 MRT0-120/h 19.93±2.06 18.54±2.06 20.01±1.56
rhEPO被PEG修饰后,rhEPO分子被PEG糖链包裹,一些分子表面的抗原表位被糖链遮盖,将不利于用常规免疫分析法作为药代动力学检测方法,如使用rhEPO单克隆抗体的夹心ELISA检测分析法;而色谱分析法对于大分子量的蛋白类药物显然也不太适合。因此,本文选择经典的放射性标记分析方法,开展PEG-EPO的药代动力学研究,了解PEG修饰达到的长效效果及动力学特征。
本文采用三氯醋酸沉淀法(TCA)和直接测定样品放射性计数法(RA)进行示踪研究。TCA能相对准确的分离原型药物,基本反映原型药的放射性,而RA可以反映原型药、代谢物以及游离125I(125I-)放射性总量。本试验所制备的放射性同位素示踪剂125IPEG-EPO,其放射化学纯度、比活度及其贮存稳定性均符合示踪实验的要求。EPO为含唾液酸的糖蛋白激素,分子中约40%为糖类,包括一个O-联结和三个N-联结的寡糖。EPO与PEG耦联后进入机体也会发生降解,仅测定总放射性强度不能真实反映原型药的情况。因此,需要在全血等样品中分离原型药。本试验所用的三氯醋酸沉淀法对原型药PEG-EPO与部分降解物和游离的125I-分离相对可靠。提高放射性比活度可以提高方法的灵敏度,但过高的放射性比活度会带来不利影响,如标记物的生物活性受损等,在满足灵敏度的前提条件下,选用较低的放射性比活度,以保证标记物的生物活性。方法学验证结果显示,本实验在测试特异性、精确度、准确度、灵敏度、标准曲线测定范围以及线性关系等均符合药代动力学研究的技术要求。
本实验分别设高、中、低(27,9,3 μg·kg-1)3个剂量组,分别相当于临床拟用剂量的9,3,1倍,且3倍的剂量关系能较好显示各剂量之间的差异。试验所制备的放射性同位素示踪剂125I-PEG-EPO,其放射化学纯度、比活度及其贮存稳定性均符合示踪实验的要求。由于EPO为大分子蛋白类药物,如- 20℃储存引起的反复冻融可损坏蛋白质结构,故稳定性实验只选用了室温和4 ℃进行考察。
本实验结果显示,PEG-EPO在大鼠体内的消除半衰期是普通rhEPO的3~4倍,由此推测,PEG-EPO一次注射可以达到普通rhEPO三次或四次给药的效果,这将明显改善临床上由于频繁给药给病人带来的痛苦。我们还将开展大动物如猕猴等体内药代动力学实验再次验证PEG-EPO的长效效果。
[1] Egrie JC, Dwyer E, Browne JK,et al.Darbepoetin alfa has a longer circulating half-life and greater in vivo potency than recombinant human erythropoietin[J].Exp Hematol, 2003, 31(4):290-299.
[2] 沈富兵,葛永红,刘兰军,等.聚乙二醇化重组人红细胞生成素在动物体内的作用[J].中国生物制品学杂志,2003,16(6):336-338.
[3] 葛永红,刘兰军,沈富兵,等.聚乙二醇对PEG化重组人促红细胞生成素热稳定性和生物学活性的影响[J].微生物学免疫学进展,2005,33(2):24-28.
[4] Veronese FM.Peptide and protein PEGylation: a review of problems and solutions[J].Biomaterials,2001,22(5): 405-417.
[5] 祝强,黄智华,黄予良,等.rhEPO-L-Fc融合蛋白的表达、生物活性和初步药动学分析[J].生物工程学报,2008,24(11):1874-1879.
[6] Macdougall IC.An overview of the efficacy and safety of novel erythropoiesis stimulating protein (NESP)[J].Nephrol Dial Transplant, 2001, 16(Suppl 3): S14-S21.
