纳米/亚微米结构包覆型Co-Cu双元金属复合材料的合成研究
2010-07-31张喜斌梁进杰廖永健
张喜斌 李 浩 梁进杰 廖永健
(惠州学院化学工程系,广东 惠州 516007)
包覆型(或核壳型)纳米材料是以一种纳米材料为核,另一种材料作为壳包覆在其表面形成的。包覆型纳米结构复合材料因其独特的结构,可实现核与壳功能的组合、优化甚至达到协同效应,从而可以得到性能远远优于核或壳的新型复合材料。由于过渡金属有着独特的催化、电学、光学和磁学性质,包覆型双元过渡金属复合材料尤为关注[2-4]。Wang等[2]制备了PdCu核PtRu/C壳型纳米催化剂,相比Pt/C和PtRu/C纳米催化剂,其对甲醇的催化氧化氧化活性分别提高了14倍和2.4倍。研究者将显著增强的电催化活性归因于PtRu与PdCu之间的协同效应。孙彦红等[3]采用溶胶法制备了Au核Ag壳(Au@Ag)结构复合纳米粒子,并用粉末-溶胶法和水热合成使其负载在TiO2纳米粒子上,当Au/Ag的化学计量比为1:3且金属的负载量为1wt%时,该复合催化剂对光催化消除臭氧有很好的催化活性。
钴是一种具有代表性的磁性金属,而铜粉在导电材料、催化、润滑油添加剂、医药等领域有着重要的应用[5]。将这两种金属进行结构复合可望得到性能优越的双元金属复合材料,但目前有关包覆型Co-Cu双元金属复合材料的报道较少。本研究采用两步法制备了纳米/亚微米结构包覆型Co-Cu双元金属复合材料,先采用水热法合成出叶片状纳米结构钴材料,再用置换法使铜单质沉积在钴的表面,形成包覆型Co-Cu双元金属复合材料。
1 实验部分
1.1 实验试剂
六水合氯化钴,无水乙醇,氢氧化钠,水合肼(80%),五水硫酸铜,乙酸,所用试剂均为分析纯,未经进一步纯化;实验用水为二次蒸馏水。
1.2 样品的合成
采用两步法合成包覆型Co-Cu双元金属复合材料:第一步,将16mmol CoCl2·6H2O溶于15ml的蒸馏水中,缓慢滴入浓度为10 mol/L的NaOH溶液20ml,得到悬浊液;在剧烈搅拌下向上述悬浊液里加入20ml乙醇和10ml 80%水合肼;将所配得的悬浊液放进用纯聚四氟乙烯衬底的高压釜中,并在放在恒温(140℃)的烘箱中在一定温度下反应3h左右。反应后冷却反应釜,收集得到黑色粒子,用水和丙酮洗涤多次,放入真空烘箱中60℃下干燥8h得到黑色粉末。第二步,在机械搅拌下,取一定量的黑色粉末混入0.1mol/L的硫酸铜和0.01mol/L的醋酸混合溶液20mL中搅拌。采用前述方法洗涤、干燥样品,得到灰红色固体粉末用于表征。
1.3 样品的表征
使用XD-3AX射线衍射仪(日本,岛津公司)对合成的样品的进行晶型分析。测试条件为:Cu靶、Ni滤波,射线波长为0.15418nm,管电压35kV,管电流30mA;采用Hitachi-4800场发射扫描电子显微镜(日本,日立公司)观察钴纳米材料的形貌及尺寸,测试时加速电压为10-20kV。采用EagleⅢ XXL能谱仪(美国,EDAX公司)进行元素分析。
2 结果与讨论
图1示出所制备的钴纳米材料的SEM照片。从图1a可见所制备的钴材料呈三维发散状,类似花簇,尺寸约为10 μm。图1b是单个花簇单元的SEM照片,该单元由10个左右“钴叶片”所组成,每个叶片长约5μm。图1c示出“钴叶片”的精细结构,“钴叶片”表面十分粗糙,充满了直径在300 nm左右、厚度为十几纳米的钴纳米薄片。

图1 所制备钴纳米材料的SEM照片
图2是所制备的钴纳米材料的XRD、EDS图谱。从XRD图谱可知,所制备的钴材料在2θ=41.6°、44.3°、47.5°、51.5°和 75.9°出现 5 个衍射峰,和文献的报道一致,表明该钴材料为面心立方和六方密堆积的混晶[6,7]。图谱中并未出现氧化钴或氢氧化钴的特征衍射峰,表明本研究作采用的方法可将二价钴全部还原为零价。DES图谱出现三个较强的峰,均对应于钴元素的峰。另外还有两个极弱的峰,分别对应于碳元素和氧元素,它们可能来自于样品的表面氧化或是表面吸附的少量杂质。

图2 所制备的钴纳米材料的XRD(a)和EDS(b)图谱
图3a是置换反应进行了15分钟后所得样品的SEM照片。样品表面出现了一些亚微米尺寸的多面体,绝大部分的尺寸在200 nm到500 nm范围内。将该图与图1b,c对比不难发现基体材料钴的表面形貌已发生了显著的改变:大量纳米钴薄片已消失,表面变得相对比较光滑。这点不难理解,因为置换反应是发生在钴纳米材料和硫酸铜溶液的固液界面。表面的钴纳米薄片由于比表面能大,反应活性高,会优先和铜离子反应。此外,从形貌上分析,这些多面体应该是置换反应在固液界面留下的产物,即零价铜。图3b是置换反应进行了30分钟后所得样品的SEM照片。从图中可见基体钴材料已基本看不见,样品表面充满了大量的正八面体铜微晶,这些正多面体尺寸大多在800 nm左右,和图3a中多面体比较,尺寸明显变大。这是因为随着置换反应的进行,所生成的铜晶粒越来越多,部分会加到先前生成的晶粒上使其长大。这也表明在本研究中可以通过控制置换反应的时间调控样品中钴铜的元素比例。

图3 置换反应时间分别为15分钟和30分钟时所得的样品的SEM照片
图4是置换反应进行了30分钟后所得样品的EDS图谱,其中a、b分别是在0-14 keV、0-1.5 keV能量范围内的图谱。
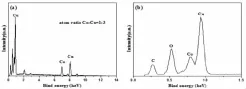
图4 置换反应进行了30分钟后所得样品的EDS图谱
从图中可见,随着反应的进行EDS图谱中出现了较强的铜元素的能谱峰,铜元素和钴元素的原子比为3:1,表明此时样品中的元素主要为铜。注意到图4b中出现了碳元素和氧元素的能谱峰,这是因为本研究向反应体系中加入了醋酸调节酸性为了防止单质钴表面生成氧化钴或氢氧化钴从而阻碍了置换反应的进行,所制备的包覆型材料中吸附或夹带了部分醋酸导致EDS图谱中出现碳元素和氧元素的能谱峰。
3 结论
采用两步法合成得到Cu包Co双元金属复合材料,第一步使用水热法制备出页片状纳米结构钴材料,第二步使用置换法使亚微米铜单质沉积在钴的表面,形成包覆型Co-Cu双元金属复合材料。研究发现,随着置换反应时间的增加,铜的尺寸及形貌均会改变。当置换反应时间为30分钟时,钴的表面上包覆了大量八面体铜微晶,其尺寸在800 nm左右。此时复合材料中钴铜元素原子比约为1:3。
[1]王莹,王华,李蓉,杜玉扣.核壳型纳米粒子合成方法及其性能的研究进展[J].影像科学与光化学,2010,28(1):65-78.
[2]Wang R.,Li H.,Feng Z.,Wang H.,Lei Z.Preparation of carbon-supported core@shellPd-Cu@PtRu nanoparticlesfor methanol oxidation[J].Journal of Power Sources,2010,195(4):1099-1102.
[3]孙彦红,张敏,杨建军.双金属核壳结构负载型Au@Ag/TiO2催化剂的制备及表征[J].无机化学学报,2009,25(11):1965-1970.
[4]崔颜,顾仁敖.Ag核Au壳金属符合纳米粒子的制备及表面增强拉曼光谱研究[J].高等学校化学学报,2005,26(11):2090-2092.
[5]王玉棉,于梦娇,王胜,侯新刚,赵燕春.超细铜粉的制备方法、存在问题及应用[J].材料导报2007,21(专辑Ⅷ):126-129.
[6]LiH.,LiaoS.Preparation oflarge Co nanosheets with enhanced coercivity by a magnetic-field-assisted solvothermal approach free of surfactants,complexants or templates[J].J.Magn.Magn.Mater.,2009,321(17):2566-2570.
[7]李浩,张喜斌.Synthesis and characterization of organics-coated cobalt nanoparticles by solvethermal approach in polyol medium[J].材料导报,2010,24(4):109-112.
