京尼平交联的脱细胞牛心包生物支架材料的实验研究
2010-07-30李新华邢万红
陈 平,李新华,邢万红
(山西医科大学第二临床医院心胸外科,山西太原 030001)
心肌组织工程补片是利用组织工程学技术,将受体心肌细胞种植在生物可降解支架材料上,孵育出有活性的心脏补片,无需抗凝,无免疫原性,有自主修复能力,耐久性强。目前用于心肌组织工程的支架材料大体分为生物支架材料和人工高分子合成支架材料两类,生物支架材料多使用脱细胞牛心包基质,其在细胞黏附及促细胞生长等方面优于人工合成的高分子材料[1]。本研究旨在探讨去污剂-酶消化法去除新鲜牛心包组织细胞的效果和保护基质的能力,以及新型生物交联剂京尼平对脱细胞牛心包基质作为支架材料的影响及意义,为心肌组织工程心脏补片的构建提供较理想的生物支架材料。
1 材料与方法
1.1 实验材料
新鲜成年牛心包(阳曲县养牛场提供),乙二胺四乙酸(EDTA)、曲拉通-100、抑肽酶、DNAaseⅠ、RNAase A、京尼平等试剂均为Sigma公司生产。磷酸盐缓冲液、Tris-HCl液、D-Hanks液等自制,青霉素和链霉素购于山西医科大学。
1.2 新鲜牛心包的处理
从养牛场采集新鲜成年牛心包,冰盐水保存运输,3~6 h后剔除心包表面残留的脂肪及其他结缔组织,然后4℃D-Hanks液漂洗,随机分成三组:A组(25块)为新鲜未脱牛心包组织,B组(25块)为脱细胞牛心包组织,C组(25块)为京尼平交联的脱细胞牛心包组织;然后对B组(25块)和C组(25块)采用去污剂-酶消化法处理获得脱细胞牛心包组织。
1.3 脱细胞支架材料的实验方法
①将B组(25块)和C组(25块)牛心包浸入4℃、pH 8.0且含 0.05 mol/L NaCl、0.02%EDTA和 100 kIU/ml抑肽酶的0.05 mol/L Tris-HCl中24 h。②浸入4℃、pH 8.0且含1.5 mol/L NaCl、0.02%EDTA和 100 kIU/ml抑肽酶的 0.05 mol/L Tris-HCl中 24 h。③4℃,pH 7.4,D-Hanks液清洗。 ④用 4℃、pH 7.4且含1%Triton X-100、0.02%EDTA和100 kIU/ml抑肽酶的 Tris-HCl浸泡 24 h。 ⑤4℃、pH 7.4、 不含 Mg2+、Ca2+的 DHanks液清洗。⑥37℃、pH 7.6、含 DNAaseⅠ(10 mg/L)、RNAaseA(1 mg/L)、Mg2+(3mmol/L)、Ca2+(1mmol/L)的 10mmol/L Tris-HCl消化 1~2 h。 ⑦4℃、pH 7.4、含 1%Triton X-100 的 Tris-HCl浸泡 24 h。 ⑧4℃、pH 7.4 D-Hanks液浸泡 48 h。
1.4 京尼平交联脱细胞牛心包组织
C组(25块)采用含碘溶液[2]于37℃孵箱内作用 48 h予以消毒,然后在37℃用0.625%京尼平溶液交联脱细胞的新鲜牛心包组织72 h[3],磷酸盐缓冲液(PBS)漂洗备用。
1.5 检测项目
1.5.1 组织学观察 将A组、B组牛心包组织各5条置入10%甲醛溶液中固定,常规石蜡包埋、切片、HE染色后在显微镜下进行组织学观察和扫描电镜观察。去细胞百分率=(新鲜牛心包组细胞总数-去细胞组残留细胞数)/新鲜牛心包组细胞总数。
1.5.2 厚度、组织热皱缩温度测定 A组、B组和C组牛心包组织各取10片,裁成40 mm×5 mm试条,以蒸馏水为介质,从室温开始,每分钟升高2℃,应用热收缩温度测定仪和HD-10型厚度仪(精度0.01 mm)完成测试。
1.5.3 机械力学测试 将A、B、C组牛心包组织剪成5.0 cm×1.0 cm矩形条块各10条,两边夹于材料性能试验机(INSRON 5544材料性能试验机,太原理工大学生物力学实验室),夹持间距为15 mm。以10 mm/min将管道壁组织向两边拉伸,记录最大载荷、最大应力、最大应变和弹性模量。
1.6 统计学分析
采用SPSS 13.0统计软件进行数据处理,数据用均数±标准差()表示,组间两两比较采用t检验分析,三组间比较采用单因素方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1 组织学观察
光镜观察显示,脱细胞处理的牛心包为白色半透明状,质地柔软,未见明显增厚。HE染色显示,脱细胞处理的牛心包中少见细胞及碎片成分,去细胞百分率达98.63%,纤维网架结构轻度松散,但基本保持完整,纤维间的空白区为原来的间质细胞和部分细胞外基质所占据的区域,而新鲜牛心包中可见许多蓝色深染的细胞核,未见明显的空白区域(图1、2)。扫描电镜观察显示,脱细胞组牛心包组织纤维排列规则,胶原纤维无溶解变性及断裂,纤维间细胞成分消失(图3)。

图1 A组光镜显示

图2 B组光镜显示

图3 B组扫描电镜显示(×20000)
2.2 组织厚度、热皱缩温度测定结果
组织厚度测定结果显示,三组比较,差异无统计学意义(P>0.05);热皱缩温度测定结果显示,C组分别与A组和B组比较,热皱缩温度差异有统计学意义(P<0.05)。见表1。
表1 组织厚度及组织热皱缩温度结果比较(,n=10)

表1 组织厚度及组织热皱缩温度结果比较(,n=10)
与C组比较,*P<0.05
组别 热皱缩温度测定(℃) 厚度测定(mm)A组78.50±0.50*3.8±1.0 B组67.90±0.60*3.8±1.2 C组85.90±0.404.0±1.0
2.3 机械力学测试
结果见图3。A组(图3A)与C组(图3B)比较,最大载荷、最大应力、弹性模量、最大应变略降低,差异有统计学意义(P<0.05)。
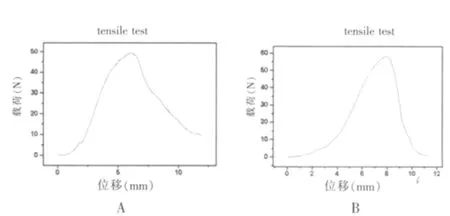
图3 机械力学测试结果
3 讨论
心肌组织工程支架材料是心肌组织工程研究的重要内容之一。目前应用于构建组织工程心肌支架的材料种类很多,主要分为天然生物支架材料和合成生物可降解材料。天然生物材料为满足用作心脏补片支架材料的需要,首先必须完全脱去细胞等抗原成分,以降低材料的免疫原性。同时,选用的制备方法应尽量减少对原有结构的破坏,结构的保留有助于组织的修复和强度的保持[4-6]。
天然生物支架材料因具有抗原性低、利于细胞黏附生长、材料孔隙及孔径优于合成材料等优点,越来越受到科研人员的重视,但存在来源有限、生物学力度较难控制等缺点。人工合成材料种类较多,质量均一性相对较好,数量不受限制,力学强度好,但存在材料孔隙及孔径制作困难、降解产物易堆积、材料质地较硬、弹性较差等缺点。支架材料的最佳孔径和厚度是两者选用所面临的共同问题。在没有血管结构和供血系统的构建组织中,细胞所需要的营养成分是通过渗透和扩散获得的。如果支架材料的各孔隙通透性差,厚度过大,种植在支架内部的细胞就会因无法摄取充足营养及排出代谢废物而坏死。同时细胞与材料的黏附能力、相容性及材料的力学性能也是组织构建的关键问题。
牛心包膜是一种天然衍生的支架材料,主要成分是Ⅰ型胶原,含量达95.00%,柔韧性好,抗原性小,生物相容性好,来源广泛,易于取材,由胶原纤维、间皮细胞和细胞外基质组成。其免疫原性主要取决于所含细胞的包膜表面抗原和细胞所分泌的某些特异物质,如可溶性蛋白、黏多糖等细胞外基质。因此,新鲜牛心包膜经脱细胞处理后可除去其内的细胞等抗原成分,从而大大降低了牛心包膜的免疫原性。
本实验采用的去污剂-酶四步脱细胞方法[7-8],以低渗、高渗透液使组织中的细胞破裂;去污剂Triton X-100破坏细胞膜磷脂和脂蛋白;蛋白酶抑制剂抑肽酶和EDTA(能与金属离子螯合,使蛋白酶失活)抑制蛋白酶的活性,保护基质中的胶原蛋白和弹性蛋白不被水解;DNAaseⅠ和RNAase A水解细胞核中的DNA和RNA,用清洗液清洗掉细胞成分、膜磷脂、脂蛋白及细胞抗原。本实验结果表明,处理后细胞数量极少,证明本方法脱细胞效果良好;胶原纤维和弹力纤维保存完整,仅排列较疏松,与细胞脱除有关;组织厚度略增加,与组织内水分增加有关。
机械力学测试结果显示,脱细胞后牛心包断裂伸长率增大,表明脱细胞后牛心包的组织疏松,变形能力增强;而抗拉负荷减小,说明脱细胞处理对牛心包的力学强度有影响。为了提高天然生物材料的强度,人们常常通过交联反应而达到增加强度的目的[9]。传统的交联方法大都使用化学合成类交联剂,而这类交联剂本身具有相对较高的细胞毒性,导致所得的生物材料在植入受体以后会影响正常组织的生长。本实验用天然生物交联剂京尼平对脱细胞牛心包进行交联,经过京尼平交联的脱细胞牛心包最大载荷增加明显。
京尼平是从栀子果实中提取的天然交联剂,它是一种环烯醚萜类化合物,具有羟基、羧基等多个活性官能团。京尼平克服了常见交联剂在处理生物组织方面的缺点,无细胞毒性,而且由其交联的生物组织在移植后不易钙化[10-11]。其可能的交联机制如下:首先自发与氨基酸残基的自由氨基反应生成一个环烯醚萜的氮化物,随后经过脱水作用形成一个芳香族的单体,之后这一芳香族单体可能由于自由基反应的二聚作用而形成环状的分子间和分子内交联。京尼平交联的最佳条件是:以0.625%为固定浓度,在中性条件下于室温固定交联3 d[12]。
综上所述,采用去污剂-酶消化法处理后细胞数量极少,证明本方法脱细胞效果良好;但抗拉负荷减小,经过新型生物交联剂京尼平交联的脱细胞牛心包最大载荷增加显著,可以弥补脱细胞牛心包力学性能的减少,为构建组织工程心脏补片提供较理想的生物材料。
[1]邢万红,徐志伟.心肌组织工程研究新进展[J].中华小儿外科杂志,2006,27(4):207-209.
[2]Moore MA,Phillips RE.Biocompatibility and immunologic properties of pericardial tissue stabilized by dye-mediated photooxidation[J].J Heart Valve Dis,1997,6(3):307-315.
[3]RatnerBD,HoffmanAS,SchoenFJ,etal.Biomaterialscience[M].SanDiego:Academic Press,1996:84-94.
[4]Oei FB,Stegmann AP,Vander Ham F,et al.The presence of immune stimulatory cells in fresh and cryopreserved donor aortic and pulmonary valve allografts[J].J Heart Valve Dis,2002,11(3):315-324.
[5]Simon P,Kasimir MT,Seebacher G,et al.Early failure of the tissue engineered porcine heart valve synergraft in pediatric patients[J].Eur J Cardio-thorac Surg,2003,23(6):1002-1006.
[6]郭铁芳.脱细胞基质与血管内皮细胞体外相容性的研究[J].中国修复重建外科杂志,2003,17:165-168.
[7]Courtman DW,Pereira CA,Kashef V,et al.Development of a pericardial acellular matrix biomaterial:biochemical and mechanical effects of cell extraction[J].Journal of Biomedical Material Research,1994,28(6):655-666.
[8]周建业,胡盛寿,任兵,等.牛心包脱细胞基质的研制[J].中国医学科学院学报,2001,23(2):193-195.
[9]陈强,吕伟娇,张文清.醛交联剂对壳聚糖复合膜性能的影响[J].华东理工大学学报:自然科学版,2005,31(3):398-402.
[10]Nickerson MT,Farnworth R,Wagar E,et al.Some physical and microstructural properties of genipin-crosslinked gelatin-maltodextrin hydrogels[J].International Journal of Biological Macromolecules,2006,38(1):40-44.
[11]Jin KH,Hwa LK,Joo JH,et al.Anti-inflammatory evaluation of gardenia extract,geniposide and genipin [J].Journal of Ethnopharmacology,2006,103(3):496-500.
[12]Sung HW,Hsu HL,Shih CC,et al.Cross-linking characteristics of biological tissues fixed with monofunctional or multifunctional epoxy compounds[J].Biomaterials,1996,17(14):1405-1413.
