Rig-I蛋白C端Helicase结构域的原核表达、纯化及其多克隆抗体制备①
2010-07-30李金鞠王自强钱杜华东师范大学生命科学学院上海200062
李金鞠 任 华 王自强 钱杜 冰 (华东师范大学生命科学学院,上海200062)
维甲酸诱导基因I(Retinoic acid-inducible gene-I,Rig-I)是2000年由Liu等[1]在全反式维甲酸(All-Trans Retinoic Acid,ATRA)诱导APL细胞株向NB4细胞分化过程中发现的一个上调表达的基因,越来越多的研究表明,Rig-I在天然免疫系统中发挥着重要的作用。Rig-I由两个半胱天冬酶募集域(Caspase Recruitment Domain,CARDs)和一个DExD/H-box RNA解旋酶结构域(Helicase)组成,全长925个氨基酸。其中DExD/H-box RNA Helicase结构域高度保守,并且几乎存在于所有的生物体内(从病毒、细菌、酵母到小鼠等哺乳动物),这种酶具有内在的ATP酶活性,参与了包括转录、RNA干扰(RNAi)、模式识别等在内的许多重要的生物学过程[2,3]。Rig-I的Helicase结构域能通过降解ATP识别并结合细胞质中的病毒双链RNA(double strand RNA,dsRNA),进而引起N端 CARDs构象的改变,使它能够与其他具有CARDs结构域的接头蛋白 IPS-1(也称作VISA/Cardif/MAV-1)结合,最终激活IRF-3、IRF-7和NF-κB等转录因子的活性,诱导Ⅰ型干扰素合成,参与机体天然免疫中的抗病毒作用[4-12]。然而,到目前为止,对于Rig-I中Helicase结构域可结合病毒dsRNA的种类以及结合方式的研究仍存在很多争议,因此,针对Rig-I尤其是Helicase结构域的高效抗体制备工作将对Rig-I蛋白的结构、功能以及天然免疫识别机制的研究有重要意义。
1 材料与方法
1.1 主要试剂和仪器 质粒DNA小量快速制备试剂盒、DNA凝胶回收试剂盒、真核细胞蛋白裂解液购自北京博大泰克生物基因技术有限责任公司。限制性内切酶NdeⅠ、XholⅠ、T4连接酶购自日本TaKaRa公司。引物由上海捷瑞生物工程有限公司合成。异丙基硫代-β-半乳糖苷(IPTG)购自德国Merck公司。辣根过氧化物酶(HRP)标记的羊抗兔IgG和FITC标记的山羊抗兔IgG购自美国Sigma公司。含全长Rig-I基因的质粒pET15b、质粒pET15b(+)、感受态细胞菌株:E.coli DH5α、BL21由本实验室保存(购自博大泰克公司)。小鼠巨噬细胞细胞株Raw264.7购自中国科学院上海细胞库。
1.2 方法
1.2.1 mRig-I-H基因扩增 根据NCBI获取小鼠Rig-I基因(Gene ID:230073)的核苷酸序列,对其C末端Helicase结构域(mRig-I-H,726~2 240 bp)进行克隆。为了便于克隆和表达,在PCR特异性上下游引物两端分别加入NdeⅠ和XholⅠ酶切位点以及相应的保护碱基,以含全长Rig-I基因的质粒为模板扩增小鼠Rig-I基因C端1 500 bp左右的片段。上游引物:5′GGAATTATCATCCTGACACCCCAGATTCTTGTG 3′;下游 引物 :5′CCGTCAGCTGCTGGTCAGGAGGAAGCACTT 3′;PCR扩增条件为:94℃预变性 2分钟;94℃变性 30秒,60℃退火 30秒,72℃延伸 90秒(30个循环);72℃再延伸,5分钟。扩增的产物上1%琼脂糖凝胶电泳分析。
1.2.2 原核表达载体pET15b-mRig-I-H构建 用NdeⅠ和XholⅠ双酶切PCR产物与pET15b(+)质粒,37℃酶切3小时。1%琼脂糖凝胶电泳后割胶回收。T4连接酶将酶切载体和PCR产物进行连接,16℃反应过夜。次日,转化入E.coli DH5α,挑取转化后单克隆菌落扩增培养,菌液PCR初步鉴定。质粒抽提纯化后,限制性内切酶(NdeⅠ和XholⅠ)双酶切鉴定。PCR、酶切鉴定后的重组质粒由上海鼎安生物科技有限公司基因测序,阳性质粒命名为pET15b(+)-mRig-I-H。
1.2.3 mRig-I-H蛋白表达 将重组质粒pET15bmRig-I-H转化入E.coli BL21,挑取单菌落于含氨苄青霉素的LB中,37℃、220 r/min培养过夜。次日按1∶100转接入1 L含氨苄青霉素的LB后,37℃220 r/min培养至OD600达到0.6。吸取部分样品作为阴性对照。加入终浓度为0.25 mmol/L的IPTG,20℃220 r/min诱导18小时。4℃4 000 r/min离心收集菌体。冰浴超声破菌,4℃12 000 r/min离心30分钟,收集上清和沉淀,10%SDS-PAGE分析mRig-I-H表达水平。
1.2.4 mRig-I-H蛋白分离纯化、浓度测定及Western blot分析 蛋白纯化采用割胶回收的方法:于超生破菌后的包涵体中加入2×上样缓冲液重悬后置100℃沸水中煮 10分钟。电泳结束后用预冷的250 mmol/LKCl浸泡胶至显示出乳白色的蛋白条带,在相应位置切下目的条带。PBS洗涤至条带透明,研磨,溶于体积为胶条体积一半的PBS中。4℃,浸泡过夜。次日,4℃,12 000 r/min,离心20分钟,取上清,冻存于-20℃以备用。采用Bradford法测定融合蛋白的浓度。纯化产物经SDS-PAGE后,电转移至硝酸纤维素膜上,目的蛋白带有His标签,以抗His单抗作为一抗(1∶1 000),HRP标记的羊抗小鼠IgG为二抗(1∶5 000),ECL显色,暗室曝光显影。
1.2.5 多克隆抗体制备及效价、Western blot检测将纯化的mRig-I-H蛋白与弗氏完全佐剂等量(等体积)乳化后,经背部皮下多点注射1只成年雄兔,每点约200μg。以后将纯化的mRig-I-H蛋白与弗氏不完全佐剂隔2周加强1次;从第3次加强免疫后7天,颈动脉取血,分离血清后,与等量甘油混合,无菌分装保存于-80℃备用。间接ELISA检测免疫血清效价。纯化蛋白经SDS-PAGE后,电转移至硝酸纤维素膜上,以免疫血清作为一抗(1∶3 000),HRP标记的羊抗兔IgG为二抗(1∶5 000),ECL显色,暗室曝光显影。
1.2.6 Western blot及细胞免疫荧光检测RAW264.7中Rig-I蛋白 每孔按 105个细胞的数目将RAW264.7铺于 6孔板内,于 37℃,5%CO2培养箱过夜培养。用终浓度10μg/ml的LPS刺激细胞24小时,对照孔加入相同体积的PBS,37℃孵育24小时[13-15]。裂解细胞获得的细胞全蛋白经SDS-PAGE后,电转移至硝酸纤维素膜上,以免疫血清作为一抗(1∶6 000),HRP标记的羊抗兔IgG为二抗(1∶10 000),ECL显色。每孔按104个细胞的数目将RAW264.7铺于24孔板内,于37℃,5%CO2培养箱过夜培养。用终浓度 10μg/ml的 LPS刺激细胞,对照孔加入相同体积的PBS,37℃孵育24小时。PBST洗去培养基后,用4%多聚甲醛和3‰Triton X-100于冰上固定细胞30分钟,PBST洗涤3次。PBST-5%脱脂奶粉封阻1小时,PBST洗3次。加入免疫血清(1∶50),4℃孵育过夜,PBST洗5次。加入FITC标记的山羊抗兔IgG(1∶300),室温孵育,PBST洗5次。PI室温作用,PBST洗涤后,缓冲甘油封片,荧光显微镜下进行观察,400倍放大,拍照记录结果。
1.2.7 激光共聚焦显微镜检测Rig-I蛋白的亚细胞定位 小鼠腹腔巨噬细胞、RAW264.7细胞接种于内置爬片的24孔板中,用终浓度10μg/ml的LPS刺激细胞,对照孔加入相同体积的PBS,37℃孵育24小时。PBST洗去培养基后,经4%多聚甲醛和3‰Triton X-100于冰上固定30分钟,PBST洗涤3次。PBST-5%脱脂奶粉封阻1小时,PBST洗3次。加入免疫血清(1∶50),4℃孵育过夜,PBST洗5次。加入FITC标记的山羊抗兔IgG(1∶300),室温孵育,PBST洗5次。PI室温作用,PBST洗涤后,抗荧光猝灭剂封片,Confocal显微镜下观察,拍照记录结果。
2 结果
2.1 PCR扩增mRig-I-H片段 应用PCR方法扩增Rig-I基因C末端Helicase结构域(726~2 240 bp),琼脂糖凝胶电泳结果显示PCR扩增得到1 500 bp大小的DNA片段,与理论基因片段大小相似。
2.2 pET15b(+)-mRig-I-H双酶切鉴定 经过筛选的阳性克隆扩增后提取质粒,双酶切鉴定结果显示质粒中包含的目的基因片段大小与预期值相符(图1)。测序结果经gene runner软件分析,序列完整正确且读码框无误,表明构建成功。
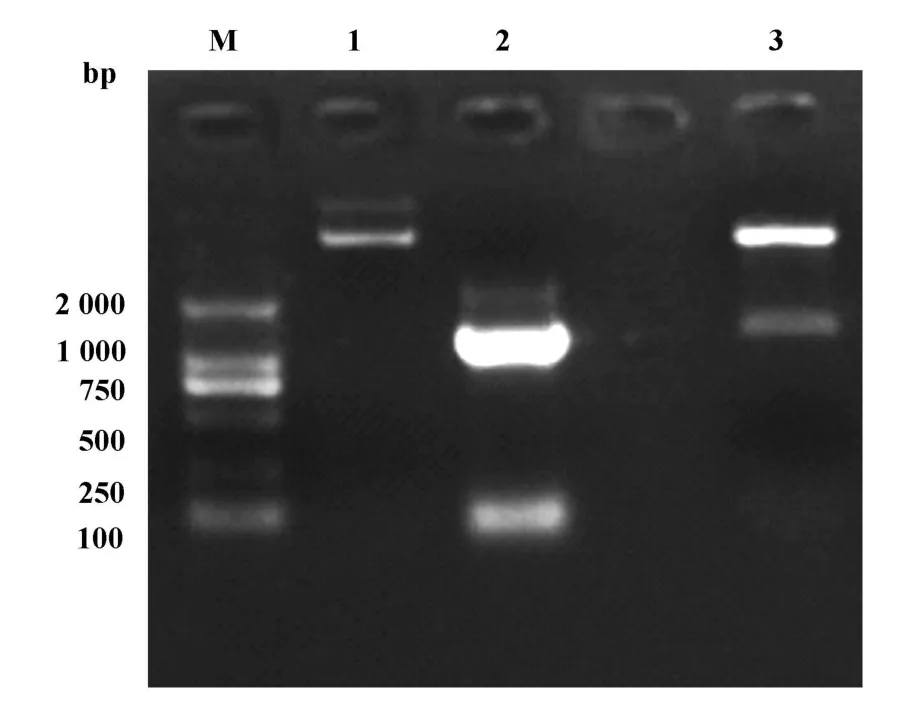
图1 PCR扩增产物及重组质粒p ET15b(+)-mRig-I-H琼脂糖凝胶电泳图Fig.1 Electrophoresis analysis of PCR product and digesting recombinant p ET15b(+)-mRig-I-H plasmid
2.3 mRig-I-H蛋白的表达量和表达形式鉴定 重组菌诱导表达后,SDS-PAGE分析显示,在大小约为40 kD处出现目的蛋白条带,与理论计算值相符,主要以包涵体形式表达,以0.4、1、10mg/ml三种不同浓度的BSA为参照,粗略估计目的蛋白的表达量(图2)。
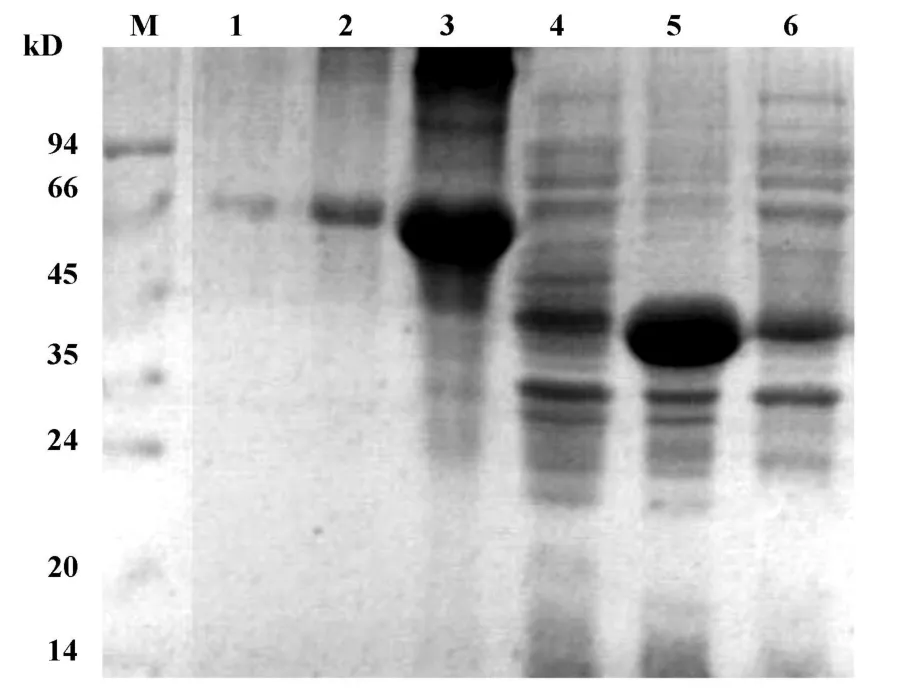
图2 SDS-PAGE分析mRig-I-H在大肠杆菌BL21中的诱导表达Fig.2 SDS-PAGE analysis for expression of mRig-I-H in E.coli BL21
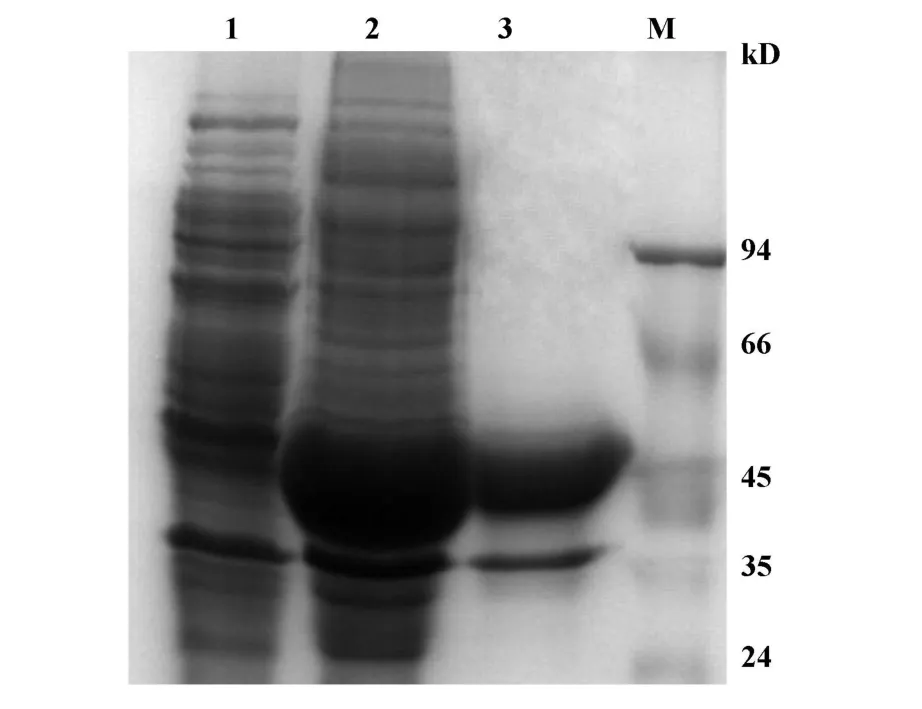
图3 纯化mRig-I-H蛋白的SDS-PAGE检测Fig.3 SDS-PAGE analysis for the purified mRig-I-H protein
2.4 mRig-I-H蛋白的纯化和Western blot检测与浓度测定 蛋白经割胶纯化后,SDS-PAGE(图3)和Western blot(图4A)结果显示,相对分子量约40 kD处有特异性条带出现,表明纯化后所得蛋白确为所表达的目的蛋白。根据蛋白浓度标准曲线计算得纯化蛋白浓度为2.83mg/ml。将纯化的mRig-I-H蛋白包被于酶标板,间接ELISA法测定兔抗血清效价在1∶100 000左右。以制备的抗mRig-I-H兔免疫血清作为一抗进行Western blot鉴定,结果显示:诱导表达菌蛋白及纯化蛋白在大小约40 kD处出现了特异蛋白条带,而在未加诱导剂的菌体蛋白中未见有反应条带,说明所制备的抗mRig-I-H抗体可与所表达的目的蛋白结合并且特异性较好(图4B)。
2.5 用制备的多抗检测RAW264.7细胞内的Rig-I蛋白 LPS刺激后能使RAW264.7细胞中Rig-I表达量上调[14,15]。以制备的抗mRig-I-H免疫兔血清作为一抗,Western blot结果显示:LPS诱导的RAW264.7细胞蛋白在大小约116 kD处出现了特异蛋白条带,而在未加LPS诱导的RAW264.7细胞蛋白中未见有反应条带,说明所制备的抗mRig-I-H抗体能够与细胞中Rig-I全蛋白特异性结合。以制备的抗mRig-I-H免疫兔血清作为一抗,以山羊抗兔IgG-FITC作为二抗,细胞免疫荧光结果显示:LPS诱导RAW264.7后,细胞质中出现非常明显的绿色荧光,而在未加LPS诱导的RAW264.7,无绿色荧光出现(图5)。
2.6 激光共聚焦显微镜检测Rig-I蛋白的亚细胞定位 为了确定Rig-I在巨噬细胞中的定位情况,实验用制备的mRig-I-H多抗对小鼠腹腔巨噬细胞、RAW264.7细胞内的Rig-I蛋白的表达位置进行检测。结果显示,在这两种细胞内,Rig-I蛋白主要以游离的方式分布在细胞质中,其中部分Rig-I蛋白会在膜的局部出现点状形式的聚集(图6),而这种聚集极有可能对Rig-I所参与的免疫调控功能具有重要意义,该结果与现有的文献报道基本相符。

图4 纯化mRig-I-H蛋白的Western blot检测Fig.4 Western blot detected to purified mRig-I-H protein by mouseanti-His serum
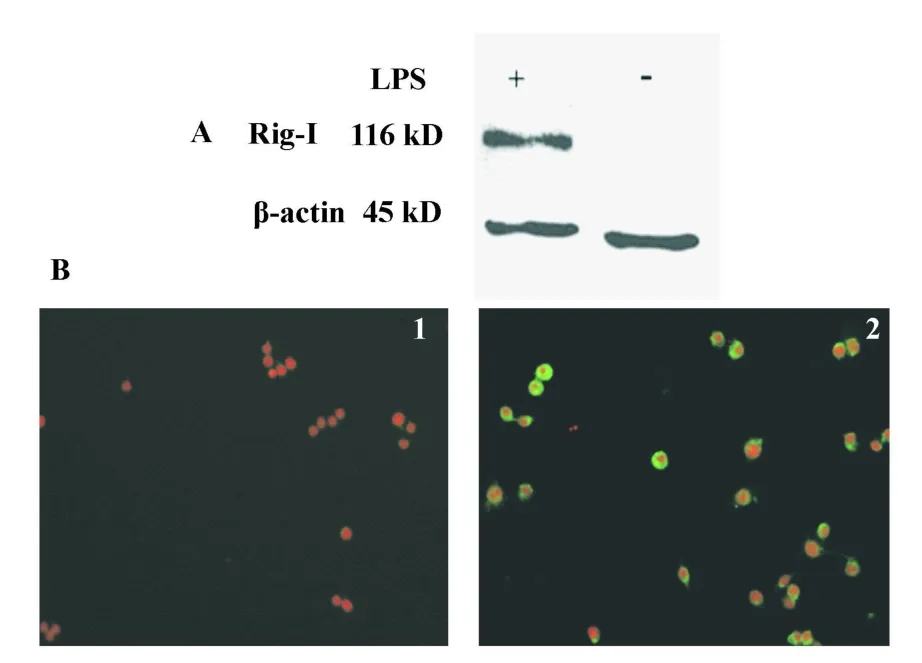
图5 使用免疫兔血清检测RAW264.7中的RIG-I蛋白Fig.5 RIG-I in RAW264.7 detected by polyclonal antibodies by Western blot
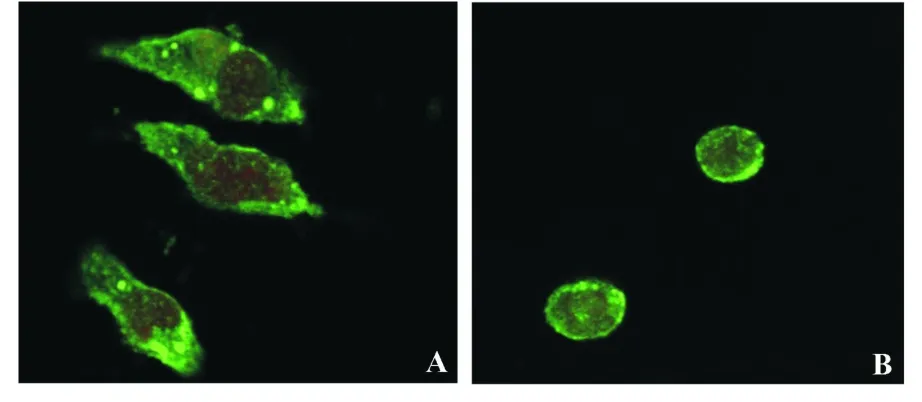
图6 RIG-I蛋白在小鼠腹腔巨噬细胞和RAW264.7细胞中的表达定位Fig.6 RIG-I location of peritoneal macrophages identitied by confocal
3 讨论
Rig-I蛋白是近年新发现的一种天然免疫受体,其生物功能的研究已经成为免疫领域的一个热点。除了抗病毒作用,一些研究还表明,Rig-I对LPS刺激巨噬细胞吞噬细菌有促进作用,Rig-I基因敲除以后的小鼠频繁出现类似结肠炎的症状,Rig-I对粒细胞的增殖有负调控作用[15-17]。这些现象的出现提示我们,Rig-I可能在免疫功能调控中发挥了十分重要的作用,因此深入开展Rig-I结构与功能调控作用的研究,将具有十分重要的意义。
抗体是研究基因功能的重要工具,制备一种效价高、特异性好的抗体,是研究相关基因表达、定位和生物学功能非常重要的一步。本实验室在克隆mRig-I-H基因片段的基础上,表达并纯化了Rig-I蛋白的C端Helicase结构域,免疫兔制备抗体,经过3次免疫强化,ELISA显示该抗体具有较高的效价。Western blot结果表示该抗体可与小鼠巨噬细胞株Raw264.7中分子量约116 kD的蛋白条带结合(能较特异性地与Rig-I蛋白结合)。激光共聚焦实验证实该抗体同样可用于Rig-I在细胞中的定位研究。
本研究利用割胶回收的融合蛋白进行抗体制备,方法操作简便,获得的抗原量较大。且抗体制备过程具有周期较短、成本低;产生的抗体效价高、特异性强;可用于酶联免疫吸附试验、免疫印迹、免疫组化实验来检测Rig-I全蛋白。多克隆抗体的制备成功为进一步阐明Rig-I通路提供了重要工具。我们将进一步深入研究 Rig-I功能及在免疫反应中的作用、调控机理,从而加快这一领域的研究进程。
1 Liu T X,Zhang J W,Tao J et al.Gene expression networks underlying retinoic acid±induced differentiation of acute promyelocytic leukemia cells[J].Blood,2000;96(4):1496-1504.
2 Silverman E,Edwalds-Gilbert G,Lin R J.DExD/H-box proteins and their partners:helping RNA helicases unwind[J].Gene,2003;312:1-16.
3 Fuller-Pace F V.DExD/H box RNA helicases:multifunctional proteins with important roles in transcriptional regulation[J].Nucleic Acids Res,2006;34(15):4206-4215.
4 Kato H,Sato S,Yoneyama et al.Cell type specific involvement of Rig-I in antiviral response[J].Immunity,2005;23:19-28.
5 Kato H,Takeuchi O,Sato S et al.Differential roles of MDA5 and Rig-I helicasesin the recognition of RNA viruses[J].Nature,2006;441:101-105.
6 Seth R B,Sun L,Ea C K et al.Identification and characterization of MAVS,a mitochondrial antiviral signaling protein that activates NF-κB and IRF-3[J].Cell,2005;122:669-682.
7 Xu LG,Wang YY,Han K J et al.VISAisan adapter protein required for virus-triggered IFN-βsignaling[J].Mol Cell,2005;19:727-740.
8 Honda K,Yanai H,Negishi H et al.IRF-7 is themaster regulator of type-I interferon-dependent immune responses[J].Nature,2005;434:772-777.
9 Meylan E,Curran J,Hofmann et al.Cardif is an adaptor protein in the Rig-Iantiviral pathway and is targeted by hepatitis C virus[J].Nature,2005;437:1167-1172.
10 Sato M,Suemori H,Hata N et al.Distinct and essential rolesof transcription factors IRF-3 and IRF-7 in response to virusesfor IFN-α/βgene induction[J].Immunity,2000;13:539-548.
11 Li K,Chen Z,Kato N et al.Distinct poly(I-C)and virus-activated signaling pathways leading to interferon-beta production in hepatocytes[J].Biol Chem,2005;280(17):16739-16747.
12 Mitsutoshi Yoncyama,Mika Kikuchi,Takashi Natsukawa et al.The RNA helicase Rig-I has an essential function in double-stranded RNA-induced innate antiviral responses[J].Nature Immunology,2004;5(7):730-737.
13 Tadaatsu Imaizumi,Hidemi Yoshida,Kei Satoh.Bacterial lipopolysaccharide induces retinoic acid-inducible gene-I in vascular endothelial cells[J].International Congress Series,2003;1251:119-123.
14 Wang J,Wu S,Jin X et al.Retinoic acid-inducible gene-I mediates late phase induction of TNF-alpha by lipopolysaccharide[J].J Immunol,2008;180(12):8011-8019.
15 Kong L,Sun L,Zhang H et al.An essential rolefor Rig-Iin Toll-like receptor-stimulated phagocytosis[J].Cell Host Microbe,2009;6(2):150-161.
16 Wang Y,Zhang HX,Sun YP etal.Rig-I-/-micedevelop colitisassociated with down regulation of Galphai2[J].Cell,2007;17:858-868.
17 Zhang NN,Shen SH,Jiang LJ et al.Rig-I plays a critical role in negatively regulating granulocytic proliferation[J].Proc Natl Acad Sci USA,2008;105:10553-10558.
