大兴安岭兴安落叶松林土壤微生物分布特征
2010-07-30姜海燕
姜海燕,闫 伟
(内蒙古农业大学 林学院,内蒙古 呼和浩特010019)
森林土壤微生物在林地枯枝落叶分解、腐殖质合成和土壤养分循环等过程中,起着十分重要的作用,其数量不仅直接影响土壤的生物化学过程及土壤养分的组成与转化,也是土壤中生物活性的具体体现,是维持和恢复林地生产力的主要因素之一[1-4]。林地土壤中3大类微生物的数量,通常可作为森林土壤生物活性高低的重要标志之一。林地微生物种群及数量、分布的广度,直接影响林地土壤理化性质和土壤肥力,进而影响林木的生长[5-7];土壤微生物种群和数量与土壤肥力及林木生长状况成正相关[8-10]。林地土壤微生物的数量是在更深层次上揭示森林生态系统能量流动和物质循环过程的重要环节。因此,研究林地土壤微生物的分布特征具有现实意义。兴安落叶松Larix gmelinii是中国大兴安岭林区主要的用材树种。许多学者对兴安落叶松林群落特性、物种特异性、碳循环、火干扰、营养状况和肥力特征等进行研究[11-13],但对土壤微生物方面的研究很少。本研究对内蒙古大兴安岭森林生态定位站地区不同林型土壤微生物分布特征进行初步研究,为探讨兴安落叶松林生态系统的结构和功能提供依据。
1 研究区域概况
试验地设在内蒙古大兴安岭森林生态系统定位站,地理坐标为50°49′~50°51′N,121°30′~121°31′E。地处大兴安岭西北坡,为中山山地,海拔为784~1 142 m。属寒温带湿润气候区,年均气温为-5.4°C,最低气温-54.0°C,大于等于10°C积温1 403°C,年降水量450~550 mm,60%集中在7-8月,9月末至翌年5月初为降雪期,降雪厚度为20~40 cm,降雪量占全年降水量的12%。全年地表蒸发量为800~1 200 mm。年均日照为2 594 h,无霜期80 d。林地土壤暗棕壤土,土层厚度为30~40 cm,含较多石砾,基岩以花岗岩与玄武岩为主。研究地主要树种为兴安落叶松,其面积占总面积的79%,树高为25~30 m,胸径26~30 cm,蓄积量150~200 m3·hm-2。林下植物常见有杜香Ledum palustre,杜鹃Rhododendron parvifolium,越橘Vaccinium vitis-idaea,红花鹿蹄草Pyrola incarnata,舞鹤草Maianthemumbif olium和山黧豆Lathyrus quinquenervius等。
2 材料与方法
2.1 样地选择
在内蒙古大兴安岭森林生态系统定位站附近原始林区选择有代表性的3种原始林型,即原始林杜香-兴安落叶松林,原始林草类-兴安落叶松林,原始林柴桦-兴安落叶松林及已被干扰的皆伐落叶松林和火烧迹地(采样时距火烧时约1 a)为样地。
2.2 土壤采集
土壤采集按不同林型采用对角线型混合取样法,分0~10,10~20,20~30 cm取样,过筛后带回实验室4℃冷藏保鲜,进行土壤微生物指标测定。采样时间为2008年9月。
2.3 土壤微生物数量的测定
土壤微生物数量分析采用稀释平板分析法。微生物计数培养基分别为:细菌采用牛肉膏蛋白胨培养基,放线菌采用高氏1号培养基,真菌采用马丁氏孟加拉红-链霉素培养基。各个处理设3个重复,最终结果取其平均值。接种后倒置于28~30℃恒温箱中培养一定时间,细菌2 d,真菌5 d,放线菌10 d,然后进行计数。细菌和放线菌的菌落数选在20~200个之间的计数,真菌菌落数在10~100个之间的计数;土壤水分含量测定采用烘干法[14-15]。
2.4 数据统计
采用Excel和SPSS统计分析软件进行数据分析,样地间差异用最小显著差数(LSD,least sighificant difference)法,土层间差异用配对样品t检验(paired-samples t test)法。
3 结果分析
3.1 不同林地土壤微生物数量的变化
兴安落叶松林林型不同,土壤微生物的数量也有差异,微生物总数是杜香-兴安落叶松林>草类-兴安落叶松林>柴桦-兴安落叶松林>火烧迹地>皆伐兴安落叶松林(表1)。在P<0.05水平上,杜香-兴安落叶松林与柴桦-兴安落叶松林、皆伐兴安落叶松林、火烧地间差异性显著,与草类-兴安落叶松林差异性不显著;草类-兴安落叶松林与皆伐兴安落叶松林、火烧地间差异性显著,与柴桦-兴安落叶松林差异性不显著。细菌数量在各样地的分布特征及不同林型差异性与微生物总数一致;真菌数量是皆伐兴安落叶松林>柴桦-兴安落叶松林>杜香-兴安落叶松林>草类-兴安落叶松林>火烧迹地,在P<0.05水平上,杜香-兴安落叶松林与皆伐兴安落叶松林、皆伐兴安落叶松林与火烧迹地差异性显著,其他林型间差异性不显著;放线菌数量是杜香-兴安落叶松林>草类-兴安落叶松林>火烧迹地>皆伐兴安落叶松林>柴桦-兴安落叶松林,杜香-兴安落叶松林与柴桦-兴安落叶松林、皆伐兴安落叶松林、火烧迹地之间差异性显著(表1)。说明不同林型间土壤微生物数量分布上存在明显的非均匀性。3种微生物中,细菌占有绝对的优势,占微生物总数的80.19%~96.83%,放线菌为1.07%~6.31%,真菌为0.38%~13.55%(表1)。可见,不同林地类型对土壤微生物数量和种类影响效果是有差异的。之所以出现这种现象,可能与不同林型的凋落物质量有一定关系,从而影响分解速率。杜香-兴安落叶松林微生物数量最多是由于其分布于原始林垂直带的顶层,光照充足,外界干扰少,土壤结构比较稳定,枯枝落叶积累多,水分涵养好,分解有机质的微生物多;皆伐林与火烧迹地的原有土壤结构遭到破坏,林下的凋落物积累少,土壤养分容易流失,导致微生物数量减少。皆伐林样地中真菌所占比例大于放线菌,这是由于皆伐林土壤pH值较低,适宜异养型的真菌生长发育,而不适宜喜于生活在土壤pH值较高的放线菌生长。
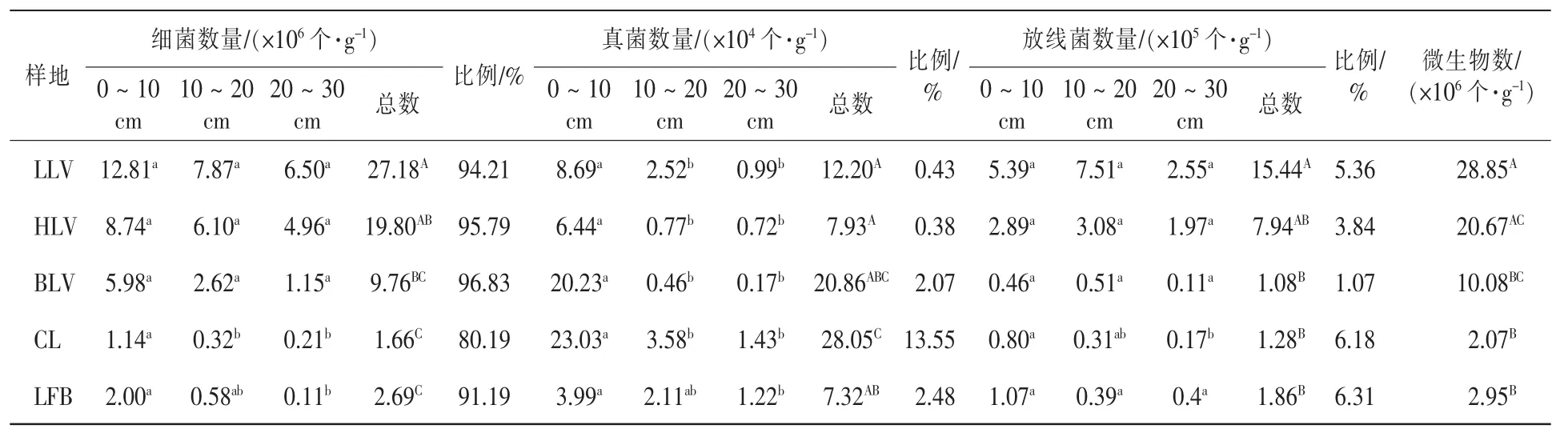
表1 不同林型土壤微生物数量及差异Table 1 The quantity and difference of soil microorganism in different forest types
3.2 土壤微生物的垂直变化
不同样地土壤微生物总数均是0~10 cm层最多,随着垂直深度的增加而逐渐减少。在皆伐林内,10~20 cm与20~30 cm微生物的垂直变化不大,而其他林型不同层次微生物的变化较明显(图1)。3类微生物的变化是:①细菌的垂直变化与微生物总数量的变化规律一样(图1~2和表1),即5个样地细菌是0~10 cm>10~20 cm>20~30 cm,皆伐林的0~10 cm与10~20 cm和20~30 cm在P<0.05水平上差异性显著,火烧迹地的0~10 cm与20~30 cm差异性显著(P<0.05),其他样地不同层次间差异性不显著。②真菌的垂直变化与微生物总数的变化一样,5个样地中皆伐林的0~10 cm真菌数量最多,其次是柴桦-兴安落叶松林;除火烧迹地外,其他样地0~10 cm与10~20 cm和20~30 cm间差异性显著(P<0.05);火烧迹地0~10 cm与20~30 cm差异性显著(P<0.05),前4个样地0~10 cm真菌数量远远大于其他2层,真菌主要集中分布在0~10 cm层(图3和表1)。③在前3个样地,放线菌的分布是10~20 cm>0~10 cm>20~30 cm,皆伐林的分布是随着深度的增加,放线菌呈递减趋势,火烧迹地的10~20 cm与20~30 cm的数量基本相近(图4),皆伐林的0~10 cm与20~30 cm间在P<0.05水平上差异性显著,其他样地土层间差异性不显著(表1)。微生物主要集中在土壤表层是由于地表聚集大量枯枝落叶,有充足的营养源,并且水热和通气状况都比较好,有利于微生物的生长和繁殖。而随着土层加深,有机质和腐殖质的含量减少,土壤温度降低,微生物活动能力减弱,其数量相应降低减少。

图1 微生物总数量垂直变化Figure 1 Vertical change of soil microbe
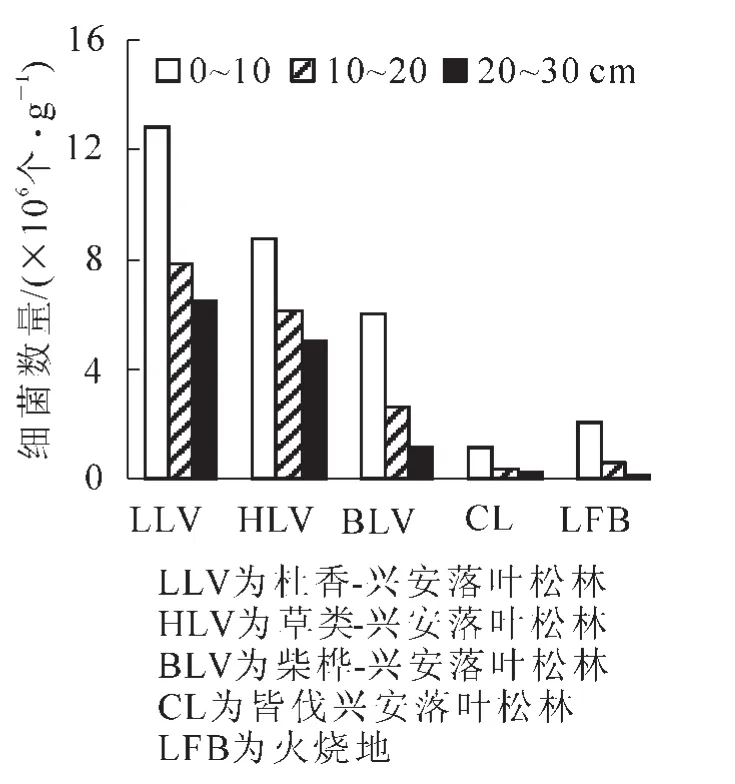
图2 细菌垂直变化Figure 2 Vertical change of bacteria
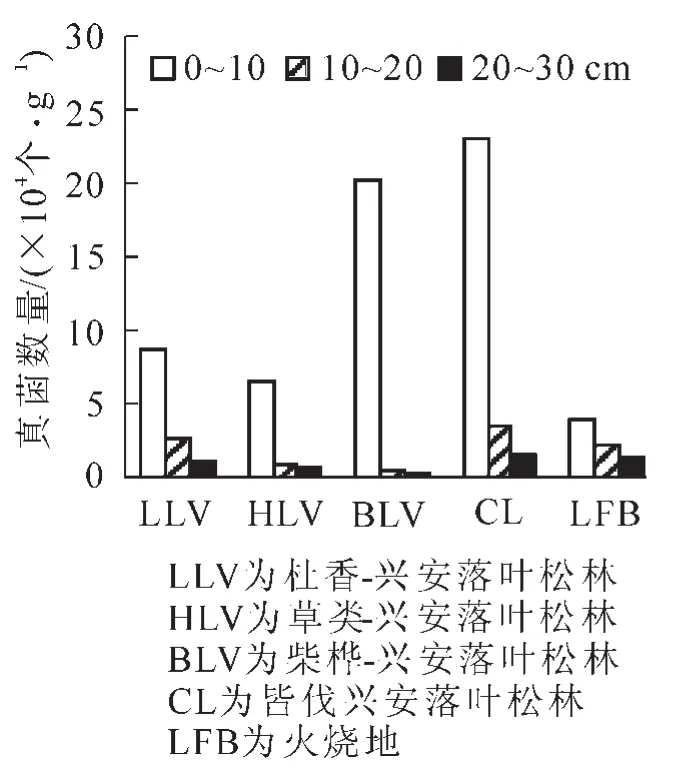
图3 真菌垂直变化Figure 3 Vertical change of fungi

图4 放线菌垂直变化Figure 4 Vertical change of actinomycetes
4 结论
土壤微生物数量与分布受各种生态因素的综合影响,生态环境的地理区域差异是主导因素。研究表明:大兴安岭兴安落叶松林不同林型中细菌占有绝对的优势,占微生物总数的80.19%~96.83%,微生物总量和细菌数量为杜香-兴安落叶松林>草类-兴安落叶松林>柴桦-兴安落叶松林>火烧迹地>皆伐兴安落叶松林,前3个林型土壤微生物数量较大,由于是原始林,人为干扰少,对林下土壤及微生物破坏性小,因此微生物活性强,数量大。
不同林型土壤微生物的垂直分布除放线菌外,其他均是随着土层深度的增加,微生物数量呈递减的趋势,同一林型的0~10 cm与20~30 cm间差异性显著(P<0.05),10~20 cm与20~30 cm间差异性不显著;杜香-兴安落叶松林、草类-兴安落叶松林、柴桦-兴安落叶松林的放线菌10~20 cm高于0~10 cm。
[1]王锐萍,刘强,彭少麟,等.尖峰岭不同树种枯落物分解过程中微生物动态[J].浙江林学院学报,2006,23(3):255-258.WANG Ruiping,LIU Qiang,PENG Shaolin,et al.Dynamics of microorganisms in litters of different tree species at Jianfengling [J].J Zhejiang For Coll,2006,23(3):255-258.
[2]李延茂,胡江春,汪思龙,等.森林生态系统中土壤微生物的作用与应用[J].应用生态学报,2004,15(10):1943-1946.LI Yanmao,HU Jiangchun,WANG Silong,et al.Function and application of soil microorganisms in forest ecosystem[J].Chin J Appl Ecol,2004,15(10):1943-1946.
[3]SCHIPPER L A,DEGENS B P,SPARLING G P.Changes in microbial heterotrophic diversity along five plant successional sequences[J].Soil Biol Biochem,2001,33:2093-2103.
[4]赵萌,方晰,田大伦.第2代杉木人工林地土壤微生物数量与土壤因子的关系[J].林业科学,2007,43(6):7-12.ZHAO Meng,FANG Xi,TIAN Dalun.Relation between the quantity of soil microbe and soil factor in the second rotation Chinese fir plantation [J].Sci Silv Sin,2007,43(6):7-12.
[5]宋漳,朱锦懋,杨玉盛.闽北常绿阔叶林土壤微生物学特性的研究[J].福建林学院学报,2000,20(4):317-320.SONG Zhang,ZHU Jinmao,YANG Yusheng.Studies on soil microbiological characteristics of evergreen broad leaved forest in northern Fujian Province [J].J Fujian Coll For,2000,20(4):317-320.
[6]徐秋芳,姜培坤,陆贻通.不同施肥对雷竹林土壤微生物功能多样性影响初报[J].浙江林学院学报,2008,25(5):548-552.XU Qiufang,JIANG Peikun,LU Yitong.Soil microbial diversity with different fertilizer types and rates in a Phyllostachys praecox stand [J].J Zhejiang For Coll,2008,25(5):548-552.
[7]马晓梅,尹林克,陈理.塔里木河干流胡杨和柽柳根际土壤微生物及其垂直分布[J].干旱区研究,2008,25(2):183-189.MA Xiaomei,YIN Linke,CHEN Li.Study on vertical distribution of microorganisms in rhizosphere of Populus euphratica and Tamarix sp.in the lower reaches of the Tarim River,Xinjiang [J].Arid Zone Res,2008,25(2):183-189.
[8]LONG R J,ZHANG D G,WANG X,et al.Effect of strategic feed supplementation on productive and reproductive performance in Yak Cows [J].Prev Vet Med,1999,38(2-3):195-206.
[9]陈俊蓉,洪伟,吴承祯,等.不同桉树土壤微生物数量的比较[J].亚热带农业研究,2008,4(2):146-150.CHEN Junrong,HONG Wei,WU Chengzhen,et al.Comparison of soilm icrobial amount of different Eucalyptus species[J].Subtrop Agric Res,2008,4(2):146-150.
[10]WANG Qingkui,WANG Silong.Soil microbial properties and nutrients in pure and mixed Chinese fir plantations [J].J For Res,2008,19(2):131-135.
[11]周梅.大兴安岭森林生态系统水文规律研究[M]//周梅.中国森林生态系统定位研究网络系列丛书.北京:中国科学技术出版社,2003:22-27.
[12]MAO Z J,WANG Y J,ZHU Y G,et al.Voronin,prolonged growth of young spruce(Picea koraiensis Nakai) plants at double atmospheric CO2concentration stimulates the preferential growth of thick roots[J].Russian J Plant Physiol,2005,52(5):741-746.
[13]NYMAN J A.Effect of crude oil and chemical additives on metabolic activity of mixed microbial populations in fresh marsh soils [J].Microb Ecol,1999,37(2):152-164.
[14]许光辉,郑洪元.土壤微生物分析方法手册[M].北京:农业出版社,1986:92-110.
[15]LOUISE M D,GWYNS G,JOHN H,et al.Management influences on soil microbial communities and their function in botanically diverse hay meadows of northern England and Wales [J].Soil Biol Biochem,2000,32:253-263.
