SEA体内杀伤S180肉瘤效果及其细胞因子的测定*
2010-07-21孙嘉琳冯艳敏李政楠张洪娜
张 云 孙嘉琳 王 雪 冯艳敏 李政楠 张洪娜
目前研究的金黄色葡萄球菌肠毒素A(即超抗原SEA)诱导的细胞毒性T细胞(CTL)对肿瘤细胞有强大的杀伤作用[1]。在临床实践中需要能对肿瘤细胞进行特异性杀伤的治疗方法,而可选择性地与肿瘤细胞结合的抗体的出现为肿瘤的生物治疗提供了新的选择[2]。SEA抗肿瘤细胞的体外实验已经有很多报道,并被证实存在一定的杀伤效果[3],而小鼠体内肿瘤模型的成功建立为SEA体内杀伤肿瘤细胞的研究提供了便利的条件。本研究利用SEA对小鼠的肿瘤细胞进行治疗,证实了SEA的体内杀伤效果,并探讨其杀伤肿瘤细胞的机制。
1 材料与方法
1.1 材料 Balb/c雄性小鼠40只,体质量18~22 g,SPF级,购自中国人民解放军军事医学科学院实验动物中心,许可证号 SCXK-(军)-2002-001。随机分成 4组,SEA 低剂量组(0.05 mg/kg),SEA 中剂量组(0.25 mg/kg),SEA 高剂量组(0.5 mg/kg)和生理盐水对照组,每组10只,前3组为实验组。S180细胞为天津科技大学食品学院馈赠。SEA为本实验提取,生理盐水注射液、干扰素(IFN)-γ鼠单克隆抗体购自南京金斯瑞生物科技有限公司,山羊抗小鼠SP检测试剂盒购自上海西塘科技有限公司,DAB显色试剂盒购自上海麦莎生物科技有限公司,苏木素染色液购自北京赛驰生物科技有限公司,IFN-γ ELISA试剂盒购自北京四正柏生物科技有限公司。
1.2 方法
1.2.1 小鼠肿瘤模型的建立 取冻存复苏的S180细胞株在5%CO2恒温培养箱中培养,传2~3代,取处于对数生长期的瘤细胞,用生理盐水稀释成1×107/mL的瘤细胞悬液,取其中0.2 mL对小鼠进行腹腔注射,10 d后,抽取小鼠腹水细胞。腹水细胞传2~3代后,抽取离心,用生理盐水洗2次,并稀释成1×107/mL的瘤细胞悬液,以每只小鼠0.2 mL接种于小鼠右前腋皮下。接种24 h后开始给药,实验组每鼠腹腔注射0.2 mL相应浓度的SEA,对照组注射等量生理盐水,隔天给药共4次。
1.2.2 肿瘤体积测量 接种后第5天,用游标卡尺开始测量肿瘤大小,连续测量5 d,并记录下数据。
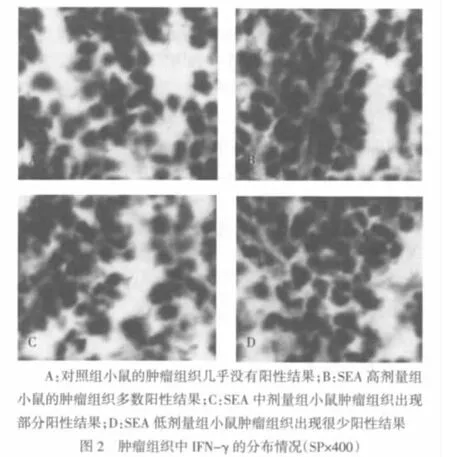
1.2.3 免疫组化法检测组织中细胞因子IFN-γ的分布情况 给药第8天,解剖小鼠并取下肿瘤组织,甲醛溶液固定,石蜡包埋,切5 μm厚的切片,组织脱蜡至水。在组织切片上滴加3%H2O2溶液,孵育15 min,以消除内源性过氧化物酶的干扰;蒸馏水稍洗后,PBS洗5 min;滴加血清封闭液,孵育15min,甩去封闭液,滴加一抗,37℃孵育3 h,然后按二抗试剂盒说明书滴加各工作液,DAB显色,稍洗后,苏木精染色,自来水冲洗,盐酸乙醇分化20 s。70%乙醇30 s→80%乙醇30 s→95%乙醇Ⅰ2 min→95%乙醇Ⅱ2 min→100%乙醇Ⅰ3 min→100%乙醇Ⅱ3 min→二甲苯Ⅰ透明7 min→二甲苯Ⅱ透明7 min→中性树胶封片。显微镜观察结果并拍照。
1.2.4 ELISA法测细胞因子IFN-γ指标 于末次给药后24h,眼眶静脉丛取血,每只小鼠取0.2 mL,离心,取上清,并取出肿瘤组织和脾脏,称质量,计算肿瘤抑制率和脾脏指数。肿瘤抑制率(%)=(对照组肿瘤质量-实验组肿瘤质量)/对照组肿瘤质量;脾脏指数=脾脏质量(mg)/小鼠体质量(g)。用 PBS溶液溶解,采用酶标双抗体夹心ELISA法测定血清、肿瘤和脾脏中IFN-γ的水平。按试剂盒说明书加标准品及上清液,加相应的多克隆抗体,37℃孵育60 min,洗涤后加入辣根过氧化酶标记的抗体,再次孵育,洗涤后加显色剂,终止反应,492 nm波长处测吸光度,绘制标准曲线,计算出血清样本IFN-γ含量。
1.3 统计学方法 采用SPSS 13.0统计软件,先进行正态性检验及方差齐性分析,多组间均数比较用单因素方差分析,两两比较采用SNK法进行q检验。P<0.05为差异有统计学意义。
2 结果
2.1 Balb/c小鼠瘤体积及生长曲线 SEA组实体瘤体积均比生理盐水对照组瘤体积增长缓慢,其中SEA高剂量组与对照组肿瘤体积相差最多,见图1。
2.2 各组小鼠各项指标比较 见表1。与对照组比较,SEA中剂量组和SEA高剂量组肿瘤质量下降,差异有统计学意义(P<0.05)。而SEA各组脾脏指数反而上升,除低、中剂量组外,各组比较差异有统计学意义,并且各组间随着SEA剂量的增大,脾脏指数增加,肿瘤质量减少。肿瘤组织中IFN-γ的分布情况见图2。与对照组比较,SEA各剂量组血清中IFN-γ 均明显增多,差异有统计学意义(P < 0.05)。并且SEA低剂量组分别与SEA中剂量和SEA高剂量比较,差异均有统计学意义(P<0.05或P<0.01)。SEA高剂量组的抑瘤率高于低、中剂量组,差异有统计学意义(P<0.05或P<0.01),低、中剂量组差异无统计学意义。
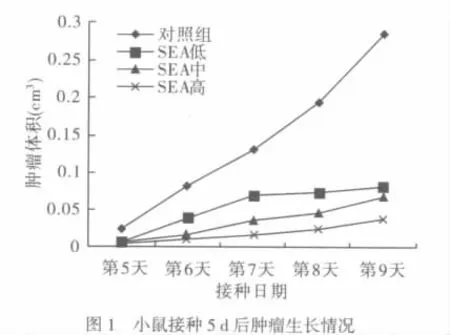
表1 解剖后各组小鼠的各项指标比较(n=10±s)
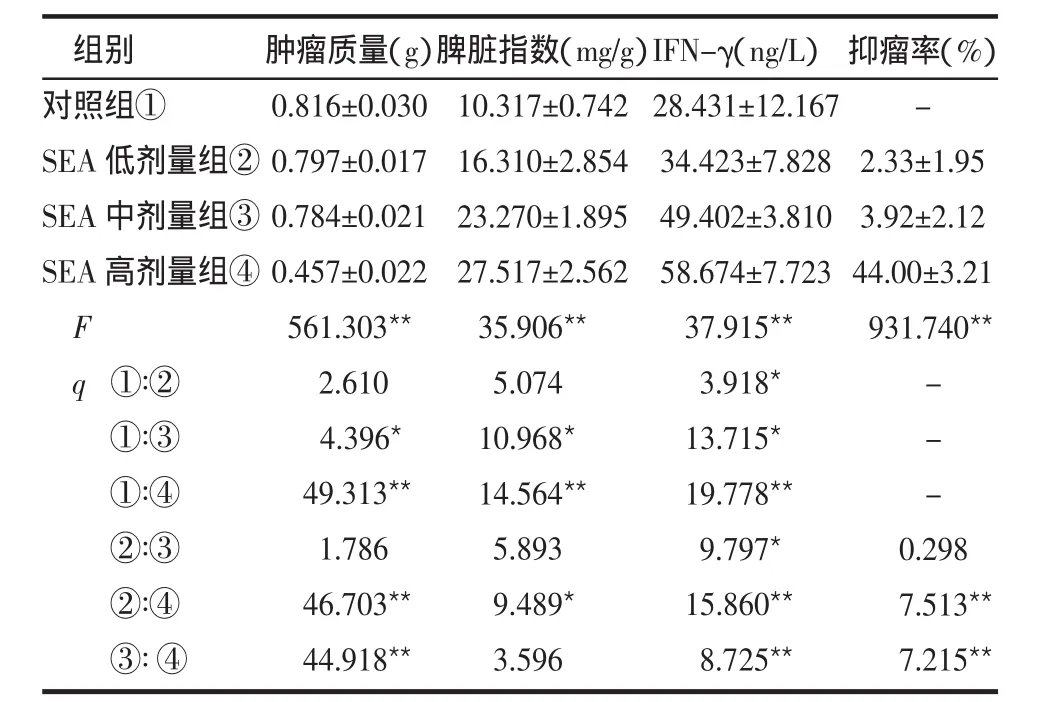
表1 解剖后各组小鼠的各项指标比较(n=10±s)
觹P < 0.05,觹觹P < 0.01
组别对照组①SEA低剂量组②SEA中剂量组③SEA高剂量组④F q①∶②①∶③①∶④②∶③②∶④③∶④0.298 7.513**7.215**肿瘤质量(g)0.816±0.030 0.797±0.017 0.784±0.021 0.457±0.022 561.303**2.610 4.396*49.313**1.786 46.703**44.918**脾脏指数(mg/g)10.317±0.742 16.310±2.854 23.270±1.895 27.517±2.562 35.906**5.074 10.968*14.564**5.893 9.489*3.596 IFN-γ(ng/L)28.431±12.167 34.423±7.828 49.402±3.810 58.674±7.723 37.915**3.918*13.715*19.778**9.797*15.860**8.725**抑瘤率(%)-2.33±1.95 3.92±2.12 44.00±3.21 931.740**---
3 讨论
干扰素是由多种细胞产生的具有广泛生物学活性的细胞因子家族,其功能主要包括抗病毒、免疫调节、抑制细胞增殖、影响细胞分化、抑制血管生成等[4]。IFN-γ主要由活化T细胞产生,在小鼠,由Th1亚群产生。当抗原刺激后T细胞分泌IFN-γ,通常与IL-2的产生相一致。干扰素作为具有较强抗肿瘤活性和免疫调节作用的细胞因子[5],在肿瘤生物治疗中占据了较为重要的位置。相信随着对干扰素生理活性和作用机制的深入认识,可以进一步提高其临床治疗效果,在肿瘤治疗领域也将具有更广阔的应用前景。
本实验结果显示,SEA组小鼠肿瘤生长速度明显低于生理盐水对照组,治疗结束后SEA组肿瘤质量及瘤体积明显低于对照组,表明SEA可以抑制S180肿瘤细胞的生长。且肿瘤的生长情况与SEA的剂量有关,随剂量的增大而呈下降趋势,而实验中,脾脏指数却随SEA剂量的增大呈现上升趋势,说明SEA杀伤肿瘤的效果与T细胞的激活有关,从ELISA实验中测得血清中IFN-γ的水平可以看出,肿瘤细胞死亡的原因在于T细胞分泌的细胞因子IFN-γ大量增多,说明超抗原SEA可刺激机体产生杀伤性很强的细胞毒T细胞(CTL)及大量的细胞因子,对肿瘤具有很强的杀伤作用。它们能与多数T细胞结合并为T细胞活化提供信号,而普通抗原只能与少数对应T细胞结合并使之活化[6]。但是由于极微量的超抗原就可激活大量T细胞并大量分泌细胞因子,因此如果在应用时剂量掌握不准,就有可能引起机体免疫调节功能紊乱而产生超敏反应,导致一系列急慢性疾病的发生,如毒素中毒综合征、风湿性关节炎、风湿热、川崎病和非特异性皮炎等。超抗原杀伤肿瘤细胞的同时对正常细胞也有杀伤作用[7]。对SEA细胞靶向定位杀伤肿瘤细胞技术还有待进一步研究,进而降低SEA的不良反应。
同时对于SEA是否能促进其他因子的分泌,分泌的IFN-γ等细胞因子通过哪条途径作用于肿瘤细胞等还有待于深入研究,以利用其机制进一步提高其抗肿瘤潜能的途径和方法;最后,通过基因重组的方法对干扰素蛋白进行改造[8],可提高其生物学活性,并降低不良反应。
[1] Liyanage UK,Moore TT,Joo HG,et al.Prevalence of regulatory T cells is increased in peripheral blood and tumormicroenvironment of patients with pancreas or breast adenocarcinoma [J].J Immunol,2002,169(5):2756-2761.
[2] Forsberg G,Ohlssonk Brodin T,et al.Therapy of human nonsmall-cell lung carcinoma using antibody targeting of a modified superantigen[J].Bri J Cancer,2001,85(1):129.
[3] 许桂莲,朱锡华,杨劲,等.超抗原SEA诱导T细胞无能的作用机制探讨[J].细胞与分子免疫学杂志,2002,18(6):105-107.
[4] Yu J,Tian R,Xiu B,et al.Antitumor activity of T cells generated from lymph nodes draining the SEA-expressing murine B16 melanoma and secondarily activated with dendritic cells[J].Int J Biol Sci,2009,5(2):135-146.
[5] Ushijima T,Sasako M.Focus on gastric cancer[J].Cancer Cell,2004,5(2):121-125.
[6] 许从峰,汪成孝,江之泉,等.超抗原SEA抗肿瘤作用研究进展[J].国外医学·肿瘤学分册,2001,28(3):165-166.
[7] Hedlund G,Dohlsten M,Petersson C,et al.Superantigen-based tumor therapy in vivo activation of cytotoxic T cells[J].Cancer Immunol Immunother,1993,36(2):89-93.
[8] Zheng G,Chen A,Sterner RE,et al.Induction of antitumor immunity via intratumoral tetra-costimulator protein transfer[J].Cancer Res,2001,61(22):8127-8134.
