尿素包合法纯化ARA的研究
2010-07-04李丽娜于长青韩玉玺
李丽娜,于长青,韩玉玺
(1.黑龙江省农产品加工工程技术研究中心,大庆 163319;2.农业部农产加工品质量监督检验测试中心(大庆))
花生四烯酸(Arachidonic acid,ARA或 AA)是5,8,11,14-二十碳四烯酸,是人体前列腺素合成的重要前体物质,具有益智健脑,提高视敏度,酯化胆固醇,抑制血小板凝集,降低血液粘度,调节血脂和血糖,保护皮肤,抗炎症等功能,已经在保健食品、化妆品、医药等领域得到广泛应用[1]。
由于ARA具有广泛的生物活性,其应用前景十分看好,而且它的纯度越高,价值就越大。ARA的提取方法很多,如传统的有机溶剂法,脂肪酶法等[2-4]。尿素包合法所需设备简单,操作方便,药品、试剂也便宜。在碳链长度相同的情况下,脂肪酸饱和度越高,越容易与尿素包合物,根据这个性质,可以将饱和度不同的脂肪酸分开,达到分离纯化的目的[5-6]。本研究之前采用CO2超临界萃取将微生物油脂从发酵液中提取出来,并将碳链长度不同的不饱和脂肪酸分开,现采用尿素包合法将饱和度不同的脂肪酸分开。
1 材料和方法
1.1 原料
经CO2超临界萃取得到的深黄被孢霉YZ-124微生物油脂,ARA含量19.34%。
1.2 试剂
ARA标准品(色谱纯)美国Sigma公司;正己烷(色谱纯)、甲醇、乙醇、乙醚、石油醚(分析纯)天津市科密欧化学试剂开发中心;尿素、氢氧化钠(分析纯)天津市大茂化学试剂厂;无水硫酸钠(分析纯)天津市光复科技发展有限公司。
同时应用气相色谱分析ARA的纯度,为ARA的研究开发提供试验科学依据。
1.3 仪器设备
微量移液器(100~1000 μL)芬兰雷伯公司;气相色谱仪(GC 9900型)上海科创色谱仪器有限公司;旋转蒸发仪(RE-52A)巩义市予华仪器有限责任公司;电子分析天平(JD100-3B)沈阳龙腾电子有限公司;电热恒温水槽(DZKW-G)上海森信实验仪器有限公司;循环水式多用真空泵(SHB-ⅢA)郑州长城科工贸有限公司。
1.4 实验方法
1.4.1 微生物油脂的提取
高产菌株YZ-124的发酵液经过预处理,用超临界CO2对发酵液进行萃取。萃取压力16 MPa、萃取温度32.5℃,萃取时间90 min,分离器Ⅰ温度37.5℃,分离器Ⅱ温度42.5℃,CO2流量15 g·h-1。从分离器Ⅰ中得到清澈透明、色泽淡黄的微生物油脂,经过旋转蒸发除去夹带剂和多余水分,得到的微生物油脂装入棕色试剂瓶,置于4℃冰箱备用。
1.4.2 油脂的前处理
油脂由脂肪酸甘油三酯组成,各种脂肪酸在甘油碳架上的排列是无序的,而且空间位阻较大,难以分离。但乙酯型稳定性好,因而,尿包时要先将脂肪酸从甘油三酸酯中解离下来,进行乙酯化处理后再进行尿素包合。微生物油脂按一定比例加入3%的NaOH-乙醇溶液,置于脂肪瓶中,在60℃的水浴中加热回流,得皂化液。冷却至室温后,加入适量水使生成的少量皂完全溶解,用10%的HCL溶液酸化混合液至pH=2~3,加正己烷萃取,分层,去下层的水层。有机相水洗至中性,加入Na2SO4脱水,抽滤,用旋转蒸发器蒸出溶剂,得到混合脂肪酸或混合脂肪酸乙酯。
1.4.3 尿素包和法纯化ARA
一定量的有机溶剂中加入适量尿素,70℃水浴加热溶解,待尿素完全溶解后,既得尿素的饱和溶液。在一定量的尿素饱和溶液中加入适量的混合脂肪酸,65℃水浴加热回流,混合物变成清澈透明的溶液后,室温冷却30 min,于一定温度的冰箱中放置一定时间。然后减压抽滤除去尿素晶体及形成的包合物。滤液中加入适量正己烷,用10%的HCl溶液酸化滤液至pH=2-3,加入适量水充分萃取,去下层的水层,把有机相水洗至中性。加入无水硫酸钠脱水,抽滤,用旋转蒸发器蒸出溶剂,得到高纯度的ARA。
1.4.4 气相色谱分析ARA含量
样品的处理方法:取微生物油脂20 mg溶于2.5 mL正己烷中,加入0.1 mL 0.5 M的甲醇钠溶液,室温下轻摇5 min,然后加入少量的无水Na2SO4去除水分,静置1 h后,于3000 rpm下离心3 min,上清液进样。
气相色谱条件:色谱柱为弹性石英毛细管柱FFAP(30 m×0.32 mm×0.5 um);柱初温为 100 ℃,以8℃·min-1升温至240℃,然后恒温至完成分析;汽化室温度为250℃;载气流量为48 mL·min-1;氢气流量为 42 mL·min;空气流量为 261 mL·min-1;尾吹流量为34 mL·min-1;进样量为4 μL。测定结果以面积归一法计算ARA的含量。
2 结果
2.1 尿素与脂肪酸的质量比对尿素包合反应的影响
为考察尿素与脂肪酸的质量比对尿素包合反应的影响,控制反应条件为:包合温度-15℃,包合时间12 h,分别选择尿素:混合脂肪酸为 1∶1、2∶1、3∶1、4∶1、5:1(W:W:W)的条件下进行实验,每个实验水平进行三次重复实验,实验结果如图1。
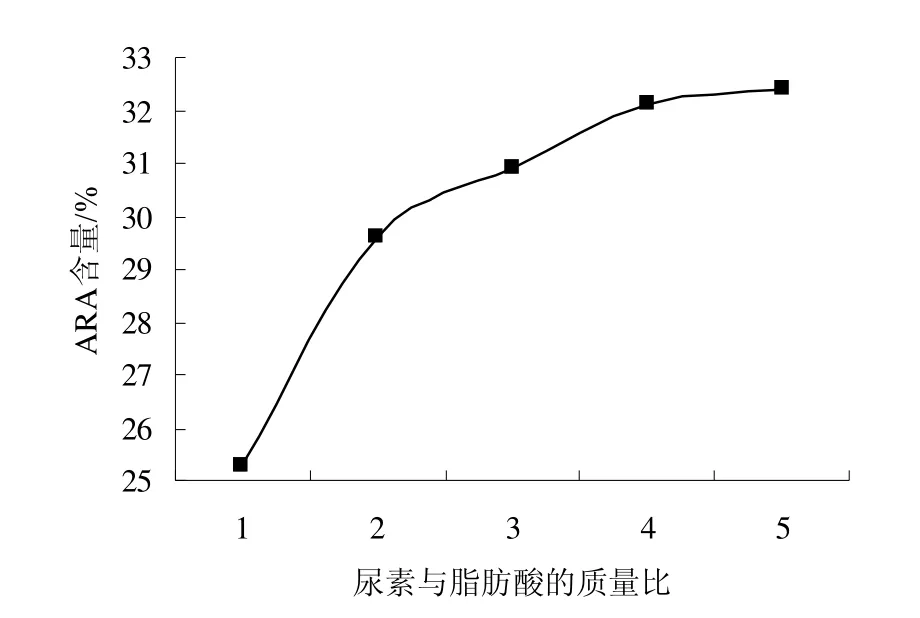
图1 尿素与脂肪酸的质量比对尿素包合反应的影响Fig.1 Effect of the quality ratio of urea and fatty acid on the urea inclusion result
由图1可以看出,ARA含量随尿素与脂肪酸质量比的增加而升高,但后期增加幅度缓慢。尿素与脂肪酸质量比为4∶1和5∶1时,对ARA的饱和反应最好。由方差分析可得,质量比为4∶1和5∶1时,得到的ARA纯度差异不显著,为了兼顾各方面的因素,采用了4∶1的比例,最终得到的微生物油脂中ARA含量为30.9%。其原因为包合所需尿素的用量不随温度的变化而变化,包合前油脂中其它组分的浓度也不会影响尿素的用量,脂肪酸和尿素的摩尔比只随脂肪酸的饱和度不同而不同。但在实际操作中,如果尿素用量较小,脂肪酸则按其平衡常数竞争性与尿素络合,饱和度高的脂肪酸优先形成包合物而沉淀;随着尿素用量增加,单烯及双烯脂肪酸也相继形成包合物析出[7]。
2.2 温度对尿素包合反应的影响
为考察温度对尿素包合反应的影响,控制反应条件为:包合时间 12 h,混合脂肪酸∶尿素∶乙醇为 1∶4∶12(W∶W∶W),分别在 5、0、-5、-10、-15 ℃的条件下进行实验,每个实验水平进行三次重复实验,实验结果如图2。
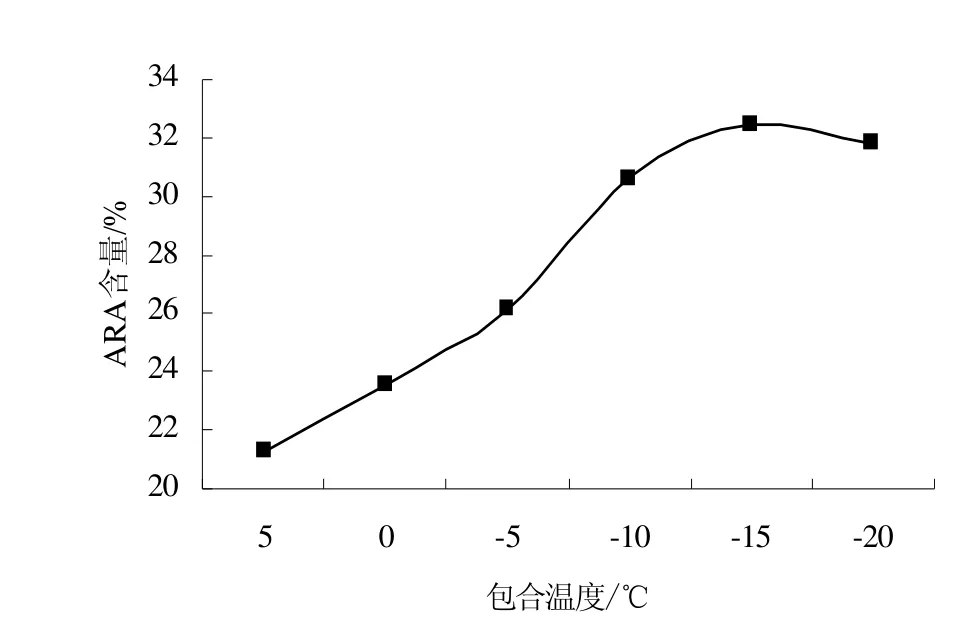
图2 温度对尿素包合反应的影响Fig.2 Effect of the temperature on the urea inclusion result
由图2可以看出,ARA含量随温度的降低先上升后下降,当温度为-15℃时,ARA含量最高,为32.4%;当温度低于-15℃时,ARA含量随温度的降低而下降,因此选择包合温度为-15℃。其原因为尿素包合反应是一个放热的反应,降低温度时,反应向生成尿素包合物的方向进行,包合温度随不饱和度的增加而降低。结晶温度高时,短链或低不饱和的脂肪酸与尿素形成的包合物难以稳定,并且不易析出;结晶温度低时,饱和脂肪酸或低不饱和脂肪酸易与尿素形成包合物,但结晶形成缓慢[8]。因此,可以通过调节包合温度,来分离饱和度不同的脂肪酸。要包合混合物中的ARA需要较低温度,但温度过低,会导致DHA等比ARA不饱和度更高的脂肪酸被大量富集,从而降低了ARA在脂肪酸中的含量。
2.3 时间对尿素包合反应的影响
为考察时间对尿素包合反应的影响,控制反应条件为:包合温度-15℃,混合脂肪酸:尿素:乙醇为1∶4∶12(W∶W∶W),分别反应 8、10、12、14、16 h,每个实验水平进行3次重复实验,实验结果如图3。
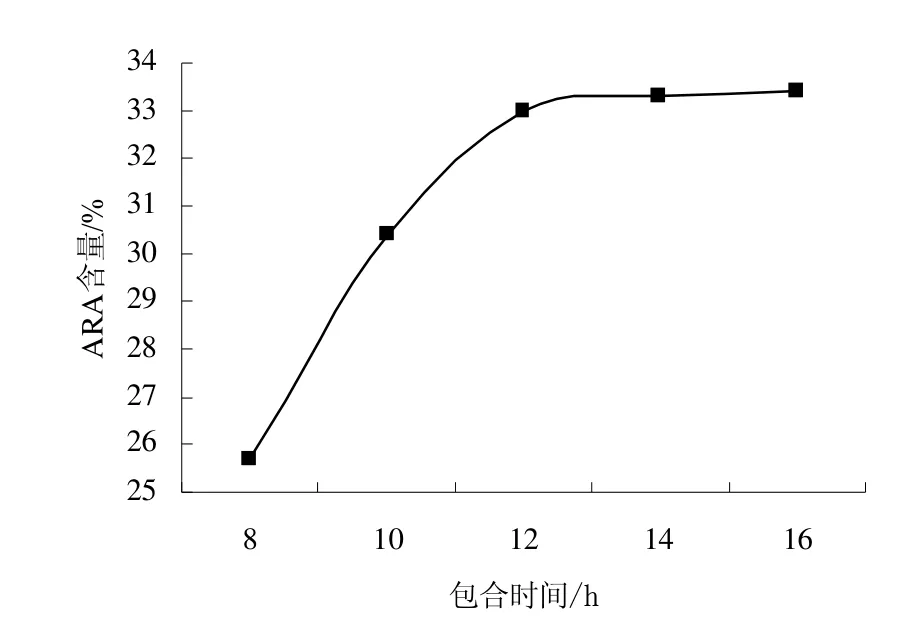
图3 时间对尿素包合反应的影响Fig.3 Effect of the time on the urea inclusion result
由图3可以看出,随着时间的延长,ARA含量逐渐增加,但后期ARA含量的提高不明显,再增加时间,ARA含量也不能显著提高。根据方差分析结果来看,包合时间在16、14和12 h时ARA含量差异不显著,综合考虑,确定包合时间为12 h。
2.4 对尿素包合反应的影响
为考察溶剂种类对尿素包合反应的影响,控制反应条件为:混合脂肪酸:尿素:溶剂为 1∶4∶12,包合温度-15℃,包合时间12 h,分别以95%的乙醇和95%的甲醇作溶剂,纯化微生物油脂中的ARA,每个实验水平进行三次重复实验,实验结果如表1。

表1 溶剂种类对尿素包合效果的影响Table 1 Effect of solvent varieties on the urea inclusion result
由表1以看出,在同样的反应条件下,甲醇和乙 醇分别作为尿素包合反应中溶解尿素的溶剂,甲醇的效果好于乙醇。而且,试验中还发现用甲醇做溶剂时溶解尿素和回收溶剂都比乙醇要容易一些。但考虑到包合的成本和甲醇的毒性及操作的安全性,尿素包合法富集微生物油脂中ARA仍以乙醇为溶剂较佳。
2.5 条件优化结果
在单因素实验的基础上,采用L9(34)正交试验,对ARA的纯化工艺条件进行优化,每个实验水平进行三次重复实验。试验因素水平见表2,试验结果见表3。

表2 试验因素水平表Table 2 Factors and levels of the orthogonal test
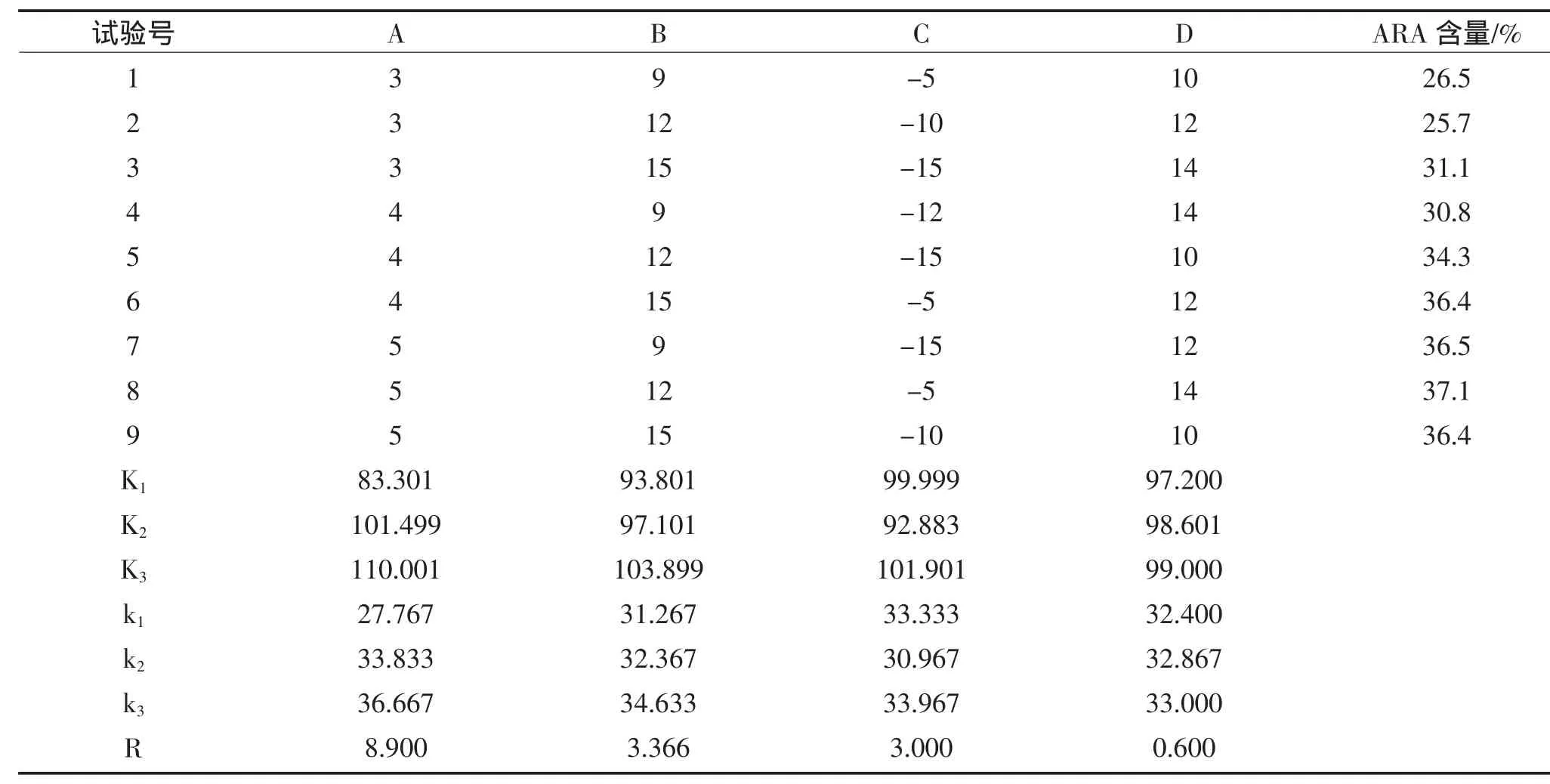
表3 尿包法纯化ARA的正交试验结果Table 3 The Result of the orthogonal test on enriching ARA
由表3可以看出,纯化工艺参数对ARA浓度的影响主次为:尿素量>溶剂量>包合温度>包合时间。对正交试验结果进行方差分析,结果如表4。

表4 方差分析表Table 4 Analysis of variance
经方差分析,尿素用量对ARA纯度的影响达到极显著水平(p<0.01),溶剂相对质量和包合温度对ARA纯度的影响达到显著水平(p<0.05)。对表4数据作图,试验因素水平对ARA的浓度的影响直观趋势图见图4。

图4 正交试验结果直观分析图Fig.4 Range analysis of the result of orthogonal test
由图4可以看出:尿素包合反应的最佳条件为A3B3C3D2,即脂肪酸∶尿素∶95%乙醇=1∶4∶12(W∶W∶W),包合温度为-15℃,包合时间为12 h时,产品中ARA的浓度达到的最高值。
2.6 气相色谱分析结果
本研究所采用的毛细管气相色谱程序升温条件,可以将饱和与不饱和长链脂肪酸甲酯分开。检测出的脂肪酸结果如图5。
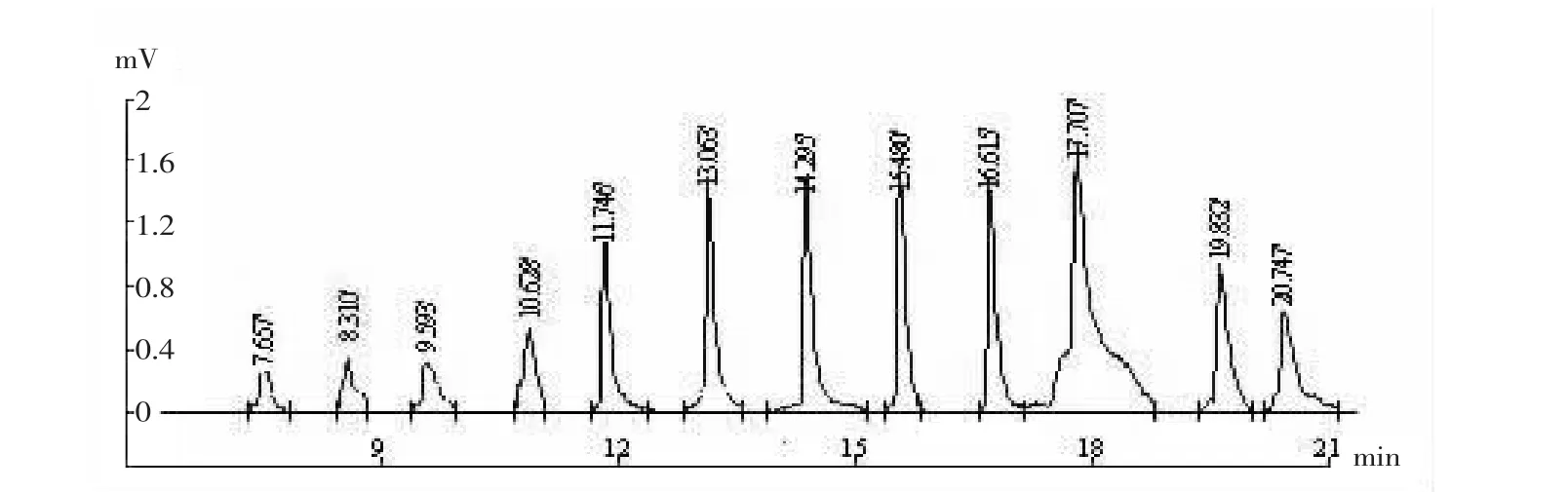
图5 微生物油脂气相色谱分析结果Fig.5 The gas chromatographic analysis result of microbes olein
结果表明,高产菌株YZ-124的微生物油脂经过尿素包合法纯化后,ARA的保留时间为17.707 min,ARA含量为36.84%,比纯化前提高90.49%。
3 结论
本文采用正交试验确定了尿素包合反应的最佳条件为:尿素∶脂肪酸为 4∶1(W∶W)、脂肪酸:乙醇为1∶12(W∶W)、包合温度为-15 ℃和包合时间为 12 h。通过方差分析和单因子效应分析得出尿素用量对ARA纯度的影响达到极显著水平(p<0.01),溶剂相对质量和包合温度对ARA纯度的影响达到显著水平(p<0.05)。在所选择的正交试验的因素和水平范围内,各种影响因素对ARA浓度的影响主次为:尿素量>溶剂量>包合温度>包合时间。按照优化的包合条件进行试验,得到的微生物油脂中ARA含量为36.84%,比纯化前提高90.49%。
[1]于长青,李丽娜.花生四烯酸研究进展[J].农产品加工(学刊),2007,(4):10-12.
[2]施东奎,胡春梅.花生四烯酸的主要作用及提取方法[J].中国中药杂志,2007,32(11):1009-1011.
[3]HAN XJ,XU P,MENG XL,etal.Preraration ofhigh-purity lino-lenic acid from oil of Lithospermum Erythrohizon by urea inclu-sion and column chromatography[J].JChin Pharm Sci,2004,13(1):53-57.
[4]Gamez,Meza N.Concentration of eicosapentaenoic acid and docosahexaenoic acid from fish oil by hydrolysis and urea complexation[J].Foodresearchinternational,2003,36(7):721-727.
[5]Liu Shucheng,ZhangChaohua,HongPengzhi, etal.Concentration ofdocosahexaenoic acid(DHA) and eicosapentaenoic acid(EPA) oftuna oilby urea complexation:optimization of process parameters [J].Journal of food engineering,2006,73:203-207.
[6]顾小红,孙素玲,汤坚,等.尿素包合法富集海狗油中的多不饱和脂肪酸[J].食品与机械,2005,22(4):15-18.
[7]刘书成,李德涛,欧冠强,等.尿素包合法富集蛇鲻鱼油中EPA 和DHA的研究[J].广东海洋大学学报,2008,28(3):61-65.
[8]刘凤霞,薛刚,高秋华,等.高纯度γ-亚麻酸包合工艺研究Ⅰ-皂化值及皂化反应[J].中国中药杂志,2005,30(5):343-346.
