原发性肝癌患者移植前、后肝内肿瘤的CT/MRI影像学对照研究
2010-06-30邵硕姜在波王劲李名安李征然吴春周斌刘涛单鸿
邵硕 姜在波 王劲 李名安 李征然 吴春 周斌 刘涛 单鸿
目前肝移植已成为我国原发性肝癌治疗的重要手段之一[1-2],但移植术后肿瘤复发转移在一定程度上限制了肝癌肝移植的开展,因此深入探讨肿瘤复发特性及复发后治疗问题具有重要意义。笔者收集了43例原发性肝癌患者接受肝移植的临床资料,重点分析了患者移植前原发灶、移植后复发灶的CT/MRI影像学资料,从病灶形态表现、血供特征初步探讨肝内肿瘤复发的生物学特性,同时监测患者移植前和移植后复发时的血清AFP含量变化,以期对临床治疗有所帮助。
1 资料与方法
1.1 纳入标准 ⑴患者接受肝移植,且术后病肝均经病理学证实为肝细胞性肝癌;⑵同一患者肝移植术前及复发后的CT/MRI影像资料完整;⑶移植后首次显示肝内复发转移灶的CT/MRI影像资料,伴或不伴其它部位转移,未做过针对性治疗(如TACE、RF、化疗或切除等)。
1.2 临床资料 2003年10月至2009年7月,中山大学肝移植中心行同种异体原位肝移植术治疗的389例肝癌患者中,符合条件的43例患者,男38例,女5例,年龄24~69岁,中位年龄48岁。所有患者均监测移植前、后的AFP浓度,术后每月行腹部彩超复查。一旦彩超发现肝内占位或患者AFP升高,及时行CT/MRI检查。

图1 a-1b 肝移植前MRI扫描示肝左右叶巨块型肝癌并周围子灶形成,动脉期明显强化,静脉期强化减退,呈快进快出。

图1 c-1d 肝移植后9月CT扫描示肝左右叶多结节复发灶,动脉期明显强化,静脉期强化减退,呈快进快出。
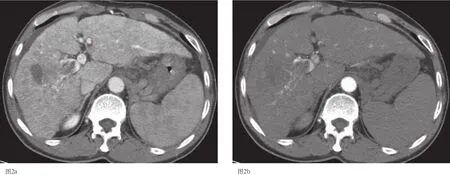
图2 a-2b 肝移植前CT扫描示肝右叶弥漫型肝癌,并门脉癌栓形成,动脉期及静脉期均无明显强化。

图2 c-2d 肝移植后5月CT扫描示肝左右叶弥漫结节灶,并门脉癌栓形成,动脉期明显强化,静脉期强化减退,呈快进快出。
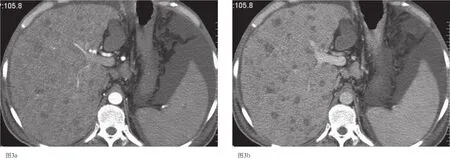
图3 a-3b 肝移植前CT扫描示肝左右叶弥漫型肝癌,动脉期及静脉期均无明显强化。
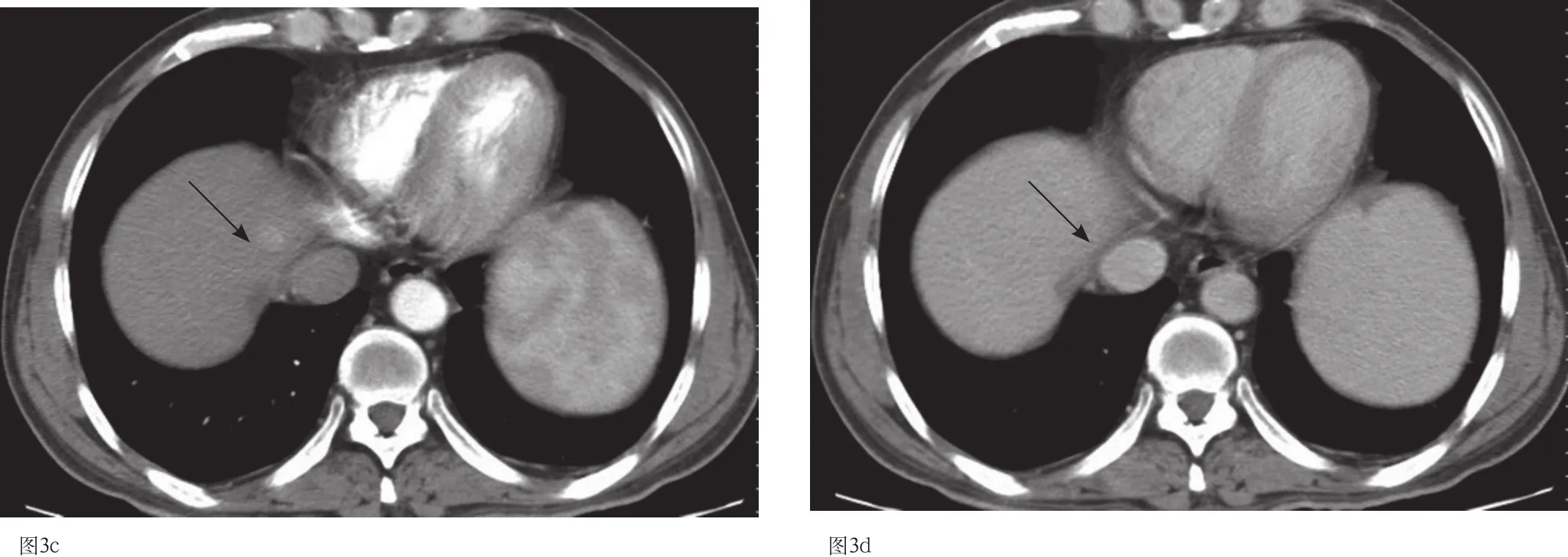
图3 c-3d 肝移植后14月CT扫描示肝右叶单发结节灶,动脉期明显强化,静脉期强化减退,呈快进快出(箭头)。
1.3 影像学检查方法 (1)CT检查:采用GE LightSpeed QX/iCT扫描机,层厚5mm连续扫描,Pitch1.0。先行平扫,其后经高压注射器于静脉内注入对比剂碘普罗胺(300mg/ml)或碘帕醇(300mg/m1)80~100ml,注射流率为3.0ml/s,然后行腹部三期动态增强扫描,对比剂注射开始后20~25s为肝动脉期,60s时为门静脉期,90~120s时为肝实质期。(2)MRI检查:采用GE SIGNA TWIN SPEED1.5MR扫描仪,常规采用T1WI、脂肪抑制T2WI序列,行上腹部横断面、冠状面及矢状面扫描。
1.4 肿瘤分型 根据肿瘤形态学分为(1)巨块型(≥5cm),伴或不伴子灶;(2)结节型(<5cm),包括单发及多发结节灶(≥2枚);(3)弥漫型表现为弥漫小结节(<3cm)分布于全肝。根据肿瘤血供类型分为:(1)血供丰富型(快进快出);(2)血供不丰富型(非快进快出),包括轻度延迟强化及无明显强化。3人盲法下阅片,对肿瘤血供、形态进行分型归类,意见不一致时经协商决定。
1.5 统计学方法 采用SPSS13.0统计学软件对同一患者原发肿瘤与移植后复发肿瘤的血供及AFP定量差异进行分析,P<0.05为有统计学意义。
2 结果
2.1 移植术后复发情况 以CT/MRI发现肝内占位病灶时计算复发时间,复发时间1~18个月(平均10个月),其中24例≤12月,19例>12月。43例患者肿瘤复发后生存时间为1~43个月,平均生存时间14.19个月。12例患者肿瘤复发后行以TACE为主的介入治疗,平均生存期为17.26个月。
2.2 移植前、后肝内肿瘤CT/MRI影像学表现(表1)
从表1可以看出,移植术前、后肝内肿瘤均易累及多叶。就形态而言,移植前原发肿瘤以巨块型为主(29/43例,占67.4%),移植后复发肿瘤以多发结节型为主(33/43例,占76.7%)。原发、复发肿瘤均以血供丰富型为主(37例vs 33例,分布86.0% vs 76.7%)。
同一患者移植前、后肿瘤血供对比如下(表2),35/43例血供一致(图1a-1d),8/43例血供不一致(图2a-2d,图3a-3d)。同一患者移植前、后肿瘤血供差异无统计学意义(P=0.289)。
2.3 移植前及复发后患者AFP变化情况(表3)43例HCC患者术前血清AFP浓度范围为2.9~35350ng/ml,中位AFP浓度为476ng/ml;复发后血清AFP浓度范围为3.9~1210ng/ml,中位AFP浓度为342ng/ml。我国于2001年制定的原发性肝癌临床诊断与分期标准,AFP标准值定为400ng/ml[3]。术前AFP大于400ng/ml者22/43例,AFP小于400ng/ml者21/43例。复发后AFP大于400ng/ml者15/43例,AFP小于400ng/ml者例28/43例。其中30例患者移植前及肿瘤复发后血清AFP均大于400ng/ml者12例,均小于400ng/ml者18例。同一患者移植前、后血清AFP变化差异无统计学意义(P=0.092)。
3 讨论
肝细胞肝癌是我国最常见的恶性肿瘤之一,我国患者占全世界的58.8%,新发病例占全世界的43%[4],总体预后较差。肝移植手术的开展和成熟,开创了治疗原发性肝癌的新领域,给部分不能行根治性切除的肝癌患者带来了希望。但肝癌患者移植术后的复发率较高,生存率较低,因此行肝癌肝移植的患者,要做好1年内复发的准备,早期发现,早期治疗,并强调带瘤生存。
CT/MRI检查在肝癌肝移植诊断中具有重要意义,能较准确地提示病灶部位、大小、形态、血供及有无转移等多方面有价值的信息[5]。本组病例移植前、后肝内肿瘤均易累及多叶。就形态而言,术前肿瘤以巨块型为主(29/43例);术后复发肿瘤以多发结节型为主(33/43例),边界多数清晰,可能由于癌细胞通过血行转移在肝内播散。就血供而言,有学者认为肝内复发转移灶主要由肝动脉供血,门静脉参与肿瘤边缘血供[6]。也有学者认为肝转移瘤完全由肝动脉供血[7-8]。本研究移植肝复发转移肿瘤(33/43例)表现为血供丰富,主要由肝动脉供血。就复发肿瘤的治疗,Roayaie等[9]报道肝内肿瘤复发患者行肝癌切除术5年的累积生存率达到47%。然而实际上更多患者同时伴肝外转移,且肝内复发肿瘤多表现为累及左、右叶的多发结节型,既失去了手术切除的机会,又不宜行消融治疗。本组病例(32/43例)同时出现了肺转移、肝门部或腹膜后淋巴结转移、腹膜或腹腔种植转移等肝外转移。因此,对血供丰富的多发转移灶,积极、系统、规范的TACE是较佳的治疗方案之一,疗效相对较好[10-11]。我院对12例肝癌移植术后肝内复发的患者行以TACE为主的治疗,患者平均生存期为17.26个月,说明了以TACE为主的介入手段可提高复发患者的生存质量,与文献观点一致[12]。

表1 43例患者移植前、后肝内肿瘤CT/MRI影像学表现

表2 移植前、后肿瘤血供情况(例数)

表3 移植前与移植后复发AFP含量情况(ng/ml)
此外,同一肝癌病人移植前、后病灶的血供及AFP浓度变化均无显著差异(P>0.05),提示复发灶与原发肿瘤的生物学特性是相似的,进一步揭示复发灶单克隆起源于原发肿瘤。原发肿瘤的癌细胞在移植术前已存在于血液中,或术中牵拉、挤压操作使癌细胞释放入血,重新定居于移植肝,这是一种比较常见的复发机制[13]。与肝癌肝切除术后复发机制之一(术前、术中癌细胞经门静脉在肝内播散)有一定相似性,均属于肝癌单中心发生。因此,移植术后尽早实施全身性辅助性化疗,可以消灭在术前或术中可能存在的微小转移灶。陈规划等[14]认为肝移植术后辅助个体化化疗能显著降低肝癌肝移植术后的肿瘤复发率,明显延长肝移植术后的无瘤生存时间。
作者认为通过对同一患者移植前、复发后肿瘤的血供对照,加上AFP的定量分析,可得出移植肝的复发主要源于原发肿瘤的血行转移。同时,CT/MRI显示移植肝内复发灶以多发结节、血供丰富为主,为患者进一步的临床治疗(TACE)提供重要的依据。
[1]俞武生,王在国,郭荣平.肝癌病人肝移植术后复发研究进展[J].世界肿瘤杂志,2007,6(4):293-296.
[2]李坚,王洪林.肝癌肝移植术后肝癌复发的研究进展[J].中华外科杂志,2005,4(11):753-756.
[3]中国抗癌协会肝癌专业委员会.原发性肝癌的临床诊断与分期标准[J].中华肝脏病杂志,2001,9(6):324.
[4]Parkin DM,Bray F,Ferlay J,et al.Estimating the world cancer burden:Globocan 2000.Int J Cancer.2001;94(2):153-156.
[5]王劲,何炳均,姜在波等.肝癌原位肝移植术后肿瘤复发的多层螺旋CT与MRI影像学诊断[J].中华肿瘤杂志,2009,31(9):691-696.
[6]Voboril R.Blood supply of metastatic liver tumors:an experimental study[J].Int Surg.2005;90(2):71-77.
[7]Kitajima K,Kuwata Y,Hayashi M,et al.Ring enhancement on T1-weighted GRE images after ferucarbotran administration for hepatic metastasis:Comparison with pathological findings:case report[J].Radiat Med.2005;23(1):75-79.
[8]Gonda T,Ishida H,Yoshinaga K,et al.Microvasculature of small liver metastases in rats[J].J Surg Res.2000;94(1):43-48.
[9]Roayaie S,Schwartz JD,Sung MW,et al.Recurrence of hepatocellular carcinoma after liver transplant:Patterns and prognosis[J].Liver Transpl.2004,10(4):534-540.
[10]李国文,梁赵玉,于小平等.肝转移瘤血供对肝动脉化疗栓塞的近期疗效影响[J].介入放射学杂志,2010,19(6):493-496.
[11]周大勇,王建华,钱晟等.肝动脉化疗栓塞术对富血供肝转移瘤的疗效分析[J].介入放射学杂志,2007,16(3):165-167.
[12]周斌,李征然,钱结胜等.原发性肝癌肝移植后肿瘤复发的化疗栓塞治疗[J].介入放射学杂志,2009,18(3):185-188.
[13]Kierile P,Weitz J,Klaes R,et a1.Detection of isolated disseminated tumor cells in bone marrow and blood salnpies of patients with hepatoeellular carcinoma.Arch Surg.2000,135(2):213-218.
[14]陈规划,陆敏强,蔡常洁等.肝癌肝移植术后个体化化疗疗效初步分析[J].中华外科杂志.2004,42(17):1040-1043.
