外源性TGF-β1对实验性自身免疫性脑脊髓炎模型小鼠中IL-23/Th17炎症轴的影响①
2010-06-21黄国祥王玉忠周文斌吴志国梁静慧中南大学湘雅医院神经内科长沙410008
黄国祥 王玉忠 周文斌 肖 波 吴志国 梁静慧 (中南大学湘雅医院神经内科,长沙 410008)
实验性自身免疫性脑脊髓炎(Experimental autoimmune encephalomyelitis,EAE)是一种主要由CD4+T细胞介导的、以中枢神经系统(Central nervous system,CNS)炎性脱髓鞘性为特征的自身免疫性疾病,因其与多发性硬化(Multiple sclerosis,MS)有着相似的临床及病理表现而成为研究MS的理想模型,其具体发病机制目前尚未明确。
Th17细胞是新近发现的辅助性CD4+T细胞,它通过分泌IL-17A(即 IL-17)、IL-17F和TNF-α等因子而发挥促炎作用。IL-17作为IL-17家族的代表性因子,已经发现在EAE中表达升高,IL-17-/-小鼠对EAE不敏感[1]。IL-23是IL-12家族新成员,由p19和p40两个亚基组成,其中p40亚基为IL-12和IL-23两者所共有。研究发现,IL-23对于维持Th17细胞的功能具有重要的作用,而IL-23参与的Th17细胞介导的炎症反应即IL-23/Th17炎症轴被认为在自身免疫性疾病的发生、发展中起了至关重要的作用[2]。
早有研究发现转化生长因子β1(Transforming growth factor beta1,TGF-β1)能减轻MS 的病情[3],但TGF-β1对MS的作用机制仍不清楚。本研究参照Mendel造模方法[4]建立慢性EAE模型并给予外源性TGF-β1,拟观察EAE小鼠病情变化和不同时期IL-23p19、IL-17和IL-6的动态表达,探讨TGF-β1在EAE中可能的作用机制,以期为MS的临床治疗提供指导。
1 材料与方法
1.1 实验动物及主要试剂 72只健康雌性C57BL/6小鼠,清洁级,8~10周,委托中南大学动物学部代为购买。MOG35-55多肽(MEVGWYRSPFSRVVHLY RNGK)由西安美联多肽合成有限公司合成(纯度>97%);百日咳毒素购自List Biological,Campbell,CA;完全弗氏佐剂购自美国Sigma公司;小鼠IL-17、IL-23、IL-6 ELISA试剂盒购自武汉博士德生物工程有限公司;小鼠 IL-17、IL-23p19、IL-6及内参GAPDH 引物由上海生工技术有限公司合成。GAPDH:Sense:5′-GCTACAGCTTCACCACA-3′,Anti-sense:5′-ACATCTGCTGGAAGGTGGAC-3′,产物大小为107 bp;IL-23p19:Sense:5′-CCAAAGGAGGTGGATAGG-3′,Anti-sense:5′-TGTCAGAGTCAAGCAGGT-3′,产物大小为 402 bp;IL-17:Sense:5′-GGCCAAGGACTTCCTCCA-3′,Anti-sense:5′-CAGCTTTCCCTCCGCATT-3′,产物大小为 211 bp;IL-6:Sense:5′-CTGATGCTGGTGACAACCAC-3′Anti-sense:5′-CAGAATTGCCATTGCACAAC-3′,产物大小为175bp。
1.2 EAE模型的建立 72只C57BL/6小鼠随机分为EAE组、佐剂组、干预组和假干预组。其中EAE组:以免疫当天为第0天,用抗原乳剂200 μ l(由100 μ g MOG35-55、100 μ l完全弗氏佐剂和 100 μ l PBS 组成)皮下注射免疫;第7天以同样剂量重复免疫。于免疫当天和48小时,每只小鼠经腹腔注射百日咳毒素200 ng。佐剂组仅注射完全弗氏佐剂,剂量同EAE组;干预组在免疫同时用TGF-β1进行干预,具体为0、3、5、6、8、9、11 天多点皮下注射,每只小鼠每次注射 1 μ g TGF-β1;假干预组,用PBS代替TGF-β1进行干预。
从初次免疫第0天起至第32天实验终止前,采用盲法,每天2人至少一次在同一时间按Benson评分标准[5],对实验小鼠进行临床评估。评分标准为:1分:尾部无力或蹒跚步态伴尾部有力;2分:蹒跚步态伴尾部无力(共济失调);2.5分:共济失调伴部分单肢麻痹;3分:单肢完全麻痹;3.5分:单肢完全麻痹伴另一肢体部分麻痹;4分:双肢完全麻痹;4.5分:四肢麻痹;5分:死亡。分别在发病初(16天)、高峰期(22天)、慢性期(32天)处死小鼠,取部分脑组织行HE和Weil氏染色观察病理改变(图1)。
1.3 逆转录聚合酶链反应 一步法提取脑组织总RNA,逆转录合成cDNA,行PCR扩增,然后进行PCR产物琼脂糖凝胶电泳,于Tanon GIS-2020电泳凝胶图像分析仪中测量各产物的光密度。PCR反应条件:94℃预变性5分钟;循环35次(95℃变性45秒,59℃退火45秒,72℃延伸1分钟),最后72℃延伸10分钟。
1.4 酶联免疫吸附法 采用双抗体夹心法ELISA试剂盒检测外周静脉血分离所得血浆中IL-17、IL-23和IL-6的水平,在规定的有效期内严格按说明书操作使用,并判定结果。
2 结果
2.1 实验动物临床评分和体重变化 EAE组在发病初期毛色发暗,活动减少,反应迟钝,食欲较差,体重明显减轻,临床评分随着时间延长加重,临床症状有多种表现,例如:尾部无力,蹒跚步态,双后肢爬行困难,不能站立,或呈偏瘫步态,在原地划圈样走动;在慢性期部分小鼠症状稍减轻,活动量较前略增加,反应仍较迟钝,体重没有进一步下降。佐剂组小鼠食欲好,形态活泼,反应灵敏,尾部有张力。干预组小鼠发病临床表现基本同EAE组,但发病时间提前,高峰期更为严重,而在慢性期更趋向于缓解;假干预组临床表现、发病时间和严重程度基本同EAE组。具体见图2、3。

图1 EAE小鼠脑中病理表现Fig.1 The representation of brain in EAE group
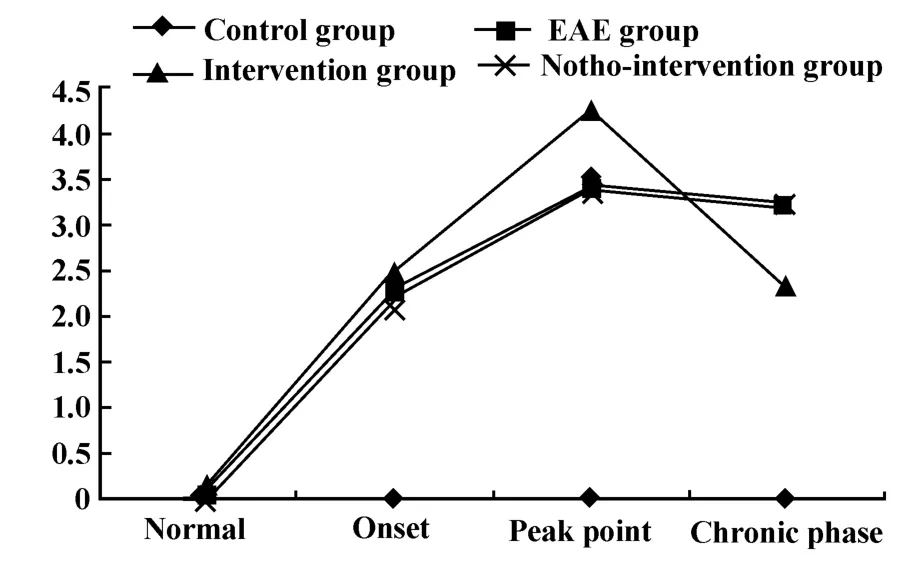
图2 实验小鼠临床评分变化Fig.2 The variance of clinical scores of experimental mice
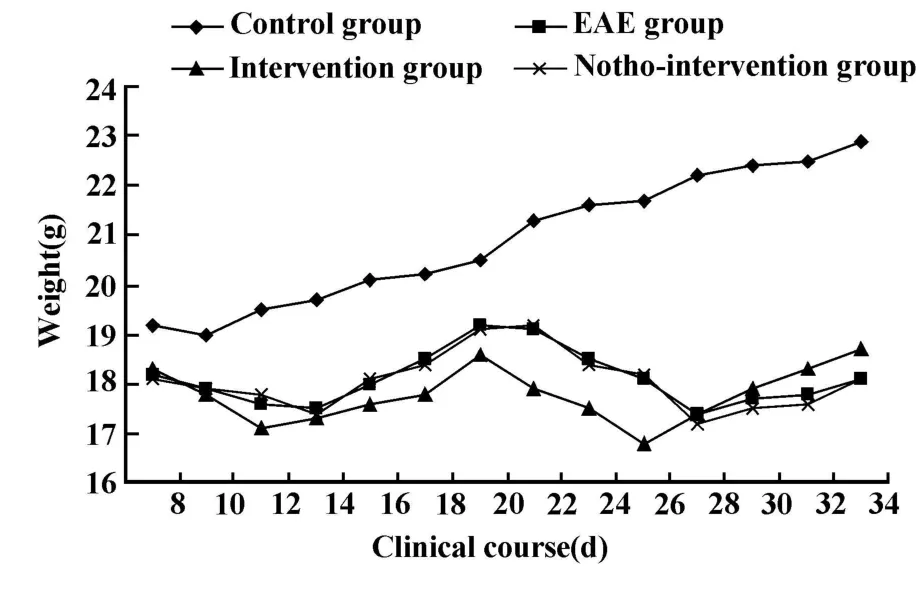
图3 实验小鼠的体重变化Fig.3 Weight variance of experimental mice

图4 实验小鼠各期脑中IL-23p19、IL-17和IL-6的mRNA表达Fig.4 The expression of IL-23p19,IL-17 and IL-6 mRNA in cerebra of experimental mice during different phase
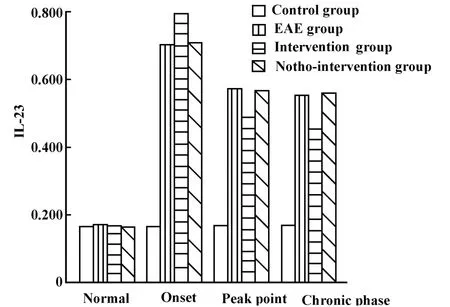
图5 实验小鼠各期外周血浆中IL-23的表达Fig.5 The expression of IL-23 in the peripheral blood plasma of experimental mice during each phase
表1 实验小鼠脑中IL-23p19 mRNA的动态表达(±s)Tab.1 The dynamic expression of IL-23p19 mRNA in cerebra of experimental mice(±s)
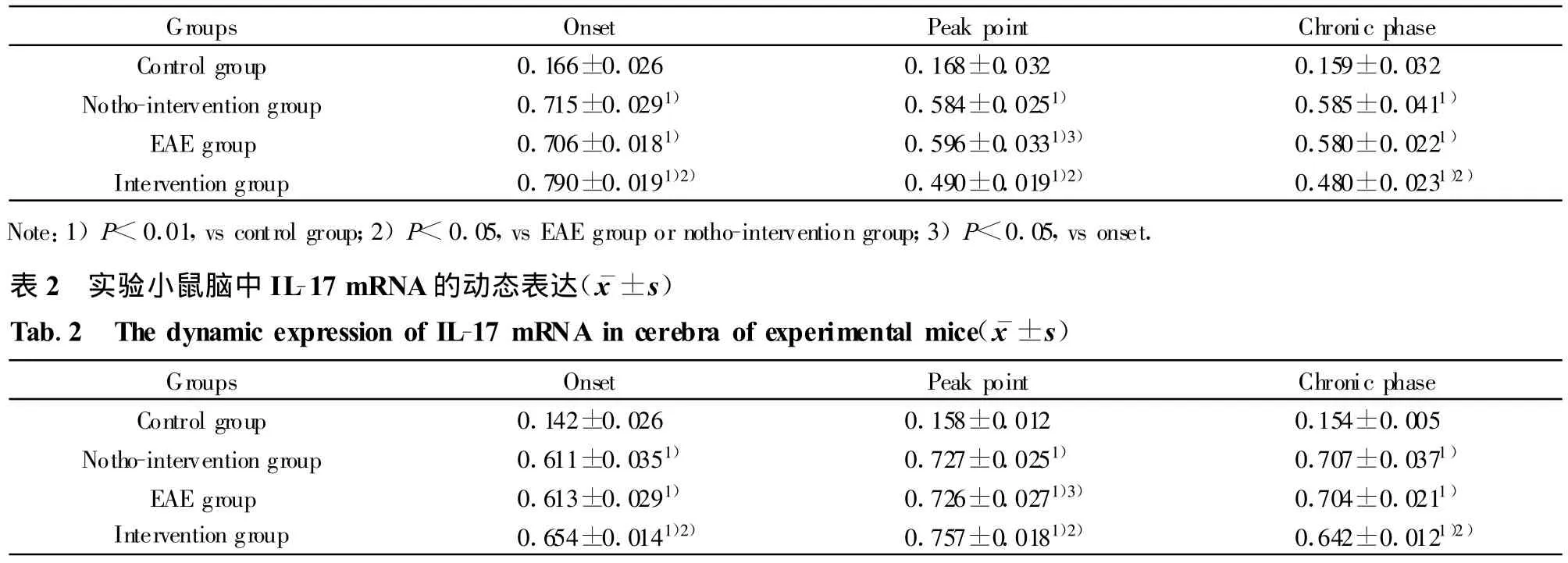
表1 实验小鼠脑中IL-23p19 mRNA的动态表达(±s)Tab.1 The dynamic expression of IL-23p19 mRNA in cerebra of experimental mice(±s)
Note:1)P<0.01,vs control group;2)P<0.05,vs EAE group or notho-intervention group;3)P<0.05,vs onset.
Groups Onset Peak point Chronic phase Control group 0.166±0.026 0.168±0.032 0.159±0.032 Notho-intervention group 0.715±0.0291) 0.584±0.0251) 0.585±0.0411)EAE group 0.706±0.0181) 0.596±0.0331)3) 0.580±0.0221)Intervention group 0.790±0.0191)2) 0.490±0.0191)2) 0.480±0.0231)2)Note:1)P<0.01,vs control group;2)P<0.05,vs EAE group or notho-intervention group;3)P<0.05,vs onset.表2 实验小鼠脑中IL-17 mRNA的动态表达(±s)Tab.2 The dynamic expression of IL-17 mRNA in cerebra of experimental mice( ±s)Groups Onset Peak point Chronic phase Control group 0.142±0.026 0.158±0.012 0.154±0.005 Notho-intervention group 0.611±0.0351) 0.727±0.0251) 0.707±0.0371)EAE group 0.613±0.0291) 0.726±0.0271)3) 0.704±0.0211)Intervention group 0.654±0.0141)2) 0.757±0.0181)2) 0.642±0.0121)2)
表3 实验小鼠脑中IL-6 mRNA的动态表达(±s)Tab.3 The dynamic expression of IL-6 mRNA in cerebra of experimental mice(±s)

表3 实验小鼠脑中IL-6 mRNA的动态表达(±s)Tab.3 The dynamic expression of IL-6 mRNA in cerebra of experimental mice(±s)
Note:1)P<0.01),vs control group;2)P<0.05,vs EAE group or notho-intervention group.
Groups Onset Peak point Chronic phase Control group 0.140±0.018 0.166±0.024 0.153±0.014 Notho-intervention group 0.720±0.0261) 0.718±0.0121) 0.724±0.0281)EAE group 0.728±0.0161) 0.721±0.0281) 0.727±0.0231)Intervention group 0.759±0.0291)2) 0.757±0.0241)2) 0.756±0.0171)2)
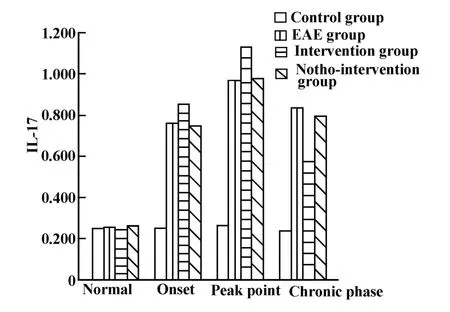
图6 实验小鼠各期外周血浆中IL-17的表达Fig.6 The expression of IL-17 in the peripheral blood plasma of experimental mice during each phase
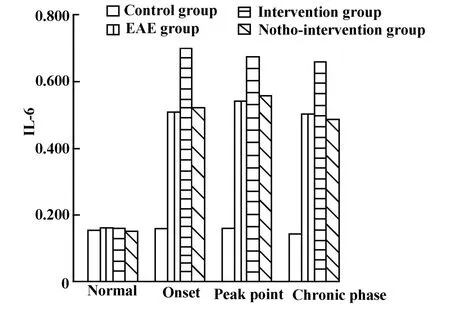
图7 实验小鼠各期外周血浆中IL-6的表达Fig.7 The expression of IL-6 in the peripheral blood plasma of experimental mice during each phase
2.2 RT-PCR结果 分别计算IL-23p19/GAPDH、IL-17/GAPDH、IL-6/GAPDH得出各指标的光密度相对值并进行比较。
IL-23p19、IL-17和IL-6在各组各期表达变化具体见表1~3和图4~7。
3 讨论
以前的研究认为IL-12在Th1细胞介导的自身免疫性疾病如多发性硬化中发挥了关键性的作用,然而新近的研究认为,IL-23可能较IL-12在EAE中发挥着更为关键的作用[6,7]。本实验中 IL-23在EAE发病初期表达即升高,这提示 IL-23可能与EAE的发病有关。Thakker等[8]从MOG免疫的小鼠中提取出致病性的T细胞,注入野生型和 IL-23p19-/-小鼠,两组均能产生EAE。这提示致病性T细胞一旦成熟产生,就很少依赖IL-23,即IL-23更可能在疾病的早期发挥作用,而本实验中IL-23在高峰期和慢性期表达下降,这也证明IL-23主要在模型的诱导初期发挥作用。
IL-17作为Th17细胞分泌的关键性因子之一,已被发现在多种自身免疫性疾病中表达升高。IL-6来源多样,可以由树突状细胞、巨噬细胞、星形胶质细胞分泌;其作用复杂,可在多种途径多个水平对其他细胞和细胞因子产生影响。本实验中,IL-17表达在发病初期表达升高,并在高峰期进一步升高,慢性期略有下降,而IL-6在整个病程均呈高表达,这说明IL-17和IL-6与EAE的发病密切相关。Veldhoen等[9]发现由分枝杆菌诱导的Th17细胞分化必须依赖TGF-β1和 IL-6存在。Ogura等[10]认为在EAE中IL-17可以通过正反馈回路诱导IL-6的产生从而增强自身免疫。Serada等[11]发现IL-6的缺陷可以抑制EAE中抗原特异性Th17细胞的产生以及Th1型细胞免疫,使用IL-6抗体可以抑制EAE的发病。我们认为在EAE的发病中,IL-6联合TGF-β1可以诱导致病性Th17细胞的分化,后者分泌大量的IL-17并进一步诱导IL-6的分泌,后者通过级联反应导致中枢神经系统髓鞘的破坏。然而本实验发现IL-6在EAE各期均呈高表达,且在慢性期IL-17表达降低时其表达依然增高,我们认为在发病初期和高峰期,IL-6的高表达与IL-17的正反馈有关[10],而在慢性期IL-6依然呈高表达可能与慢性期炎症反应的维持有关,这可能存在其他的调节机制,有待进一步的研究。
TGF-β1属于生长因子超家族,它具有多重调节功能。在TGF-β1干预组中,与EAE组相比,IL-23在发病初期表达更高,而在高峰期和慢性期表达更低;经TGF-β1干预后,EAE小鼠发病提前,这也支持IL-23可能主要在EAE模型诱导初期发挥作用的结论。在干预组中,IL-17在发病初期、在高峰期的表达较EAE组更高,而在慢性期表达下降;IL-6在整个病程均呈高表达。在临床症状上,经TGF-β1干预后的EAE小鼠高峰期症状更重,而在慢性期更趋向于缓解,这说明IL-17的表达与EAE疾病的严重程度呈正相关。研究发现,TGF-β1的免疫调节功能呈现剂量依赖性,低浓度时表现为协同IL-6诱导Th17细胞的分化,而在高浓度时则诱导CD4+CD25+调节性T细胞的分化,其中前者可以诱导EAE的发生而后者介导免疫抑制[12]。本实验中,我们对干预组采用多个时间点重复注射TGF-β1,我们认为在干预之初,在低剂量的条件下,TGF-β1的功能主要表现为协同IL-6诱导Th17的分化,后者分泌IL-17并进一步诱导IL-6的高表达;随着注射剂量累积的增多,TGF-β1的功能又表现为诱导Treg细胞的分化,这与干预组小鼠的临床表现是相符合的。研究发现,IL-23对于Th17细胞的存活、增殖以及IL-17的分泌至关重要[13]。这与本实验干预组中发病初IL-23的表达上调以及干预组小鼠发病提前、高峰期症状更重是相符合的。然而TGF-β1如何影响IL-23的表达,其机制尚不清楚。
总之,本研究验证了IL-23/Th17细胞炎症轴在EAE发病中的重要性;IL-23在早期的免疫启动中可能发挥着关键性的作用;外源性的TGF-β1通过上调IL-17的表达使得EAE的发病提前,高峰期症状更重;同时经干预后,EAE在慢性期更趋向于缓解。我们期望本文能为MS的临床治疗提供指导,然而EAE/MS的发病是多种免疫因子共同作用的结果,TGF-β1能否用于MS临床治疗,仍需进一步的研究。
1 Komiyama Y,Nakae S,Matsuki T et al.IL-17 plays an important role in the development of experimental autoimmune encephalomyelitis[J].J Immunol,2006;177(1):566-573.
2 Kikly K,Liu L,Na S et al.The IL-23/Th(17)axis:therapeutic targetsfor autoimmune inflammation[J].Curr Opin Immunol,2006;18(6):670-675.
3 Mangan P R,Harrington L E,O'Quinn D B et al.Transforming growth factor-beta induces development of the T(H)17 lineage[J].Nature,2006;441(7090):231-234.
4 Mendel I,Kerlero de Rosbo N,Ben-Nun A.A myelin oligodendrocyte glycoprotein peptide induces typical chronic experimental autoimmune encephalomyelitis in H-2b mice:fine specificity and T cell receptor V beta expression of encephalitogenic T cells[J].Eur J Immunol,1995;25(7):1951-1959.
5 Benson J M,Stuckman S S,Cox K L et al.Oral administration of myelin basic protein is superior to myelin in suppressing established relapsing experimental autoimmune encephalomyelitis[J].J Immunol,1999;162(10):6247-6254.
6 Cua D J,Sherlock J,Chen Y et al.Interleukin-23 rather than interleukin-12 is the critical cytokine for autoimmune inflammation of the brain[J].Nature,2003;421:744-748.
7 Hunter C A.New IL-12-family members:IL-23 and IL-27,cytokines with divergent functions[J].Nat Rev Immunol,2005;5(7):521-531.
8 Thakker P,Leach M W,Kuang W et al.IL-23 is critical in the induction but not in the effector phase of experimental autoimmune encephalomyelitis[J].J Immunol,2007;178(4):2589-2598.
9 Veldhoen M,Hocking R J,Flavell R A et al.Signals mediated by transforming growth factor-β initiate autoimmune encephalomyelitis,but chronic inflammation is needed to sustain disease[J].Nat Immunol,2006;7(11):1151-1156.
10 Ogura H,Murakami M,Okuyama Y et al.Interleukin-17 promotes autoimmunity by triggering a positive-feedback loop via interleukin-6 induction[J].Immunity,2008;29(4):628-636.
11 Serada S,Fujimoto M,Mihara M et al.IL-6 blockade inhibits the induction of myelin antigen-specific Th17 cells and Th1 cells in experimental autoimmune encephalomyelitis[J].Proc Natl Acad Sci USA,2008;105(26):9041-9046.
12 Zhou L,Lopes J,Chong M et al.TGF-β-inducedFoxp3 inhibitsTh17 cell differentiation by antagonizing ROR γ t function[J].Nature,2008;453(7192):236-240.
13 Veldhoen M,Hocking R J,Atkins C J et al.TGF beta in the context of an inflammatory cytokine milieu supports de novo differentiation of IL-17-producing T cells[J].Immunity,2006;24(2):179-189.