APRIL在非小细胞肺癌中的表达研究①
2010-06-21孙宝兰倪红兵王惠民南通大学附属医院医学检验中心南通226001
孙宝兰 朱 俐 王 行 倪红兵 王惠民 (南通大学附属医院医学检验中心,南通 226001)
肺癌高发病率、高死亡率,是严重威胁人类健康和生命的恶性肿瘤之一[1],其中非小细胞肺癌(Nonsmall cell lung cancer,NSCLC)占全部肺癌的75%左右[2],在包括肺癌在内的各种肿瘤的发生发展过程中,相对于基因突变而言基因表达异常更为普遍,研究在NSCLC中异常表达的肿瘤相关基因,评价其在肺癌发生发展中的作用是有效预防和诊断NSCLC的前提。
增殖诱导配体(A proliferation-inducing ligand,APRIL)属于肿瘤坏死因子超家族,大量研究表明,APRIL与肿瘤生长调节关系密切,在体内、外均能刺激肿瘤细胞生长,在多种肿瘤细胞株和肿瘤组织如结肠癌、腮腺癌及淋巴组织中都有高表达[3,4]。本文拟采用RTQ-PCR(Real-time fluorescence quantitative polymerase chain reaction,RTQ-PCR)、 Western blot和免疫组化技术(IHC)检测APRIL在NSCLC组织中的表达情况,探讨APRIL在肺癌发生发展中的作用。
1 材料与方法
1.1 临床资料 NSCLC新鲜组织标本取自2006年8月至2008年5月南通大学附属医院胸外科NSCLC手术病例68例,均经病理学检查确诊,所有患者术前未行化疗及放疗,其中男44例,女24例,年龄35~72岁,平均62.6岁。按WHO“肺肿瘤组织学分型”(2000)标准分类,组织病理分型为鳞癌36例,腺癌32例。全部标本于手术时收集,分装后立即放入-70℃低温冰箱冻存。肺癌组织取自原发癌灶,远端正常肺组织取自距癌灶边缘7厘米以上的部位,并经病理学检查未见癌细胞。
NSCLC石蜡标本取自南通大学附属医院病理科2007年1月至2008年3月间的NSCLC 50例,入选标准:(1)术前未行放疗、化疗、免疫治疗等抗肿瘤治疗;(2)石蜡标本完好,临床原始资料完整。其中男性31例,女性19例,平均年龄61.5岁。每例均重新复习阅片。组织病理分型为鳞癌26例,腺癌24例。高分化 6例,中分化26例,低分化18例。TNM分期:Ⅰ期19例,Ⅱ期24例,Ⅲ期5例,Ⅳ期2例。伴肺门和/或纵隔淋巴结转移者33例。同时取远端正常组织10例作为对照。所有标本均经10%福尔马林固定,常规脱水后石蜡包埋,病理诊断无异议。
1.2 实验方法
1.2.1 实时荧光定量PCR(RTQ-PCR)检测APRIL mRNA表达 根据APRIL注册号(AF046888)和内参β2微球蛋白(β2microgluobulin,β2M)(注册号 NM 004048),采用Primer Premier 5.0设计相应引物,引物序列如下:APRIL上游引物:5′-ACT CTC AGT TGC CCT CTG GTT G-3′(819 nt~840 nt),APRIL 下游引物 :5′-GGA ACT CTG CTC CGGGAGACT C-3′(984nt~1005 nt),扩增 片段长度 187 bp;β2M 上 游引物:5′-CTA TCC AGC GTA CTC CAA-3′(119 nt~ 136 nt),β2M下游引物:5′-GCA GGC ATA CTC ATC TTT T-3′(342 nt~360 nt),扩增片段长度242 bp,均由上海生物工程公司合成。取100 mg组织加1 ml Trizol(Invitrogen),按说明书操作提取细胞总RNA,核酸蛋白分析仪(HITACHI公司)检测RNA质量和浓度;取总RNA 3.0 μ g,以Oligo(DT)18为引物,按试剂盒说明书逆转录为 cDNA,分装后-20℃保存。将 2 μ l cDNA模板加入18 μ l PCR反应液(含 1×PCR buffer,4.0 mmol/L MgCl2,0.2 mmol/L dNTPs,APRIL或 β2M 上 、下游引物各0.15 μ mol/L,20×SYBR GreenⅠ0.3 μ l,Taq DNA聚合酶1.5 U。混匀后加入Roche专用毛细管中,并设空白对照、以空载质粒作模板的阴性对照和相应的6个质粒标准品(浓度分别为106、105、104、103、102、10 copies/μ l)。各反应管于 Roche 荧光定量检测仪(Lightcycler)进行PCR扩增:94℃预变性3分钟;94℃5秒,62℃35秒,共40个循环。根据各自标准品建立的标准曲线,由软件自动计算待测样本中APRIL或β2M准确含量,以所测APRIL mRNA和β2M mRNA含量的比值作为评价APRIL表达水平的指标。
1.2.2 Western blot检测APRIL蛋白表达 称取约100 mg组织标本,用剪刀剪碎,加入1 ml含PMSF的裂解液(碧云天)混匀,于冰浴中用匀浆器充分匀浆,低温(4℃)12 000 r/min离心15分钟。吸取上清液与5×样品缓冲液混合,100℃变性,离心,加入样品孔中,蛋白上样量为50 μ g。电泳(80 V,20分钟;100 V,90分钟),凝胶(300 mA,130分钟)转移至聚偏二氟乙烯(PVDF)膜。PVDF膜用1×TBS-T配制的5%的脱脂奶粉封闭,37℃震荡1小时,洗膜5 min×3次,加入1∶1 000浓缩型兔抗人APRIL多克隆抗体(美国,芝加哥),4℃过夜,洗膜5分钟×3次,加入二抗(1∶2 500)37℃孵育1小时,洗膜5分钟×3次,ECL试剂显影。以β-actin作为内参。
1.2.3 免疫组织化学法进一步研究APRIL蛋白表达和定位 浓缩型兔抗人APRIL多克隆抗体(美国 ,芝加哥),使用浓度 2 μ g/ml。即用型SP 法免疫组化检测试剂盒(美国GBI公司),DAB显色试剂盒(北京中山生物有限公司)。将入选的所有组织蜡块每一个均连续切片2~3张、切片厚度5 μ m,其中 1张行HE染色,其余采用链霉素抗生素蛋白-过氧化酶连接(SP)免疫组化方法检测,用PBS代替一抗作阴性对照,检测程序严格按产品说明书进行。光学显微镜下以细胞浆和/或细胞膜被染成淡黄至棕黄色者为阳性细胞,评分根据Allred计分标准[5],按照染色的阳性细胞数和染色强度评分。阳性细胞数分为6个级别:0.无细胞染色;1.<1%的细胞染色;2.1%~10%的细胞染色;3.11%~33%的细胞染色;4.34%~66%的细胞染色;5.>67%的细胞染色。细胞染色强度分为4个级别:0.阴性(无染色);1.弱阳性(淡黄色);2.阳性(黄色);3.强阳性(棕黄色)。随机选择有代表性的10个高倍镜视野,每个视野记数100个肿瘤细胞,以二者之和得分将APRIL免疫反应性分为3个级别:APRIL阴性(0分),APRIL阳性(1~6分),APRIL强阳性(7~8分)。
1.3 统计学处理 应用SPSS11.5统计软件,对计量资料采用t检验,并分别计算均数、标准差和变异系数,所得结果表示为±s;对计数资料采用Pear-son χ2相关分析,P<0.05有统计学意义。
2 结果
2.1 实时荧光定量PCR(RTQ-PCR)检测APRIL mRNA表达结果 68例NSCLC癌组织和远端正常组织APRIL mRNA含量分别为0.72±0.06和 0.10±0.04(±s),统计学分析 P <0.05。其中36例鳞癌癌组织和其远端正常组织APRIL mRNA分别为0.74±0.06和0.10±0.03;32例腺癌癌组织和其远端正常组织APRIL mRNA分别为0.70±0.05和0.11±0.04,统计学分析均P<0.05。鳞癌与腺癌癌组织APRIL mRNA水平统计学分析无显著性差异(0.74±0.06 vs.0.70±0.05,P >0.05)(表1,图1)。
2.2 Western blot检测APRIL蛋白表达结果 在68对NSCLC癌组织及配对远端正常组织标本中随机选取25对标本进行检测,结果显示APRIL蛋白在癌组织标本中有阳性条带,而在远端正常组织无阳性条带出现(图2A)。灰度扫描结果显示APRIL蛋白在NSCLC癌组织表达为0.94±0.12(±s),远端正常组织为0.00,统计学分析癌组织和远端正常组织APRIL蛋白表达差异明显(P<0.001)(图2B)。
2.3 免疫组织化学检测APRIL蛋白结果
2.3.1 APRIL蛋白在NSCLC中的定位和表达
APRIL阳性反应物质呈棕黄色且多位于阳性细胞胞浆/膜上,在50例NSCLC手术标本切片中,APRIL蛋白在46例肺癌组织中呈阳性表达(46/50,92%)(图3A、B),其中,16例(16/50,32%)APRIL强阳性,30例(30/50,60%)APRIL阳性,4例(4/50,8%)阴性表达;10例远端正常组织中1例(1/10,10%)APRIL表达阳性,9例(9/10,90%)APRIL阴性(图3C),与癌组织相比,统计学分析P<0.001。
2.3.2 APRIL蛋白表达与NSCLC临床病理关系
APRIL蛋白表达分别与患者临床病理资料:性别、年龄、淋巴结转移、组织学分型、肿瘤病理分级、TNM分期等进行分析。结果表明,APRIL蛋白表达与淋巴结转移(P=0.014)、肿瘤病理分级(P=0.000)和TNM分期(P=0.006)明显相关,与性别、年龄、组织学分型无关(P均>0.05)。见表2。

表1 非小细胞肺癌中APRIL mRNA表达Tab.1 The expression levels of APRIL mRNA in NSCLC

图1 非小细胞肺癌中APRIL mRNA表达Fig.1 APRIL mRNA expression in NSCLC
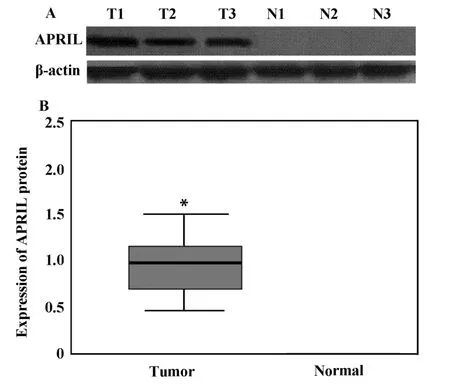
图2 非小细胞肺癌中APRIL蛋白表达Fig.2 Expression of APRIL protein in NSCLC
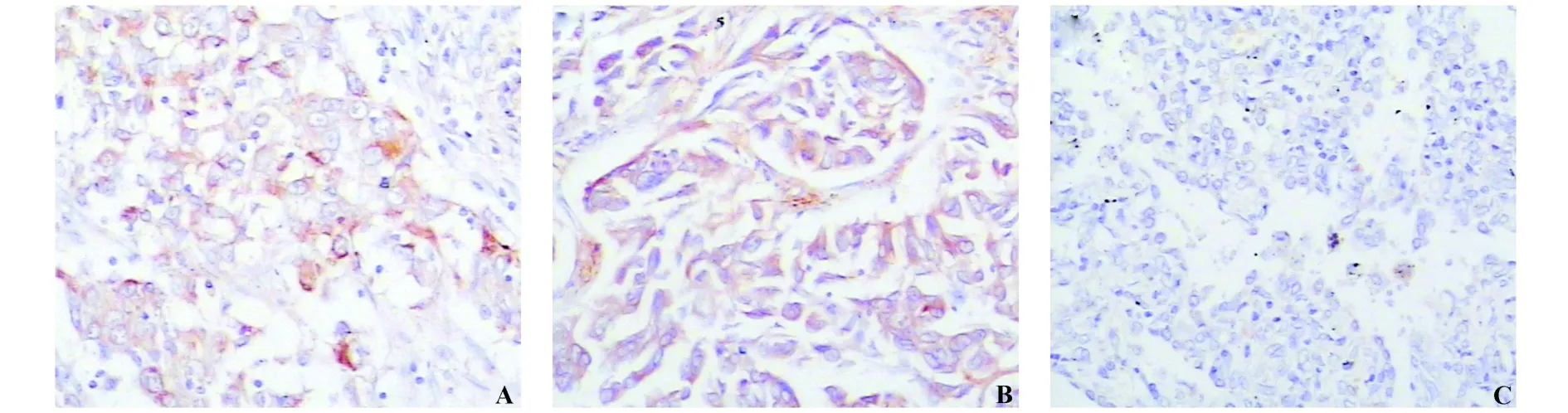
图3 非小细胞肺癌组织中APRIL蛋白定位和表达(SP×200)Fig.3 APRIL protein location and expression in NSCLCby immunohistochemistry analysis(SP×200)Note:A.Squamous cell carcinoma;B.Adeocarcinoma;C.Normal tissue.
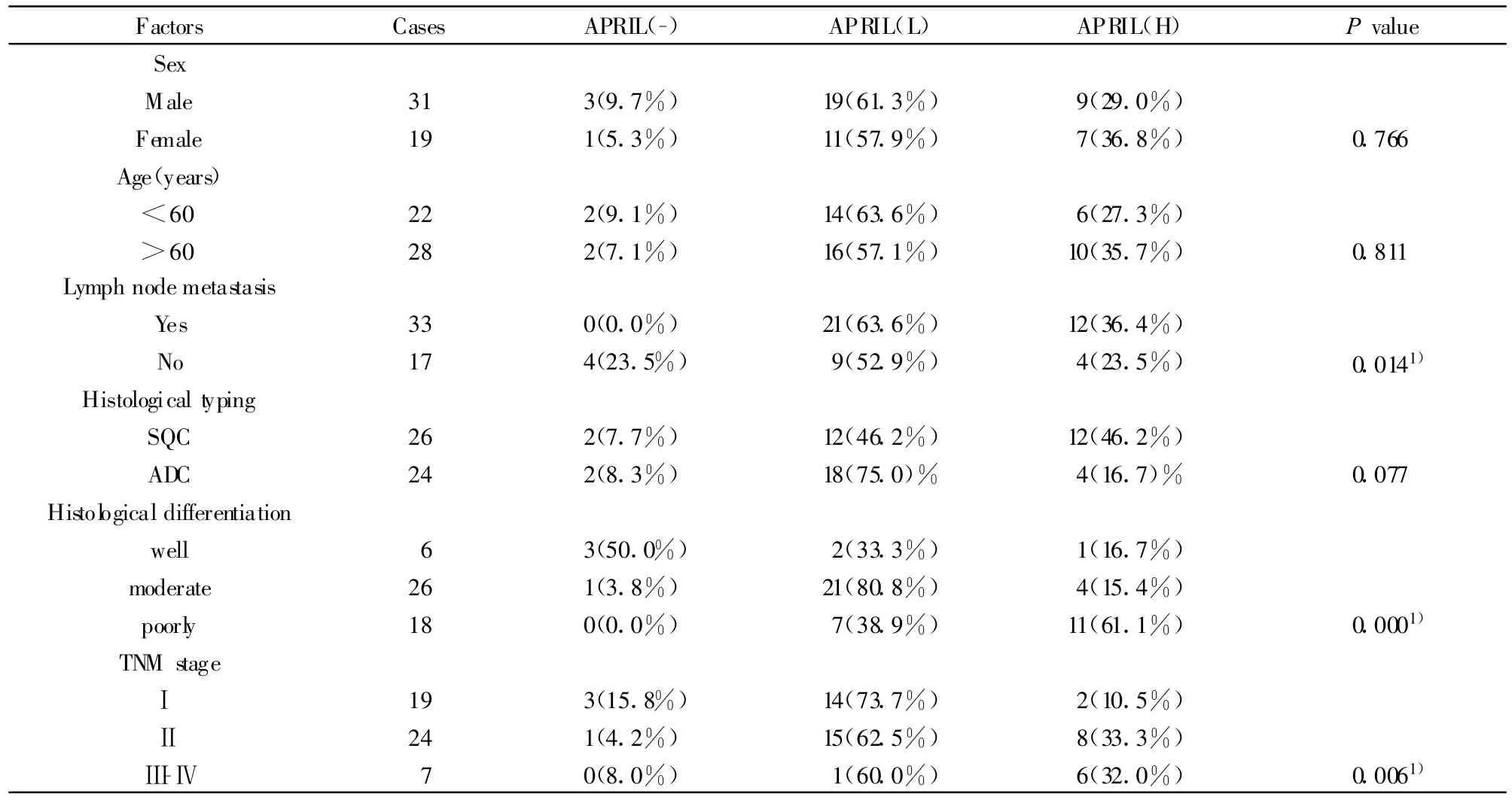
表2 APRIL蛋白表达与NSCLC临床病理特征的关系Tab.2 Correlation of APRIL expression in NSCLC to the clinical and pathological parameters
3 讨论
肿瘤坏死因子(Tumor necrosis factor,TNF)超家族可诱导多种生物学效应,如细胞的增殖、分化和凋亡等,在机体的防御、炎症反应及免疫调节等过程中起重要作用[6]。增殖诱导配体(A proliferation-inducing ligand,APRIL)是TNF超家族的一员[3],它有多种生物学作用,如刺激肿瘤细胞的生长[3,7],调节肿瘤细胞凋亡[8],活化核因子NF-kB等[9],并且和体液免疫的调节也密切相关[7,10]。
本研究中,我们首先采用荧光定量PCR技术分析了APRIL mRNA在NSCLC癌组织及其远端正常组织中的表达水平,发现NSCLC癌组织中APRIL的水平显著高于远端正常组织(P<0.05), Western blot和免疫组化技术研究APRIL的蛋白表达得到类似的结果: Western blot显示APRIL在NSCLC的癌组织表达显著高于远端正常组织(P<0.001),免疫组化结果表明APRIL在NSCLC恶性肿瘤组织中的阳性表达率(92%)显著高于癌旁正常组织(10%)。这些结果都提示APRIL在NSCLC患者的癌组织中高水平表达,与施健等[11]报道APRIL mRNA在肺癌组织中高表达结果相一致。在 Western blot分析时我们发现,在远端正常组中未检测到APRIL蛋白表达,而同一正常组织标本用RTQ-PCR技术却能检测出APRIL mRNA有低水平表达,究其原因可能与RTQPCR检测mRNA有更高的灵敏度有关。
与TNF家族内的其他成员不同,APRIL蛋白首先在高尔基体内加工修饰,经furin蛋白酶切割裂解后,部分可与 TWEAK结合形成APRIL的跨膜形式[12],这一理论成果我们在免疫组化结果中所观察到的APRIL蛋白主要分布于阳性细胞胞浆/胞膜上得到证实。在分析APRIL蛋白表达与患者临床病理资料的关系中,我们发现APRIL表达与肺肿瘤的淋巴结转移和严重程度呈正相关,TNM分期中APRIL阳性程度虽在Ⅰ、Ⅱ期表达无差异,但都显著低于Ⅲ-Ⅳ期;本课题组用RNA干扰技术敲低APRIL在结肠癌细胞株SW480中的表达时也发现APRIL与肿瘤的转移和侵袭有关[13];同时Okano等[14]在研究APRIL对人肝细胞癌的作用时也发现APRIL能促进肝细胞增殖与侵袭,这些结果均说明APRIL在肿瘤的发生发展中发挥着重要作用。APRIL在肿瘤中的作用主要通过与其靶细胞表面的两个受体——穿膜蛋白活化物(TACI)和B细胞成熟抗原(BCMA)结合发挥活性[7],但有研究发现APRIL在肺癌组织中可能是与其第三个特异性受体——硫酸乙酰肝素蛋白聚糖(heparansulfate proteoglycans,HSPG)结合启动下游信号传导通路促进肿瘤细胞的生长分化[15],至于在非小细胞肺癌中具体是哪一种信号传导通路发挥作用,本研究将在下一步的工作中进行。
综上所述,APRIL在NSCLC中高表达,而且与NSCLC分化转移有着密切关系,提示APRIL可能参与肿瘤发生、演进的过程,但是否可以作为NSCLC的一种预后因子,尚需进一步深入研究。
1 Arkin D M,Bray F,Ferlay J et al.Global cancer statistics,2002[J].CA Cancer J Clin,2005;55(2):74-108.
2 Seve P,Dumontet C.Chemoresistance in non-small cell lung cancer[J].CurrMed Chem Anticancer Agents,2005;5(1):73-88.
3 Hahne M,Kataoka T,Schroter M et al.APRIL,a new ligand of the tumor necrosis factor family,stimulates tumor cell growth[J].J Exp Med,1998;188(6):1185-1190.
4 Rennert P,SchneiderP,Cachero T et al.A soluble form of B cell maturation antigen,a receptor for the tumor necrosis factor family member APRIL,inhibits tumor cell growth[J].J Exp Med,2000;192(11):1677-1684.
5 Allred D C,Harvey J M,Berardo M et al.Prognostic and predictive factors in breast cancer by immunohistochemical analysis[J].Mod Pathol,1998;11(2):155-168.
6 Smith C A,Farrah T,Goodwin R G.The receptor superfamily of cellular and viral proteins:activation,costimulation,and death[J].Cell,1994;76(6):959-962.
7 Yu G,Boone T,Delaney J et al.APRIL and TALL-1 and receptors BCMA and TACI:system for regulating humoral immunity[J].Nature Immunol,2000;1(3):253-256.
8 Novak A J,Bram R J,Kay N E et al.Aberrant expression of B-lymphocyte stumulator by B chronic lymphocytic leukemia cells:a mechanism for survival[J].Blood,2002;100(8):2973-2979.
9 Litinskiy M B,Nardelli B,Hilbert D M et al.DCs induce CD40-independent immunoglobulin class switching through BLyS and APRIL[J].Nat Immunol,2002;3(9):822-829.
10 Stein J V,Lopez-Fraga M,Elustondo F A et al.APRIL modulates B and T cell immunity[J].J Clin Invest,2002;109(9):1587-1598.
11 施 健,张冬雷,崔之础 et al.增殖诱导配体及其受体在肿瘤组织中的表达与意义[J].检验医学,2007;22(2):150-154.
12 Kolfschoten G,Balade B,Hahne M et al.TWE-PRIL:a fusion protein of TWEAK and APRIL[J].Biochemical Pharmacology,2003;66(8):1427-1432.
13 Ding W,Wang J,Sun B et al.APRIL knockdown suppresses migration and invasion of human colon carcinoma cells[J].Clin Biochem,2009;42(16-17):1694-1698.
14 Okano H,Shiraki K,Yamanaka Y et al.Functional expression of a proliferation-ralated implications for neovascularization[J].World J.Gastroenterol,2005;11(30):4650-4654.
15 Day E S,Cachero T G,Qian F et al.Selectivity of BAFF/BLyS and APRIL for binding to the TNF family receptors BAFF/BR3 and BCMA[J].Biochemistry,2005;44(6):1919-1931.