人CXCR3基因转染细胞株的构建、鉴定及初步功能研究①
2010-06-21刘玉华陈永井郭静雅陈昌友胡玲玲陈明心杜阳阳徐耀瑜邱玉华
孙 杰 刘玉华 陈永井 郭静雅 陈昌友 胡玲玲 陈明心 杜阳阳 徐耀瑜 邱玉华
(苏州大学医学部免疫学系,苏州 215123)
CXCR3(CD183)-CXC Chemokine Receptor 3是一种七次跨膜的G-蛋白偶联受体,基因定位于X染色体q13区,编码区长度为1 104 bp,由368个氨基酸组成,分子量为40.659 kD[1,2]。目前已发现三种可变异构体 CXCR3-A、CXCR3-B、CXCR3-alt,通常所说的CXCR3是指CXCR3-A;有三种配体Mig、IP-10及I-TAC可与之结合[3]。在正常生理状态下,CXCR3主要表达于活化/记忆T细胞、NK细胞、巨噬细胞等。在一些疾病病理性进程中如自身免疫性疾病、移植排异、感染等病人外周血淋巴细胞表面呈高表达,在某些恶性肿瘤细胞表面也呈高表达[4-8]。研究表明,CXCR3介导的信号在指导白细胞定向迁移的同时,在肿瘤转移、自身免疫性疾病和移植排异等疾病的发生、发展和预后过程中发挥重要作用。通过免疫干预手段阻断CXCR3信号转导对上述疾病具有积极的治疗作用[9]。本研究旨在构建稳定表达人CXCR3分子的基因转染细胞株L929-CXCR3及在配体作用下的迁移效应,为进一步研制CXCR3单克隆抗体及功能研究奠定了物质基础。
1 材料与方法
1.1 材料 LipofectamineTM2000、Zeocin和Top10大肠杆菌购自Invitrogen公司;各种限制性内切酶、T4 DNA连接酶、克隆载体pMD19-T及逆转录试剂盒购自Takara公司;琼脂糖粉购自上海华美公司;小量质粒抽提试剂盒、胶回收试剂盒购自上海华舜公司;胎牛血清(FCS)购自Hyclone公司;TRIzol和RPMI1640培养基购自GIBCO公司;PE标记的鼠抗人CXCR3 mAb购自BD公司;24孔Transwell板购自Millipore公司。Mig、IP-10及 I-TAC购自 Peprotech公司;293T、L929细胞购自ATCC,由本室保存;逆转录病毒载体pEGZ-term及两个辅助病毒载体pHIT456和pHIT60由德国Sefling教授惠赠。
1.2 方法
1.2.1 人CXCR3基因的克隆与鉴定 根据GeneBank收录的人CXCR3基因序列(NM-001504)设计PCR引物,由南京金斯特生物技术有限公司合成。PCR引物为 P1:5′-ATGGTCCTTGAGGTGAGTGACCACC-3′,P2:5′-CTCTGAGGTCTCAGACCAGGATGA-3′。取正常志愿者抗凝外周血100 ml,经Ficoll密度梯度离心分离获得PBMC,用 50 μ g/ml PHA 的RPMI1640培养基培养3天,再加入400 U/ml的 IL-3诱导3天,收集细胞;TRIzol一步法抽提总RNA,将mRNA逆转录成cDNA(按TaKaRa逆转录试剂盒说明书操作),取5 μ l cDNA作为模板,进行PCR扩增。PCR反应条件为:94℃预变性40秒,94℃变性 40秒,60℃退火40秒,72℃延伸80秒,35个循环,72℃延伸10分钟。PCR扩增产物经1%琼脂糖凝胶电泳鉴定,割胶回收目的片段,用试剂盒纯化后与pMD19-T载体连接16℃30分钟(按试剂盒说明书操作),CaCl2法转化感受态大肠杆菌Top10,筛选氨苄青霉素抗性克隆,重组质粒pMD19-T/CXCR3经煮菌PCR、酶切鉴定后,送南京金斯特生物技术有限公司测序验证。
1.2.2 重组逆转录病毒载体的构建 PCR引物为P3:5′-CAGGAATTCACCATGGTCCTTGAGGTGAGTGAC-3′,引入 EcoR Ⅰ 酶切位点 ;P4:5′-ACCGGATCCTCACAAGCCCGAGTAGGAGGCCTCTGAGGTCTCAGACCAG GA-3′,引入 BamHⅠ酶切位点。以测序正确的pMD19-T/CXCR3重组质粒为模板,P3、P4为引物,扩增出含EcoRⅠ和BamHⅠ酶切位点的CXCR3编码区基因片段,PCR扩增产物和pEGZ-term载体同时用EcoRⅠ和BamHⅠ进行双酶切,30℃4小时。回收目的片段,T4 DNA连接酶16℃4小时,连接产物pEGZ-term/CXCR3转化感受态大肠杆菌Top10。氨苄青霉素抗性克隆经煮菌PCR、酶切鉴定和测序验证后,以确定获得含有正确序列的人CXCR3基因的重组逆转录病毒载体pEGZ-term/CXCR3。
1.2.3 稳定表达人CXCR3分子的基因转染细胞株L929-CXCR3的构建 将重组逆转录病毒载体pEGZ-term/CXCR3与两个辅助病毒载体pHIT456和pHIT60按2∶1∶1混合后,用脂质体法共转染包装细胞293T(按试剂盒说明书操作)。48小时后收集含完整逆转录病毒颗粒的293T培养上清,感染6孔板中60%~70%汇片的L929细胞,同时加入polybrene使其终浓度为8 ng/ml,37℃感染6小时,添加含10%FCS的RPMI1640培养基至2 ml/孔,每隔24小时感染一次,重复感染3次。收集L929细胞,按1∶6稀释后,将其置于含500 μ g/ml Zeocin的选择培养基中,筛选培养两周,挑取单克隆集落,进行扩大培养。同时制备转染空载体的阴性对照细胞株L929-mock。
1.2.4 FCM分析L929-CXCR3细胞中GFP和膜表面目的分子的表达 收集Zeocin抗性生长的L929-CXCR3细胞,经FCM分析绿色荧光蛋白(GFP)报告基因的表达。同时将PE标记的鼠抗人CXCR3单克隆抗体与L929-CXCR3基因转染细胞4℃反应30分钟,用含2%FCS的PBS洗2遍,用FCM检测人CXCR3分子在细胞膜上的表达。分别以小鼠IgG及L929-mock作为抗体的同型对照及细胞的阴性对照。
1.2.5 RT-PCR检测L929-CXCR3细胞中人CXCR3基因的转录 收集L929-CXCR3细胞,TRIzol抽提其总 RNA,逆转录成cDNA,取 5 μ l cDNA 作为模板 ,用前述CXCR3特异性引物P3、P4,扩增人CXCR3目的基因,同时用L929-mock细胞作对照。
1.2.6 L929-CXCR3在其配体作用下迁移能力的分析 在8 μ m的 transwell板上室中加入L929-CXCR3细胞1×105个(400 μ l),下室中分别加入 Mig、IP-10及 I-TAC,浓度梯度依次为,Mig:5、10、20、50、80、100 ng/ml;IP-10:0.5 、2 、5 、10 、20 、50 ng/ml及 I-TAC:1 、2 、5、10、20、50 ng/ml各 600 μ l;用 L929-mock 作为细胞对照,培养基作为趋化因子的阴性对照,每组设三个复孔。于37℃、5%CO2培养箱中孵育5小时,用FCM对下室中的细胞计数。(迁移率)%=(下室中的细胞数/上室中接种的细胞总数)×100%。
1.3 统计学分析 利用SPSS17.0统计软件,采用t检验进行统计学分析,结果以±s表示。
2 结果
2.1 人CXCR3编码区全长基因的克隆 从活化的人PBMC的mRNA中,用RT-PCR方法扩增出了人CXCR3基因,长约1 100 bp。测序结果与GeneBank中注册的序列相同(图1)。
2.2 重组逆转录病毒载体的构建 重组逆转录病毒经PCR和双酶切,1%琼脂糖凝胶电泳分析,目的片段与人CXCR3基因大小基本一致。DNA测序结果表明,所获得的序列与GeneBank中注册的序列相同,由此表明已成功构建了人CXCR3基因重组逆转录病毒表达载体pEGZ-term/CXCR3(图2)。
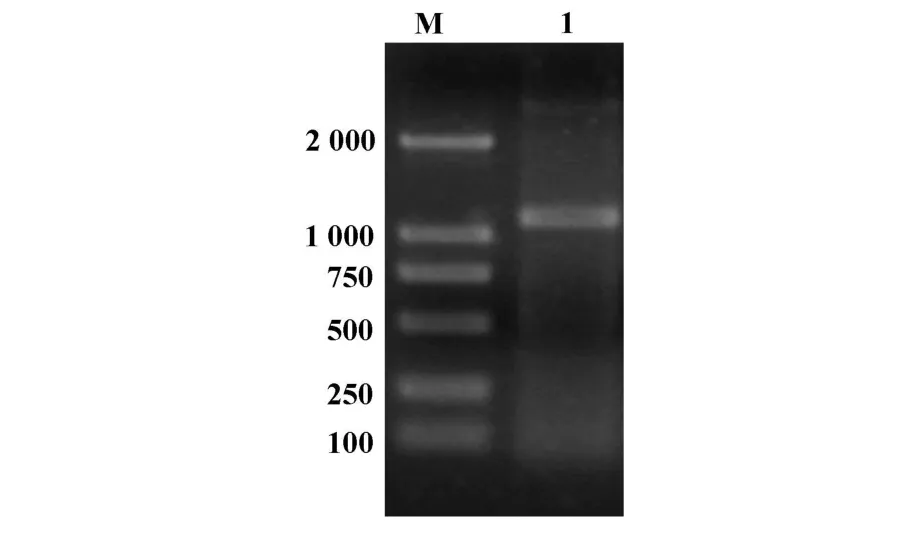
图1 人CXCR3基因克隆的PCR产物Fig.1 PCR product of human CXCR3 gene identified by agargose gel eletrophoresis
2.3 人CXCR3基因转染细胞株L929-CXCR3的构建及鉴定 经Zeocin加压筛选获得的L929-CXCR3细胞株,FCM分析结果显示:细胞中GFP的表达率为99.8%(图3);细胞膜表面CXCR3分子的阳性表达率为98.4%(图4)。RT-PCR方法进一步从基因水平验证了L929-CXCR3中人CXCR3基因的表达(图5)。
2.4 L929-CXCR3在其配体作用下迁移能力的分析Transwell分析结果显示,Mig、IP-10及I-TAC均可趋化 L929-CXCR3迁移,但起始浓度不同,依次为Mig 10 ng/ml、IP-10 5 ng/ml及 I-TAC 1 ng/ml,相应迁移率分别为2.46%、2.34%及2.24%,并且具有浓度依赖性。三种配体在10 ng/ml时介导L929-CXCR3的迁移率与对照细胞L929-mock的迁移率有显著性差异(P<0.01,图6)。对三种配体在10、20、50 ng/ml时介导L929-CXCR3的迁移率比较发现,同等浓度条件下,I-TAC引起的迁移率与Mig和IP-10引起的迁移率相比均具有显著性差异(P<0.01),而Mig和IP-10相比无显著性差异(图7)。
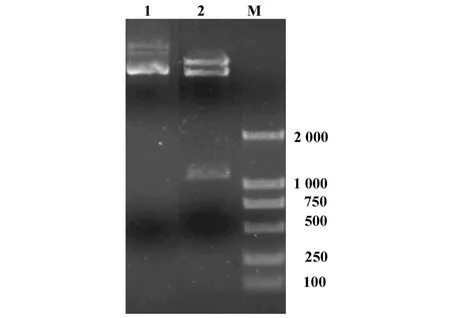
图2 重组逆转录病毒载体的双酶切鉴定Fig.2 The results of reconstruion pEGZ-term vector digested by EcoRⅠand BamHⅠ
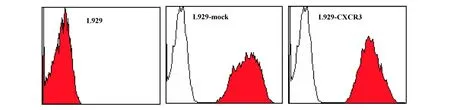
图3 流式细胞术分析L929-CXCR3细胞中GFP的表达Fig.3 Analysis of GFP report gene expressed in L929-CXCR3 by FCM
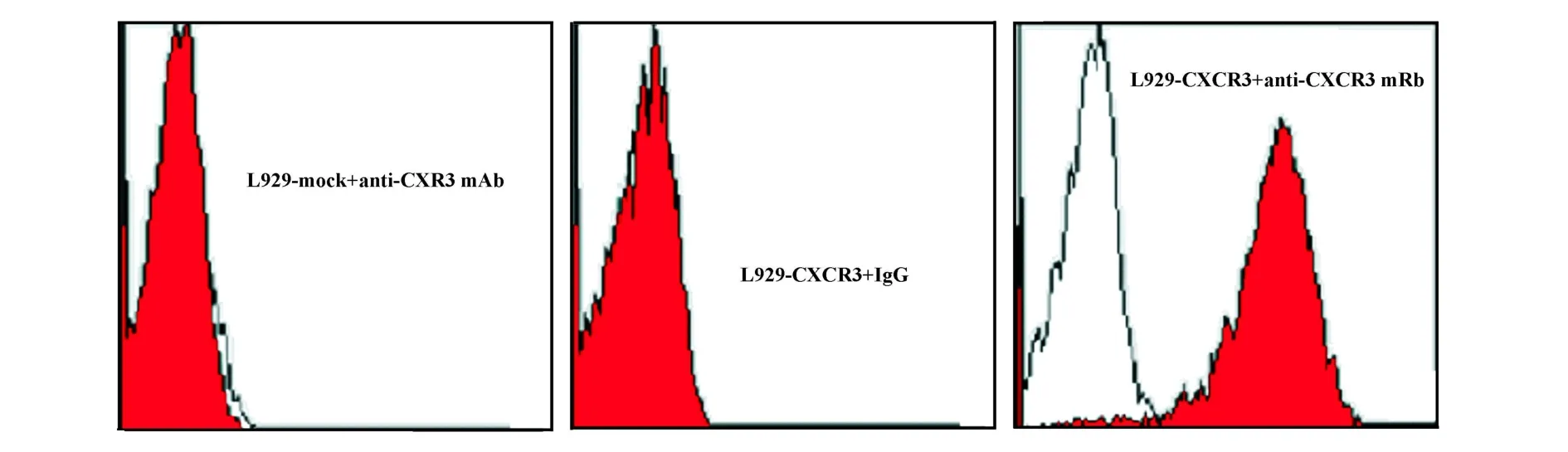
图4 流式细胞术检测人CXCR3分子在L929-CXCR3上的表达Fig.4 Detection of human CXCR3 molecule expression on the membrane of L929-CXCR3 by FCM
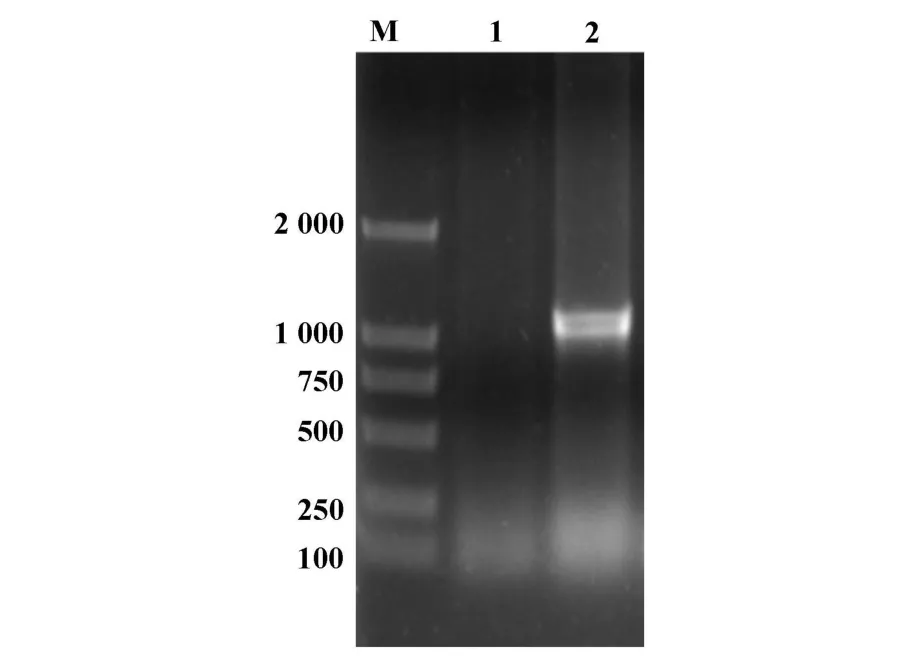
图5 L929-CXCR3细胞中人CXCR3基因的RT-PCR及凝胶电泳鉴定Fig.5 Identification of human CXCR3 gene in L929-CXCR3 by RT-PCR and gel electrophoresis
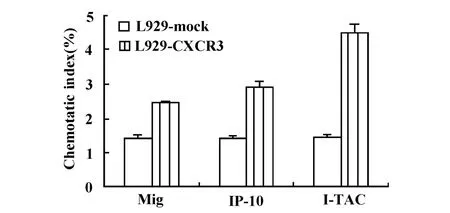
图6 L929-CXCR3在10 ng/ml的Mig、IP-10及 I-TAC作用下的迁移率Fig.6 Chemotatic index of L929-CXCR3 induced by 10 ng/ml Mig,IP-10 and I-TAC
3 讨论
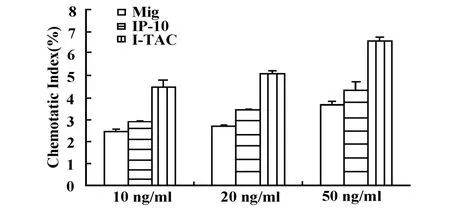
图7 L929-CXCR3在同等浓度的Mig、IP-10及 I-TAC作用下的迁移率的比较Fig.7 Comparisition of chemotatic index of L929-CXCR3 induced by Mig,IP-10 and I-TAC respectively
CXCR3主要表达于活化/记忆T细胞,NK细胞及巨噬细胞等,IL-2可上调CXCR3的表达;有三种CXC趋化因子可与CXCR3结合 ,分别是Mig、IP-10及I-TAC[10]。CXCR3的这三种配体主要表达于内皮细胞、成纤维细胞、角质形成细胞以及单核细胞等,受体-配体相互作用可趋化CXCR3+细胞定向迁移[11]。本研究构建了含有人CXCR3序列的重组逆转录病毒载体,将其与两辅助病毒载体脂质体法共转染包装细胞293T,收集含完整逆转录病毒颗粒的293T培养上清感染L929细胞,利用500~800 μ g/ml的Zeocin加压筛选培养2周,挑取单克隆集落,扩大培养。经反复冻存与复苏后,FCM检测L929-CXCR3膜表面CXCR3分子的阳性表达率仍在98.0%以上,以确定建立了稳定表达人CXCR3分子的基因转染细胞株L929-CXCR3。
利用 Transwell系统研究了CXCR3三种配体Mig、IP-10及I-TAC对L929-CXCR3的趋化效力。研究结果显示,L929-CXCR3在Mig、IP-10及I-TAC作用下可发生迁移,但三种配体的起始浓度不同,并且具有浓度依赖性。另外Mig、IP-10及I-TAC在同等浓度下介导L929-CXCR3的迁移率不同,推测它们与CXCR3可能具有不同的结合位点或不同的亲和力,强度依次为I-TAC>IP-10≥Mig。因此,L929-CXCR3趋化迁移模型的建立对研究自身免疫性疾病与移植排异中淋巴细胞的迁移,以及CXCR3信号转导在肿瘤转移过程中的作用,具有相应的实验价值。
利用本基因转染细胞株作为免疫原免疫小鼠,可以制备鼠抗人CXCR3单克隆抗体,为进一步研究CXCR3在恶性肿瘤细胞表面的表达及其与肿瘤转移的相关性奠定了基础。据文献报道,CXCR3在黑色素瘤、结肠癌、乳腺癌、B淋巴瘤等肿瘤细胞和组织中高表达,并且与肿瘤转移密切相关[12-14]。已有研究表明,在黑色素瘤、结肠癌等小鼠肿瘤模型中,应用CXCR3拮抗物AMG487,可有效抑制肿瘤细胞向引流淋巴结的转移;在乳腺癌模型中,可抑制肿瘤细胞向肺部的转移;但均不影响原接种部位肿瘤的生长,这为CXCR3单克隆抗体应用于CXCR3+肿瘤的治疗提供参考依据[15-17]。我们将以此基因转染细胞株为基础,进一步研制鼠抗人CXCR3单克隆抗体,利用单克隆抗体深入研究CXCR3信号通路在肿瘤发生、发展和转移中的作用。
1 Liping L,Melissa K C,De R H et al.Chemokine receptor CXCR3:anunexpected enigma[J].Curr Top Dev Biol,2005;68:149-181.
2 Marcel L,Pius L,Nicole B et al.Lymphocyte-specific chemokine receptor CXCR3:regulation,chemokine,binding and gene localization[J].Eur J Immunol,1998;28(14):3696-3705.
3 Laura L,Michela F,Francesco A et al.An alternatively spliced variant of CXCR3 mediates the inhibition of endothelial cell growth induced by IP-10,Mig,and I-TAC,and acts as functional receptor for platelet factor 4[J].J Exp Med,2003;197(11):1537-1549.
4 杨秀利,储以微,邓富刚 et al.IP10对机体抗肿瘤免疫应答的增强作用及其机制[J].中国免疫学杂志,2006;22(2):99-107.
5 Robert M S,Marie D B,Javier M et al.Cancer CXC chemokine networks and tumour angiogenesis[J].Eur J Cancer,2006;42(6):768-778.
6 Marcel L,Basil G,Pius L et al.Chemokine receptor specific for IP-10and Mig:structure,function,and expression in activated T-lymphocytes[J].J Exp Med,1996;184:963-969.
7 Romagnani P,Lasagni L,Annunziato F et al.CXC chemokines:the regulatory link between inflammation and angiogenesis[J].Trends Immunol,2004;25(4):201-209.
8 Katherine E C,Christine A S,Timothy J P et al.Interferon inducible T cell alpha chemoattractant(I-TAC):a novel Non-ELR CXC chemokine with potent activity on activated T cells through selective high afflnity Binding to CXCR3[J].J ExpMed,1998;187(12):2009-2021.
9 Tonya C W,Salah R,Xinrong M et al.Antagonism of CXCR3 inhibits Lung metastasis in a murine model of metastatic breast cancer[J].Cancer Res,2006;66:(15):7701-7707.
10 康 辉,王亚男,范 霞 et al.趋化因子及其受体与中国HCV/HIV合并感染相关性的研究[J].中国免疫学杂志,2006;22(6):569-572.
11 Robert M S,Marie D B,Brigitte N G et al.CXC chemokines in angiogenesis[J].Cytokine Growth Factor Rev,2005;16(6):593-609.
12 Vandercappellen J,Van Damme J,Struyf S.The role of CXC chemokines and their receptors in cancer[J].Cancer Lett,2008;267(2):226-244.
13 Nicola G,Sabrina B,Paola R et al.CXCR3 and its binding chemokines in myeloma cells:expression of isoforms and potential relationships with myeloma cell proliferation and survival[J].Haematologica,2006;91(11):1489-1497.
14 Maria L B,Antonio B,Francesco P et al.Understanding the immunoangiostatic CXC chemokine network[J].Cardiovasc Res,2008;78(2):250-256.
15 Kenji K,Masahiro S,Hiromi S et al.Pivotal role of CXCR3inmelanoma cell metastasis to lymph nodes[J].Curr Top Dev Biol,2005;68:149-181.
16 Kawada1 K,Hosogi H,Sonoshita1 M et al.Chemokine receptor CXCR3 promotes coloncancermetastasis to lymphonodes[J].Oncogene,2007;26(32):4679-4688.
17 Onya C W,Salah R,Xinrong M et al.Antagonism of CXCR3 inhibits lung metastasis in a murine model of metastatic breast cancer[J].Cancer Res,2006;66(15):7701-7707.