脓毒症时各型一氧化氮合酶在大鼠心脏中的表达及其可能机制
2010-06-19陈艳明王士雯
陈艳明,陈 琪,王士雯
脓毒症是严重创伤、感染及大手术等多种应激状态时的常见并发症,其发病率和死亡率居高不下,而心功能不全在脓毒症早期就可出现,并且与预后密切相关。脓毒症时心功能的降低是多种因素累加的结果,包括氧化磷酸化脱偶联,细胞产生高能磷酸盐的能力降低;心肌冬眠;循环抑制因子TNF-α激活心脏中一氧化氮合酶(nitric oxide synthase,NOS),产生大量 NO[1]。但脓毒症时各型NOS表达及可能作用尚不明确。本研究拟对此进行初步探讨。
1 材料与方法
1.1 材料 成年雄性Wistar大鼠(250~350 g),由解放军总医院实验动物中心提供。脂多糖(lipopolysaccharide,LPS)购自美国Sigma公司。总RNA提取试剂盒、cDNA第一链合成试剂盒、PCR试剂盒购自北京Tianwei公司。兔抗大鼠内皮型NOS(eNOS)、兔抗大鼠神经元型NOS(nNOS)、兔抗大鼠诱导型NOS(iNOS)均购自武汉 Boster公司。
1.2 脓毒症模型建立 30只大鼠,分别腹腔注射生理盐水和LPS(10 mg/kg)各0.2 ml,形成对照组和LPS组。给药6h后取组织备用。
1.3 血流动力学测定 脓毒症模型的建立同前。Wistar大鼠以乌拉坦(1 g/kg)经腹腔注射麻醉,仰卧位固定于手术台上。分离右侧颈总动脉,用充盈0.4%肝素盐水的PE50管向心性插入动脉,连接多道生理记录仪检测心电和血压变化。稳定30 min后向前推进导管至左心室并固定导管,稳定10 min后记录左心室内血流动力学参数,包括心率(heart rate,HR)、等容收缩期左室内压力最大上升速率(+dp/dtmax)、等容舒张期左室内压力最大下降速率(-dp/dtmax)等的改变。
1.4 NOS活性测定 按照南京生物建成技术公司生产的试剂盒说明书测定的结构型NOS(constitutive NOS,cNOS)及诱导型(inducible NOS,iNOS)。
1.5 各型NOS的表达
1.5.1 半定量RT-PCR T rizol试剂提取RNA 紫外分光光度计进行RNA定量。TIAN Script MMLV合成cDNA 第一链,总反应体系25 μ l,反应物用于PCR。利用 DNAclub软件设计各型NOS和 GAPDH 的引物。nNOS:上游 5′-GTCTTCCACCAGGAGATG-3′,下 游 5′-AAAGGCACAGAAGTGGGGGTA-3′,扩增长 度 618bp;eNOS[1]:上 游 5′-TCCAGTAACACAGACAGTGCA-3′,下 游5′-CAGGAAGTAAGTGAGAGC-3′,扩增长度 693bp;iNOS:上游 5′-GAGATCAATGCAGCTGTG-3′,下游5′-AGAATGGAGATAGGACGT-3′,扩增长度 217bp;GAPDH:上游:5′-ATCACCATCTTCCAGGAGCG-3′,下游:5′-TGACCTTGCCCACAGCCTTG-3′,扩增长度443 bp。nNOS PCR反应条件为94℃变性30 s,55℃退火30 s,72℃延伸 1 min,35个循环;eNOS和iNOS PCR反应条件为95℃变性30 s,55℃退火30 s,72℃延伸1 min,34个循环数;GAPDH PCR反应条件为94℃变性30 s,60℃退火30 s,72℃延伸30 s,25个循环数。取5 μ l PCR产物进行琼脂糖电泳,应用凝胶成像系统各型NOS/GAPDH,进行半定量测定。
1.5.2 Western blot测定各型NOS蛋白的表达心肌加入蛋白裂解液匀浆,取上清,紫外分光光度计测定蛋白浓度,其余上清液分装后置于-70℃保存。将样品100℃沸水中加热变性10 min,1000 g短暂离心后,进行蛋白质聚丙烯酸胺凝胶电泳。电泳结束后,进行转膜,将转有蛋白的硝酸纤维素膜置于5%脱脂牛奶中室温下封闭1 h。剪切相应蛋白条带并分别加入兔抗大鼠nNOS、iNOS和eNOS多克隆抗体,4℃过夜。TBST洗膜3次,分别加入山羊抗兔碱性磷酸酶标记二抗(1∶1000稀释),室温孵育1 h。TBST洗膜3次后用NBT/BCIP显色液显色。特异性条带的光密度值采用上海天能科技有限公司GIS像分析系统处理。
1.6 统计学处理 采用GraphPad Prism-4软件进行数据处理。实验数据以±s表示。两组间差异比较采用组间t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 脓毒症时大鼠心脏功能的变化 注射 LPS 6 h后,大鼠平均动脉血压明显下降,心率增加(P<0.05);反映左心室收缩和舒张功能的指标(±dp/dt)下降明显,分别较基础状态下降了20.9%和18.3%(P<0.05;表1)。
2.2 心肌组织NOS活性测定 基础条件下,成年大鼠心脏总NOS(total NOS)的活性为(0.45±0.17)U/mg蛋白质,其中iNOS的活性较弱,cNOS(包括eNOS和nNOS)活性较高;给予LPS处理后,心脏总NOS活性未见明显变化,iNOS的活性明显升高,是基础状态的4倍(P<0.01),cNOS的活性较基础状态减少了27.5%(P<0.05;图1)。
2.3 心脏中各型NOS mRNA的表达 正常情况下,成年大鼠心脏中存在 eNOS mRNA和nNOS mRNA的表达,其中eNOS mRNA的含量高于nNOS mRNA,正常成年大鼠心脏组织中未能检测到iNOS mRNA的表达;给予 LPS 6 h后 iNOS mRNA的含量明显上升,nNOS和eNOS mRNA的含量减少(表2,图2)。
表1 大鼠血流动力学的测定(n=15±s)

表1 大鼠血流动力学的测定(n=15±s)
注:HR:心率;MAP:平均动脉压;与对照组比较,*P<0.05
组别 HR(次/min) MAP(mmHg) +dp/dtmax/(mmHg/s) -dp/dtmax/(mmHg/s)对照组 363±24 125±4 8200±1440 -6000±1230脂多糖组 430±15* 114±5* 6400±1320* -4900±850*
表2 大鼠心肌组织中各型NOS mRNA的表达(n=15±s)
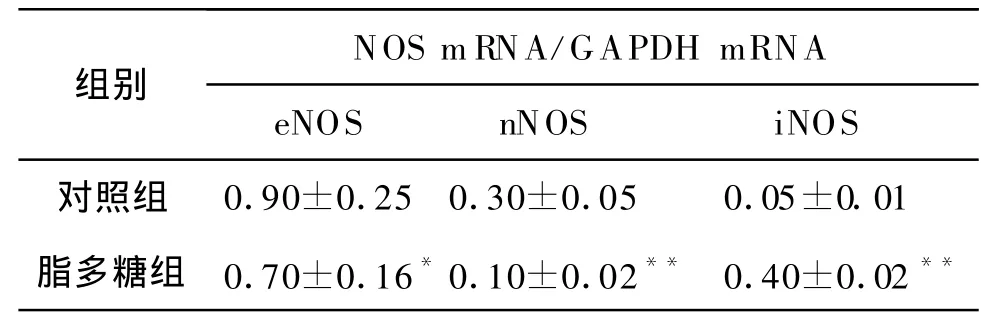
表2 大鼠心肌组织中各型NOS mRNA的表达(n=15±s)
注:eNOS:内皮型一氧化氮合酶;nNOS:神经元型一氧化氮合酶;iNOS:诱导型一氧化氮合酶。与对照组比较,*P<0.05,**P<0.01
NOS mRNA/GAPDH mRNA组别eNOS nNOS iNOS对照组 0.90±0.250.30±0.05 0.05±0.01脂多糖组 0.70±0.16*0.10±0.02** 0.40±0.02**

2.4 心脏各型NOS的蛋白表达 在正常情况下,心肌组织存在cNOS(含nNOS和eNOS)的蛋白表达,但nNOS的蛋白表达量远远少于eNOS的表达量。给予大鼠LPS 6 h后,nNOS和eNOS的蛋白表达量下降(P<0.05)。正常情况下,心肌组织可见极少量iNOS的表达,给予LPS 6 h后,iNOS的表达量明显增加(P<0.01;表3,图3)。
表3 大鼠心肌组织中各型NOS蛋白表达(n=15±s)
注:eNOS:内皮型一氧化氮合酶;nNOS:神经元型一氧化氮合酶;iNOS:诱导型一氧化氮合酶。与对照组比较,*P<0.05,**P<0.01
组别 eNOS/β-actin nNOS/β-actin iNOS/β-actin对照组 0.85±0.25 0.25±0.05 0.05±0.01脂多糖组 0.65±0.20*0.10±0.02**0.60±0.10**

图3 心脏各型NOS的蛋白表达
3 讨 论
本研究证实脓毒症时心血管功能受损,如心室收缩、舒张功能下降、血压下降。内毒素注入体内后可产生明显的心血管抑制作用,而体外实验缺乏相应的抑制作用,提示内毒素通过产生内源性物质介导该损伤作用[2]。
NOS分为3种亚型:nNOS,iNOS和eNOS;其中eNOS和nNOS又统称cNOS,是许多正常组织中基本存在的一种酶,它为Ca2+/钙调素依赖型,合成及释放NO量少,且cNOS合成的NO寿命极短。iNOS为非Ca2+依赖型,它能够持续大量释放NO。给予 LPS后iNOS的活性较基础状态增加4倍,cNOS的活性较弱,iNOS活性增加是产生和释放大量NO的主要原因。
与NOS活性变化一致,给予LPS 6 h后,大鼠心肌组织iNOS表达明显增多(P<0.01);eNOS和nNOS的表达均明显减弱。敲除iNOS基因和应用iNOS阻断剂后,可恢复心血管系统对儿茶酚胺的敏感性[3];但是应用NOS阻断剂SMT、L-Nil和546C88反而增加脓毒症的死亡率[4],提示脓毒症时不仅iNOS在器官损伤中发挥作用,cNOS也可能发挥一定作用。
生理条件下,eNOS催化产生的NO可以透过细胞膜进入血管腔,发挥抑制白细胞附壁、聚集的作用。脓毒症时,心肌血管内白细胞附壁能力增强、黏附分子表达增多、自由基生成增加和血小板聚集、附壁增多[5];脓毒症时心肌细胞上过表达eNOS可防止心功能降低[6]。本研究表明,脓毒症大鼠模型eNOS表达减少,提示其可能在心功能受损中发挥作用。nNOS首次发现时的组织细胞定位在神经元细胞上。且发现它在心脏的交感神经、副交感神经和心肌细胞上也有表达。基础条件下其表达量较eNOS少,并且给予 LPS处理后,心肌细胞nNOS的表达量进一步减少。关于nNOS在心脏中的作用目前研究较少。基础条件下,nNOS产生的NO在心肌细胞对胆碱能和肾上腺能信号转导的调节和肌浆网Ca2+转运中发挥重要作用[7]。基础条件下nNOS主要在心肌细胞的胞浆和胞膜上表达,脓毒症时心肌细胞上nNOS的表达减少,提示nNOS产生NO减少也可能参与心肌细胞功能障碍。另外在对心脏功能调整过程中,各型NOS间存在相互调节[8],在同一疾病不同时间发挥着不同作用;这是一个庞大复杂的体系,因此在脓毒症时各型NOS的作用值得进一步研究。
[1]Fernandes CJ Jr,Akamine N,Knobel E.Myocardial depression in sepsis[J].Shock,2008,36(Suppl):14-17.
[2]T riantafilou M,Triantafilou K.The dynamics of LPS recognition:complex orchestration of multiple receptors[J].Endotoxin Res,2005,11(1):5-11.
[3]Barth E,Radermacher P,Thiemermann C,et al.Role of inducible nitric oxide synthase in the reduced responsiveness of the myocardium to catecholamines in a hyperdynamic murine model of septic shock[J].Crit Care Med,2006,34(2):307-313.
[4]Lee CC,Lin NT,Hsu YH,et al.Inducible nitric oxide synthase inhibition potentiates multiple organ dysfunction induced by endotoxin in conscious rats[J].Cardiovasc Pharmacol,2005,45(5):396-403.
[5]David EJ,David RN,Brian WG.Leukocyte and endothelial cell interactions in sepsis:relevance of the protein C pathway[J].Crit Care Med,2004,32(Suppl):S280-S286.
[6]Ichinose F,Buys ES,Neilan TG,et al.Cardiomyocyte-specific overexpression of nitric oxide synthase 3 prevents myocardial dysfunction in murine models of septic shock[J].Circ Res,2007,100(1):130-139.
[7]Wang H,Kohr MJ,T raynham CJ,et al.Neuronal nitric oxide synthase signaling within cardiac myocytes targets phospholamban[J].Am J Physiol Cell Physiol,2008,296(6):C1566-1575.
[8]Casadei B.The emerging role of neuronal nitric oxide synthase in the regulation of myocardial function[J].Exp Physiol,2006,91(6):943-955.
