胰岛素和丁酸钠对自发性高血压大鼠血管平滑肌细胞组蛋白乙酰化及增殖相关基因和蛋白的影响
2010-06-15傅春江何作云王旭开杨成明王红勇方玉强石伟彬何多芬
傅春江,何作云,王旭开△,杨成明,王红勇,方玉强,石伟彬,韩 愈,何多芬
(第三军医大学:1.大坪医院心内科,重庆400042;2.新桥医院心内科,重庆400037)
我国人群高血压(EH)的患病率呈持续增长趋势,大量研究证实,高血压合并糖尿病及高胰岛素血症的患者,发生心脑血管并发症的风险大大高于单纯高血压患者。研究还证实,胰岛素可促进血管平滑肌细胞(VSMC)中bFGF、TGF-β、PDGF、Matrix Gla和OPN等细胞增殖及表型相关基因及蛋白高表达,而决定VSMC表型的a-SM却是低表达,表明胰岛素促进VSMC异常增殖的同时还伴有VSMC表型改变。那么VSMC是通过何种方式引起这些基因表达差异的呢?目前尚缺乏相关研究。既往对胰岛素引起血管平滑肌细胞异常增殖的研究,多从细胞转录因子(如AP-1等),应答基因转录、翻译及结构基因本身改变等方面入手。近年来,基因外修饰,特别是组蛋白修饰对基因的表达调控有了重要的进展,提出了“组蛋白密码”的假说:即结构基因表达的开放与关闭与组蛋白修饰-染色质重构有关。胰岛素可以促进VSMC增殖,这种作用和丝裂原活化蛋白激酶(MAPK)通路密切相关,在胰岛素引起VSMC增殖的过程中,是否通过了组蛋白修饰,以及MAPK是否参与了这种修饰,目前还不清楚,这正是本研究所要探讨的。
1 材料和方法
1.1 材料 自发性高血压大鼠(SHR)购自北京阜外医院;胎牛血清和DM EM购自Gibco公司;PD98059购自Promega公司;羊抗鼠抗体、羊抗兔抗体、兔抗羊抗体购自Sigma公司;胰岛素购自德国Roche公司,抗MAPK抗体、抗α-SM actin抗体购自Sigma公司;抗 HDAC1抗体、抗H3赖氨酸乙酰化抗体购自Cellsignaling公司;抗 PDGF抗体、抗骨桥蛋白(OPN)抗体购自Santa公司;β-actin抗体购自Abcam公司。
1.2 方法
1.2.1 VSMC的分离培养及分组 采用纯种4周龄雄性SHR,分离主动脉,去除内膜与外膜,用贴块法分离培养VSMC,经免疫组化鉴定,6~10代的VSMC用于研究。实验分为6个组。(1)空白对照组(C组):不加任何干预;(2)胰岛素组(insulin组):加入终浓度为10-7mol/L胰岛素作用;(3)PD98059组:加入终浓度为 10-5mol/L PD98059;(4)丁酸钠组(Na组):加入终浓度为10-3mol/L丁酸钠;(5)胰岛素联合PD98059组(insulin联合 PD98059组):PD98059预处理30min后,再加入同样浓度的胰岛素;(6)胰岛素联合丁酸钠组(insulin联合Na组):丁酸钠预处理 30min后,再加入同样浓度的胰岛素。以上各组胰岛素均作用24h。
1.2.2 VSM C蛋白质提取 按1×108cells/L细胞数接种于25cm2培养瓶中,用含10%小牛血清DMEM培养基培养,贴壁生长后换含1%小牛血清DMEM培养基静置培养24h。将静置培养的VSMC细胞按组别分别加或不加PD98059、丁酸钠,孵育30min后每孔加或不加胰岛素;孵育24h后弃去培养基,冷PBS漂洗,0.25%胰酶消化,4 000r/min、2min,弃上清液,冷PBS漂洗,4 000r/min、2min,弃上清液。4℃下在细胞沉淀中加入细胞裂解液(cell lysis buffer 100μ L+PMSF1μ L),4℃下1h充分裂解。取上清液分装、保存。DU 800 Spectrophotometer建立蛋白质浓度曲线后测定蛋白质样品浓度。
1.2.3 免疫印迹 提取的蛋白质按100μ g上样,9%SDS-聚丙烯酰胺凝胶电泳,125V,90min分离蛋白质125V,125mA,1h转印至PVDF膜。TBST漂洗3次,每次5min,TBS配置的5%脱脂奶粉封闭 2h。用抗 MAPK、α-SM actin和 OPN、HDAC1、PDGF、H3赖氨酸乙酰化抗体进行检测。
2 结 果
2.1 胰岛素和丁酸钠对MAPK的影响 经胰岛素刺激后,VSMC的MAPK表达明显增加,这与前面实验结果一致,而用丁酸钠和PD98059预处理后,胰岛素促进MAPK的表达作用明显减弱(P<0.05),在未给予胰岛素干预情况下,PD98059对VSM C M APK的表达亦有降低作用(P<0.05)(图1)。

图1 胰岛素和丁酸钠对MAPK的影响
2.2 胰岛素和丁酸钠对HDAC1的影响 用胰岛素作用于VSMC,结果显示胰岛素可上调HDAC1的表达,说明胰岛素对组蛋白乙酰化/去乙酰化产生了影响。这种作用可被丁酸钠所阻断,但PD98059对胰岛素作用后的HDAC1无明显影响,说明胰岛素促进HDAC1表达并没有通过MAPK途径,而丁酸钠组HDAC1的表达最低,提示丁酸钠对生理情况下SHR VSMC HDAC1蛋白质的表达即有抑制作用(图2)。
2.3 胰岛素和丁酸钠对H3赖氨酸乙酰化的影响 经胰岛素作用后,SHR VSMC H3乙酰化赖氨酸(Lys9)的表达较正常对照组升高(P<0.05),而 PD98059可使正常对照组 H3乙酰化赖氨酸的表达减弱,同时抑制胰岛素对H3乙酰化赖氨酸的上调作用,说明胰岛素促进H3赖氨酸乙酰化的作用通过MAPK途径。丁酸钠可使SHR VSMC H3乙酰化赖氨酸的表达明显升高,提示丁酸钠可明显促进VSMC H3的乙酰化(图3)。
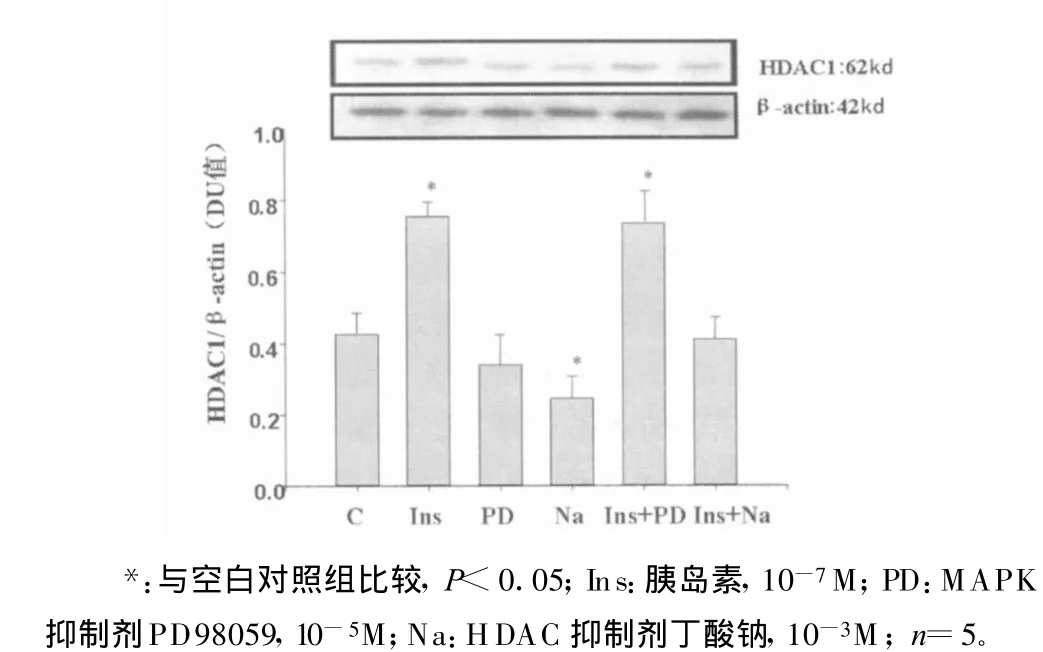
图2 胰岛素和丁酸钠对HDAC1的影响
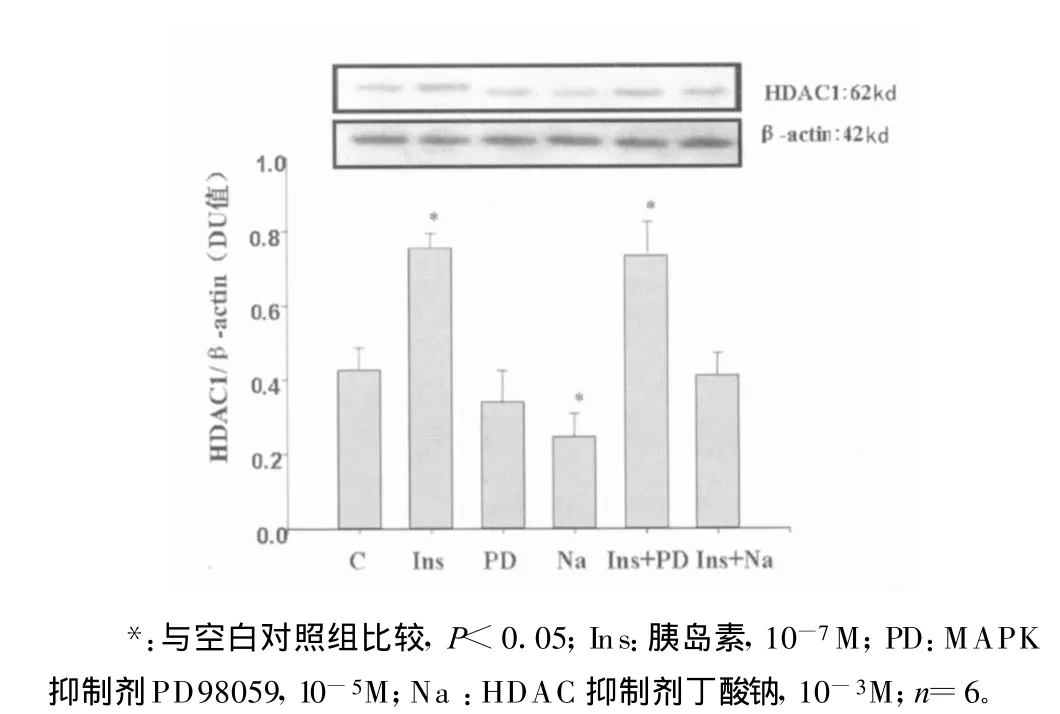
图3 胰岛素和丁酸钠对H3乙酰化赖氨酸的影响
2.4 胰岛素和丁酸钠对PDGF的影响 免疫印迹结果显示胰岛素组PDGF的表达明显高于其他组(P<0.05),PD98059及丁酸钠预处理后,与胰岛素组比较这种作用受到明显的抑制(P<0.05)(图4)。

图4 胰岛素和丁酸钠对PDGF的影响
2.5 胰岛素和丁酸钠对α-SM actin的影响 免疫印迹结果显示胰岛素组α-SM actin的表达明显低于其他组(P<0.05),PD98059及丁酸钠预处理后,这种作用受到明显的抑制与胰岛素组比较(P<0.05)(图 5)。
2.6 胰岛素和丁酸钠对OPN的影响 免疫印迹结果显示胰岛素作用后OPN的表达较空白对照组明显增强(P<0.05),PD98059及丁酸钠预处理后,OPN的表达明显减弱,与胰岛素组比较差异有统计学意义(P<0.05)(图 6)。

图5 胰岛素和丁酸钠对α-SM actin的影响

图6 胰岛素和丁酸钠对OPN的影响
3 讨 论
丁酸钠是HDAC抑制剂,通过抑制HDACs的活性,引起组蛋白超乙酰化。国内外大量研究证实丁酸钠对许多种细胞的异常增殖能够起到抑制作用,并且丁酸钠已经应用于肿瘤的临床研究。但是关于丁酸钠对高胰岛素血症时VSMC的异常增殖作用研究得较少。本研究发现,在丁酸钠预处理后,胰岛素促进VSMC增殖的作用受到明显抑制,说明组蛋白的超乙酰化同样对VSMC异常增殖具有抑制作用。在丁酸钠处理后,结果显示H3组蛋白赖氨酸乙酰化与其他组相比明显增强,这和国外的相关研究结果一致。同时本研究发现,在使用胰岛素刺激后,H3组蛋白赖氨酸表达亦增强,为什么都是组蛋白赖氨酸乙酰化增强而胰岛素的作用表现促进细胞增殖,而丁酸钠的作用是抑制细胞增殖呢?组蛋白乙酰化可以中和组蛋白所带正电荷,从而减弱核小体中碱性氨基酸与DNA的静电吸引力,降低其与带负电荷DNA链的亲和性,降低相邻核小体之间的聚集,使DNA与组蛋白空间位阻增大,两者间的相互作用减弱,DNA易于解聚,染色质呈转录活性结构,因此有利于转录因子与DNA模板相结合,增加转录因子的进入进而激活基因转录[1]。本研究也发现细胞增殖相关基因PDGF在胰岛素的作用下表达明显升高,同时伴随H3赖氨酸乙酰化增强,说明H3赖氨酸乙酰化使得PDGF基因活化。关于细胞增殖相关因子PDGF是目前研究得比较多的,大量的研究证实PDGF促进VSMC的增殖,这种现象在肿瘤细胞也得到证实,胰岛素促进VSMC增殖和很多癌基因的激活相关,癌基因激活后又可通过增殖相关因子的激活从而使细胞增殖。因此,丁酸钠可能对VSMC的增殖存在抑制作用。丁酸钠抑制细胞增殖的原因在于其使组蛋白超乙酰化,有研究证实组蛋白乙酰化促进细胞增殖,但组蛋白的超乙酰化反而抑制细胞增殖,研究发现丁酸钠可以下调增殖相关细胞核抗原(PCNA)、视网膜母细胞瘤敏感蛋白p130(pRb)、细胞分裂控制蛋白2同系物(cdc2),细胞周期素(cyclin)B1、细胞分裂控制蛋白 20同系物(p55cdc),HMG1、2以及其他细胞增殖相关基因的表达,上调cyclin D1、p21WAF1、p141NK4B/p15INK5B、丛集蛋白等增殖抑制基因的表达。同时丁酸钠还对应激相关蛋白如热休克蛋白(HSP)、细胞色素P450,血管功能调节蛋白存在影响[2]。丁酸钠还对GST-P1在核上的定位存在影响,同时下调应激氧化蛋白[3],从而抑制VSMC的增殖。因此,丁酸钠抑制细胞增殖和两方面因素有关:(1)组蛋白的超乙酰化抑制了增殖相关基因的转录;(2)组蛋白的这种超乙酰化促进抗癌基因及增殖抑制基因的转录活性,且这种作用具有肿瘤相关基因特异性,其具体机制目前不清。使用丁酸钠处理后,组蛋白的超乙酰化对MAPK也起到抑制作用,MAPK作为细胞信号转导通路在VSMC增殖过程中扮演着重要的角色[4],胰岛素促进VSMC增殖其中的重要一条通路就是MAPK途径已经得到较广泛地认同。
本研究发现,丁酸钠明显抑制MAPK蛋白的表达。这可能是丁酸钠抑制胰岛素促VSMC增殖的一个重要机制。在本研究中发现一个有趣的现象,胰岛素虽然促进H3组蛋白乙酰化,但对HDAC1的作用却是增强的。HDAC1是组蛋白去乙酰化酶之一,可以使组蛋白去乙酰化,从理论上讲,HDAC1的增强应该使组蛋白去乙酰化增强,乙酰化减弱,但本研究的结果却显示胰岛素促进HDAC1的表达。作者分析这可能和两方面因素有关:(1)组蛋白的去乙酰化是HDAC家族共同作用的结果,每一种HDAC对结合在DNA上的组蛋白靶点是不同的,胰岛素可能对不同的HDAC具有不同的作用;(2)胰岛素促进了H3组蛋白的乙酰化,是否在VSMC内存在着一种反馈平衡机制,使得HDAC1的活性反而增强呢?以上只是推测,具体机制有待进一步探讨。在阻断MAPK后并不能抑制胰岛素促进HDAC1的作用,说明胰岛素促进HDAC1的表达没有通过MAPK途径。因为细胞信号转导通路有很多种,如蛋白激酶A(PKA),蛋白激酶C(PKC)和磷脂酰肌醇-3(羟基)激酶(PI3K)-丝氨酸/苏氨酸蛋白激酶(Akt)通路等。胰岛素的这种作用有可能通过了其他途径。
本研究还证实,PD98059可以阻断胰岛素促进H3的乙酰化作用,说明在VSMC中,胰岛素对H3的乙酰化作用是通过了MAPK信号通路的。在H3乙酰化减弱的同时伴随VSMC增殖的抑制,说明H3乙酰化对VSMC的增殖具有重要意义。H3乙酰化增加的同时细胞也发生了表型的转化,在VSMC中α-SM actin作为收缩型的标志,而OPN和基质蛋白作为合成型的标志。研究发现VSMC增殖的同时往往伴随这些蛋白的变化,因此,一部分研究者也把α-SM actin和OPN含量的变化作为细胞增殖的一个指标。VSMC的主要特点是在成熟的血管组织中并非是其终末分化状态,因此在某种条件下其表型可以被调节。VSMC去分化状态和表型的改变被认为是在动脉粥样硬化和新生内膜过度增殖过程中血管壁重构的重要方面。分化状态的VSM C呈纺锤形,增殖和收缩能力均很低;而去分化状态的VSMC呈菱形或上皮细胞样,具有较高的增殖能力和迁移能力,其蛋白水解活性也增加,而细胞支架和收缩蛋白含量降低,并且对凋亡诱导刺激的敏感性增加[5]。
胰岛素可促使PDGF上调,PD98059和丁酸钠均可阻断胰岛素对VSMC的这种作用,说明组蛋白的超乙酰化通过某种途径抑制了PDGF的表达,组蛋白的乙酰化/去乙酰化改变在胰岛素促VSMC增殖的过程中起着重要的调控作用。
本研究发现胰岛素促使α-SM actin下调的同时使OPN上调,且这种作用能够被PD98059和丁酸钠阻断,因此,一方面说明胰岛素的这种作用通过了MAPK通路,另一方面说明结构基因的外修饰即组蛋白的乙酰化/去乙酰化改变影响了这些蛋白质的表达。从机制上推测,组蛋白的超乙酰化抑制了某些增殖及表型转化相关基因,使得VSMC的增殖受到抑制,从而升高α-SM actin和下调OPN。据此,作者认为,胰岛素是否通过这样一个途径而引起VSMC增殖的呢?即胰岛素→MAPK细胞信号转导系统→组蛋白乙酰化改变→相关增殖基因(如PDGF)活化→细胞增殖和表型转化。但其中许多具体环节尚待进一步研究。在临床上,冠脉内支架植入术已被广泛地应用于冠心病的治疗,在支架植入后,如何预防再狭窄是保持支架作用长期稳定性的关键,雷帕霉素细胞内的作用靶点是雷帕霉素靶蛋白(mTOR),其通常情况下被Akt磷酸化。雷帕霉素可以抑制mTOR下游的活化,包括JNK活化以及诱导凋亡[6],从而抑制VSM C的增殖,达到防止再狭窄的目的。目前,雷帕霉素涂层支架已经应用于临床治疗并被认可,丁酸钠作为人体内生理存在的成分,是否可以作为预防再狭窄的药物?值得进一步研究。
[1]Kozarides T.Histone acetylases and dacetylases in cell proliferation[J].Curr Opin Genet Dev,1999,9:40.
[2]Ranganna K,Yousefipour Z,Yatsu FM,et al.Gene expression profile ofbutyrate-inhibited vascularsmooth muscle cell proliferation[J].M ol Cell Biochem,2003,254(1-2):21.
[3]Ranganna K,M athew OP,Yatsu FM,et al.Involvement of glutathione/glutathione S-transferase antioxidant system in butyrate-inhibited vascular smooth muscle cell proliferation[J].FEBS,2007,274(22):5962.
[4]Sassi Y,Lipskaia L,Vandecasteele G,et al.Multidrug resistance-associated protein 4 regulates cAM P-dependent signaling pathways and controls human and rat SMC proliferation[J].J Clin Invest,2008,118(8):2747.
[5]Owens GK,Kumar MS,Wamhoff BR.Molecular regulation of vascular smooth muscle cell differentiation in development and disease[J].Physiol Rev,2004,84(3):767.
[6]Huang S,Shu L,Dilling MB,et al.Sustained activation of the JNK cascade and rapamycin-induced apoptosis are suppressed by p53/p21(Cip1)[J].Mol Cell,2003,11(6):1491.
