肿瘤坏死因子-α对人喉鳞癌细胞放疗增敏作用的实验研究*
2010-06-15朱圣明宋仕茂骆志国吴俊波
朱圣明,宋仕茂,吴 峰,骆志国,丁 珺,吴俊波
(湖北省十堰市郧阳医学院附属太和医院肿瘤科,湖北十堰442000)
放疗在头颈部恶性肿瘤,如喉癌的治疗中占有重要的地位。然而,放疗后肿瘤局部残存和复发是放疗失败的主要表现形式,其根本原因在于肿瘤细胞中存在放射抗拒性细胞。单纯从改进放射物理技术的角度来解决这一问题已经接近平台期。因此,积极寻求联合增敏的策略和手段是提高放疗疗效的重要途径。为此,国内外学者开始尝试着通过各种手段来增强肿瘤细胞对放疗的敏感性,其中包括小剂量化疗的放疗增敏、分子靶向药物的放疗增敏、基因增敏以及中草药的放疗增敏等[1]。这些策略各异的增敏手段一定程度上增加了肿瘤细胞的放射敏感性,但也存在毒副反应大、疗效有限的不足。
近年来,利用人体中正常存在的细胞因子等生物制剂用于放疗增敏逐渐引起肿瘤研究者的关注[2]。肿瘤坏死因子-α(TNF-α)是由激活的巨噬细胞或单核细胞分泌的一种具有多种生物活性的细胞因子。大量的研究证实,TNF-α除具有抗感染和调节机体免疫的功能外,尚可起到诸如肿瘤生长抑制等多种机制的抗肿瘤效应[3]。本研究建立人喉鳞癌放射抗拒性细胞模型Hep-2R,通过检测 TNF-α对Hep-2R增殖、凋亡的影响及细胞凋亡相关基因表达水平的变化,探讨TNF-α对放射抗拒性Hep-2R细胞放射敏感性的逆转作用。
1 材料与方法
1.1 细胞系 放射抗拒性人喉鳞癌细胞系Hep-2R为武汉大学中南医院肿瘤研究所惠赠并于本研究室保存,细胞用完全培养基于37℃、5%CO2的孵箱中培养。该细胞系是在母本细胞Hep-2的基础上经超分割照射诱导构建而成,并在传代培养过程中经过多次放射敏感性检测证实了其放射抗拒性[4]。
1.2 主要试剂和仪器 四甲基偶氮唑蓝(MT T)购于武汉天源生物技术有限公司,为Duchefa分装;TUNEL凋亡试剂盒为Roche公司产品;总RNA提取试剂盒为美国Invitrogen公司产品;M-MLV逆转录酶为美国Promega公司产品;Ex Taq DNA聚合酶为日本Takara公司产品;重组人肿瘤坏死因子α(rhTNF-α)为北京宝赛生物公司产品;流式凋亡检测试剂盒为北京瑞帮兴业科技有限公司产品;Elite ESP型流式细胞仪为美国Coulter公司生产;IX-71型倒置荧光显微镜为日本O-lympus公司生产。
1.3 M TT检测 将贴壁细胞用0.25%的胰蛋白酶消化后计数,调整细胞浓度为1×104/mL,接种于 96孔板。待12h细胞贴壁后加重组人TNF-α,实验组分别加入终浓度为 100u/mL、200u/mL 、400u/mL 、600u/mL 的 TNF-α100μ L,对照 组(0u/mL)加入等体积溶剂的培养液,每组12复孔。MT T比色法分别于加药后24、48、72h测定各孔570nm的吸光度值(OD值)。根据下列公式计算各培养孔中的细胞生长抑制率:细胞抑制率=(OD对照-OD实验)/OD对照×100%。
1.4 T UNEL及流式细胞法检测细胞凋亡 消化贴壁培养至对数生长期的Hep-2R细胞并计数,调整细胞浓度为2×105/mL。将干净无菌玻片置入 6孔培养板中,按2×105/孔接种细胞。待各孔细胞铺满玻片80%,将细胞分组进行实验。空白组:未作任何处理的Hep-2R细胞;TNF-α处理组:400u/mL TNF-α处理;TNF-α联合放疗处理组:400u/mLTNF-α处理后24h加用常规分割单次照射剂量2Gy(60Co治疗机,射野20cm×20cm,源皮距80cm,61.3cGy/min),每组设置3个平行复孔;另设阴性对照组:地塞米松处理和阳性对照组:DNAase处理。处理后的细胞按照TUNEL凋亡检测试剂盒操作方法进行凋亡检测。发生凋亡的细胞DNA出现断裂,其dUTP可被亲和素标记的异硫氨酸荧光素(FITC-Sigma)标记,在荧光显微镜下呈荧光阳性,计算细胞平均凋亡率。另取上述处理细胞各1×106个用冷 PBS洗涤2次后重悬于200μ LBinding Buffer。再加入 10μ L Annexin V-FITC 和 10μ L PI,轻轻混匀,避光4℃反应30min。 最后加入 300μ LBinding Buffer,用于流式细胞术检测细胞凋亡上机检测。
1.5 Bax凋亡基因检测 按照T rizol总RNA提取操作方法,提取上述各分组处理的细胞的总RNA。以等量的总RNA做为模板,逆转录合成第1条链。逆转录后的cDNA模板用以进行上述处理细胞中Bax mRNA的半定量检测。引物的设计:根据GenBank中人 Baxα的序列(NM_138761)及内对照(人 β-actin)的序 列设计引物。 F1:5′-GCAAACTGGTGCTCAAGGC-3′;R1:5′-AGAAACACCGCCCTCACG-3′(扩 增189bp 的 Baxα片 段);F2:5′-GACTACCTCATGAAGATC-3′,R2:5′-GATCCACATCTGCTGGAA-3′(扩增 500bp 的人β-actin片段)。PCR反应条件:94℃预变性 2min,94℃30s,50℃30s,72℃2min,33个循环,最后72°后延伸 10min。等量PCR产物用15g/L琼脂糖凝胶电泳检测。电泳条带经Bandscan软件灰度扫描后,灰度值进行统计学分析(SPSS13.0)。
1.6 克隆形成实验 消化贴壁培养至对数生长期的Hep-2R细胞并计数。分别按200个/瓶和 400个/瓶在30cm2培养瓶中接种细胞作为空白对照和实验组细胞。将贴壁生长的细胞分组进行实验。空白组:未作任何处理的Hep-2R细胞;TNF-α处理组:400u/mL TNF-α处理;单纯放疗组:照射剂量 2Gy;TNF-α联合放疗处理组:400u/mLTNF-α处理后24h加用2Gy放疗,每组设置3个平行对照,37℃,5%CO2细胞培养箱中连续培养2周。培养期结束,80%乙醇固定细胞并用吉姆萨染色,显微镜下计数细胞克隆形成数目(以大于50个细胞为克隆形成标准),计算平均克隆形成率。克隆形成率=(实验组克隆数/接种数)/(对照克隆数/接种数)。
1.7 动物实验 将8×106个培养至对数期的Hep-2R细胞,消化后均分于4支1.5mL EP管中,离心并洗涤3次,去除培养基中牛血清,分组处理细胞。对照组:加入1mL生理盐水;TNF-α组:加入1mL含400u/mL TNF-α的生理盐水;放疗组:细胞置于无菌平皿中接受放疗;TNF-α联合放疗组:1mL含400u/mL TNF-α处理细胞后接受放疗。收集细胞,用无血清1640制成每0.2mL含1×106个细胞悬液,用微量注射器注入0.2mL于裸鼠右肋皮下,每组细胞接种5只裸鼠。30d观察期内,每周测量小鼠瘤体大小,记录数据。30d后,处死小鼠,小心剥离瘤体并用天平秤取重量。求取每组小鼠的平均抑瘤率。
2 结 果
2.1 M TT法检测生长抑制率 放射抗拒性人喉鳞癌细胞Hep-2R经不同浓度T NF-α处理后,MT T实验结果显示:不同浓度TNF-α对Hep-2R细胞均有明显的生长抑制作用,且抑制作用具有浓度依赖性,持续作用 24h,400u/mL的 TNF-α可产生对肿瘤细胞50%的抑制作用,达到较理想的药物量效浓度,再增加药物浓度,TNF-α对Hep-2R细胞的生长抑制作用增长减缓。而TNF-α对Hep-2R细胞的生长抑制效应对时间的依赖性并不明显(图1)。
2.2 T UNEL法检测细胞凋亡 经过不同方式处理的Hep-2R细胞,利用亲和素标记的异硫氨酸荧光素染色,在荧光显微镜下观察细胞凋亡并计算其凋亡率,结果显示:不给予任何处理的对照组细胞凋亡率为(6.0±1.1)%,给予 TNF-α处理的Hep-2R细胞凋亡率为(21.0±2.8)%,而 TNF-α联合放疗处理的细胞凋亡率可达(48.0±3.7)%,三者间差异有统计学意义(P<0.05);在实验中,设置的阳性对照和阴性对照细胞凋亡率分别为70%和4%(图2)。
2.3 流式细胞术检测细胞凋亡 放射抗拒性人喉鳞癌细胞Hep-2R经TNF-α处理和联合放疗处理后,流式细胞术检测细胞凋亡指数(apoptosis index,AI),结果表明:不加任何处理的细胞、单纯 TNF-α处理组细胞和TNF-α联合放疗处理组细胞的凋亡指数分别为 1.2±0.3、3.6±0.5和 6.6±0.7,其对应的凋亡率分别为(10±1.3)%、(30±2.2)%和(55±2.7)%,三者间比较差异有统计学意义(P<0.05),单用 TNF-α即可诱导放射抗拒性人喉鳞癌细胞 Hep-2R的显著凋亡,与放疗联用时,凋亡诱导作用明显增加(图3)。

图1 TNF-α对Hep-2R细胞生长抑制的时间和剂量依赖性
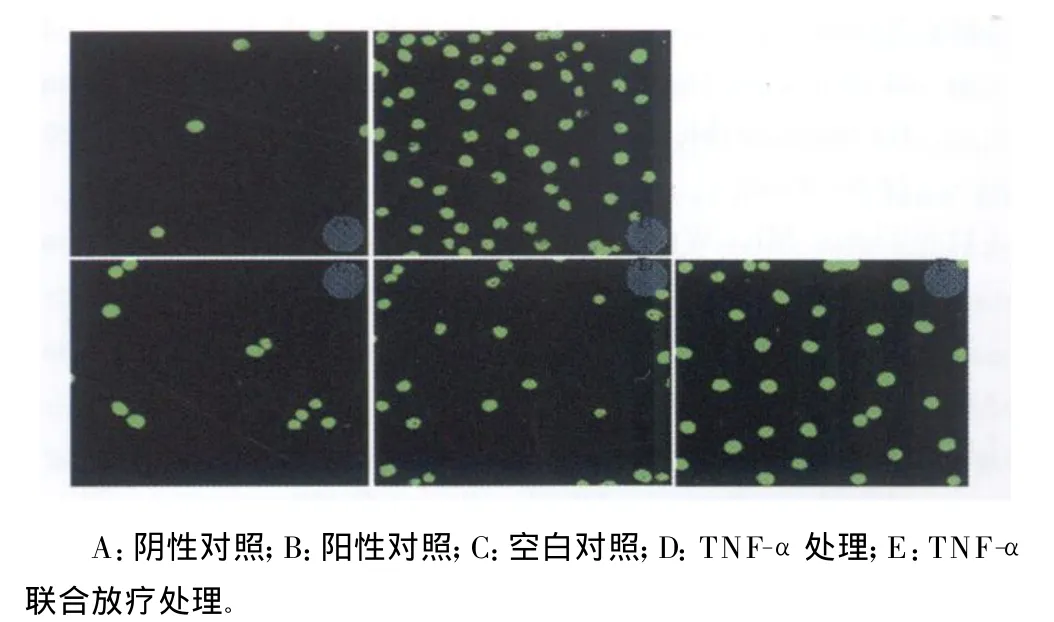
图2 TUNEL法检测 TNF-α诱导Hep-2R细胞凋亡(荧光显微镜×100)

图3 流式细胞术检测TNF-α诱导Hep-2R细胞的凋亡
2.4 凋亡相关基因Bax检测 Hep-R细胞经过TNF-α单独处理和联合放疗处理后,RT-PCR法检测细胞中凋亡相关基因Bax的活性亚基 Baxα的表达水平,结果显示:经过 Bandscan软件灰度扫描,不经任何处理的Hep-R细胞Baxα呈现基础表达水平,其灰度值平均为28±2,而 TNF-α处理的 Hep-R细胞Baxα基因表达明显上调,其灰度值为 45±3,TNF-α联合放疗处理细胞后,Baxα基因表达出现协同增加效应,灰度值达到88±3,数据显示差异有统计学意义(P<0.05)(图4)。
2.5 体外克隆形成实验 放射抗拒性Hep-2R细胞分别单用TNF-α处理、单用放疗处理和 TNF-α联合放疗处理后,体外克隆形成实验计算克隆形成率,求取平均值,实验结果显示:以未作任何处理的空白对照细胞的克隆形成率作为对照,单用放疗处理的、单用TNF-α处理的和 TNF-α处理联合放疗处理的Hep-2R细胞克隆形成率分别为(58±2)%、(80±3)%和(39±2)%,三者间比较差异有统计学意义(P<0.05)(图5)。

图4 RT-PCR检测 Baxα基因表达

图5 体外克隆实验直方图
2.6 裸鼠移植瘤实验 相同数目的放射抗拒性Hep-2R细胞,在分别接受单用放疗处理、单用 TNF-α处理和 TNF-α处理联合放疗处理后接种裸鼠,观察期结束,处死荷瘤小鼠,求取各组小鼠的平均抑瘤率,结果显示:单用 TNF-α处理、单用放疗处理和TNF-α处理联合放疗处理组小鼠的抑瘤率分别为(15.2±1.9)%,(35.4±2.1)%和(55.1±2.9)%,三者比较差异有统计学意义(P<0.05),说明TNF-α有明显的放疗增敏作用。
3 讨 论
TNF-α是一种能直接杀伤肿瘤细胞的多肽细胞因子,也是目前发现的抗肿瘤活性最强的细胞因子之一。TNF-α的抗肿瘤作用不仅表现在其具有直接的肿瘤细胞毒性和细胞生长抑制作用,而且与其他治疗方式联合应用可能发挥更大的抗肿瘤效应。
诸多的研究显示,TNF-α的直接抗肿瘤效应首先体现在对肿瘤细胞生长增殖的抑制。焦伟[5]报道外源性TNF-α能明显抑制体外培养的CNE3细胞的生长增殖,且该抑制效应具有剂量和时相依赖性的特点。本研究分别采用T NF-α的4个不同的药物浓度梯度作用肿瘤细胞Hep-2R,M TT实验检测细胞的增殖情况,结果显示:不同浓度 TNF-α对Hep-2R细胞均有生长抑制作用,且抑制作用具有浓度依赖性,这与焦伟的研究结果一致。但在本研究中,在作者的实验条件下并未发现TNF-α对Hep-2R细胞的生长抑制效应具有明显的时间依赖性,推测这可能与不同肿瘤对 TNF-α的敏感性存在差异[6]。
TNF-α能够诱导细胞凋亡的生物学功能最初在正常细胞的炎症损伤研究中被证实[7]。随着肿瘤发生、发展观念不断丰富,肿瘤细胞凋亡受阻已被证实为恶性肿瘤发生、发展过程中的重要生物学特征。Liu等[8]在门静脉癌栓标本中检测到了肝癌细胞的高凋亡率与 TNF-α高表达的正相关性。刘大庆等[9]的实验则报道应用细胞计数、DNA降解片段琼脂糖凝胶电泳观察及电镜观察等手段检测到,rhTNF-α作用MEC-1细胞后,细胞出现大量的凋亡现象。本研究应用TUNEL法和流式细胞术均检测到,单用TNF-α即可明显诱导放射抗拒性人喉癌细胞的凋亡,而联用常规分割剂量2Gy/次照射后,这种促凋亡效应协同增加。另有报道,化疗也可对TNF-α的促凋亡作用产生协同作用[10-11]。
Wang等[12]和Sun等[13]分别在体内外证实了 TNF-α促进肿瘤细胞凋亡可能与Bcl-2的表达抑制有关。而Bcl-2相关X蛋白(Bax)可与抗凋亡基因Bcl-2形成异源二聚体,具有抑制Bcl-2,促进细胞凋亡的作用,Bcl-2与Bax二者之间的比例决定了细胞的命运。本研究发现,TNF-α处理的人喉癌细胞BaxαmRNA的表达水平高于未经任何处理的母本细胞的表达水平,从而推测TNF-α诱导人喉癌细胞凋亡是通过上调Bax基因/蛋白的表达水平来实现的。这从另外一个角度进一步证实了凋亡相关基因在TNF-α诱导肿瘤细胞凋亡中扮演角色。但Meng等[14]报道的研究结果认为,TNF-α诱导人涎腺腺样囊性癌细胞SACC的凋亡与P53蛋白阳性表达的增加有明确的正相关性,而Bcl-2蛋白不但与此无负相关性,相反在凋亡的早期反而表达增加,推测可能是检测凋亡相关基因的时间与细胞凋亡出现的时间不同步。
增殖和凋亡情况是决定肿瘤细胞接受放射线照射后最终命运的两个最重要因素。肿瘤细胞生长抑制和(或)凋亡增加则放射敏感,反之放射抗拒。本实验利用经典的放射敏感性检测手段研究了TNF-α对Hep-2R细胞的放疗增敏作用,结果显示:T NF-α本身可以通过抑制细胞增殖和促进细胞凋亡降低Hep-2R的克隆形成率,并且能够同放射线的杀伤作用形成协同效应。在裸鼠移植瘤实验也得到了一致的研究成果。与本研究结果一致的是,Yuan等[15]证实了TNF-α对原发性放射抗拒性鼻咽癌细胞的放疗增敏效应。Herzog等[16]进一步发现,T NF-α不仅能增加放疗对敏感细胞的杀伤作用,还能使对放疗耐受的细胞变得敏感。值得提出的是,本研究采用的是放射诱导的放射抗拒性Hep-2R细胞,这一细胞群体既包含了自身放射抗拒的细胞群也包含了放射诱导的细胞群,能更好地反映临床患者放疗过程中细胞群的组成变化。此外,TNF-α在乏氧反应元件的调控下还能实现显著的放射乏氧增敏[17]。
总之,为研究TNF-α对放疗的增敏作用,本实验将 TNF-α作用于放射抗拒性人喉癌细胞Hep-2R,通过生长抑制实验、凋亡检测实验和放射敏感性检测,在体外初步证实了,TNF-α是通过对Hep-2R细胞的生长抑制和诱导凋亡作用从而有效地起到了放疗增敏作用,进而为临床应用TNF-α放疗增敏提供了实验基础和理论依据。
[1]Spalding AC,Lawrence TS.New and emerging radiosensitizers and radioprotectors[J].Cancer Invest,2006,24(4):444.
[2]Yacoub A,Mitchell C,Hong Y,et al.MDA-7 regulates cell growth and radiosensitivity in vitro of primary(nonestablished)human glioma cells[J].Cancer Biol Ther,2004,3(8):739.
[3]Balkwill F.Tumour necrosis factor and cancer[J].Nat Rev Cancer,2009,9(5):361.
[4]骆志国,周福祥,周云峰,等.辐射诱导辐射耐受鳞癌细胞株的建立及其生物学特性[J].中华放射肿瘤学杂志,2005,14(3):208.
[5]焦伟.重组人肿瘤坏死因子对鼻咽癌细胞生长抑制的研究[J].广西医科大学学报,1999,16(5):563.
[6]Ding L,Wu T,Chen XP,et al.Construction of a recombinant eukaryotic vector expressing human tumor necrosis factor alpha and expressing stably in cell line HepG2/ADM[J].Chin J Cancer Prev Treat,2007,14(4):261.
[7]Wei QS,Lu WH,Chen HB,et al.Studies of hepatocytes apoptosis induced by TNF-α and its mechanism[J].Chin German J Clin Oncol,2008,7(2):72.
[8]Liu AZ,Chen XP,Meng CC,et al.Apoptosis and expression of TNF-α of cancer cells in portal vein tumor thrombosis[J].Chin J Hepatobiliary Surg,2004,10(1):45.
[9]刘大庆,司徒镇强,周树夏,等.重组人肿瘤坏死因子α诱导黏液表皮样癌细胞凋亡[J].第四军医大学学报,2004,25(1):152.
[10]Nakamoto T,Inagawa H,Takagi K,et al.A new method of antitumor therapy with a high dose of TNF perfusion for unresectable liver tumors[J].Anticancer Res,2000,20(6A):4087.
[11]Tietze MK,Wuestefeld T,Paul Y,et al.kappaB alpha gene therapy in tumor necrosis factor-alpha and chemotherapy-mediated apoptosis of hepatocellular carcinomas[J].Cancer Gene Ther,2000,7:1315.
[12]Wang Y,Chen HY,Liu WH.Relationship of TNF-induced apoptosis in U937 cell and Bcl22 expression[J].Acta Univ Med Anhui,1999,34(2):99.
[13]Sun GR,Feng FZ,Xiang Y.In Vivo Study of the Expression of Bcl-2 in Transfection of Human Tumor Necrosis Faetor-αinto Drug Resistant Cell Line of Choriocarcinoma[J].Chin J Hemorh,2007,17(3):350.
[14]Meng XM,Wang J,Dong FS,et al.Expression of P53 and bcl-2 proteins in the cell apoptosis of adenoid cystic carcinoma induced by tumor necrosis factor-alpha(TNF-α)[J].J Modern Stomatol,2002,16(2):107.
[15]Yuan J,Sun N.Cell cycle and radio-enhanced sensitivity of NPC[J].J Hainan Med Coll,2004,10(3):139
[16]Herzog TJ,Nelson PK,Mutch DG,et al.Effect of radiation on tumour necrosisfactor-a mediated cytolysis of cell lines derived from cervical carcinomas[J].Gynecol Oncol,1992,47:196.
[17]王卫东,陈正堂,李德志,等.缺氧反应元件对肺癌放射基因治疗的乏氧增敏实验研究[J].重庆医学,2004,33(7):962.
