ERK信号通路与MMP-9在肺腺癌表达中的相关性*
2010-06-15周向东
黎 联,李 敏,周向东
(1.重庆市江津区人民医院呼吸内科 402260;2.重庆市江津区人民医院病理科 402260;3.重庆医科大学附属第二医院呼吸内科 400010)
肺癌发病率高,常发生浸润和转移,因此与肺癌侵袭、转移相关的因子一直是研究的重点。目前研究证实基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)在多种癌组织中的表达明显高于正常组织,在癌的发生、发展中起着重要作用,然而很少有关于M MP-9表达与信号转导通路关系的研究。细胞外信号调节激酶(extracelluar signal-regulated kinase,ERK)是丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族的重要成员,最近,ERK信号通路以正性调节的方式参与肿瘤的侵袭、转移过程而倍受关注。为此,本研究检测磷酸化细胞外信号调节激酶(pERK)、MM P-9在肺腺癌组织中的表达,并进一步在体外研究pERK、MM P-9在肺腺癌细胞中的表达,分析ERK信号通路对肺腺癌细胞M MP-9蛋白表达的影响,评价其临床应用价值。
1 临床资料
1.1 一般资料 选择重庆医科大学附属第二医院和重庆市江津区人民医院67例肺腺癌患者手术切除的肺癌蜡块(2000年3月至2004年3月),14例癌旁正常组织标本。所有标本均经10%甲醛固定,石蜡包埋,5 μ m厚连续切片。男55例,女 12例,年龄40~82岁,>60岁的42例,≤60岁的25例。病灶大于3 cm的40例,病灶小于或等于3 cm的27例。伴淋巴结转移28例,不伴淋巴结转移39例,所有病例术前未行放化疗。据美国联合癌症分类委员会(AJCC)和国际抗癌联盟(UICC)2002年制订的肺癌TNM分期标准[1]:Ⅰ~Ⅱ期37例,Ⅲ~Ⅳ期30例。
1.2 细胞系 人肺腺癌SPC-A-1由重庆医科大学基础医学研究所已有的细胞复苏而得,细胞在 37℃、5%CO2、含10%小牛血清的RPMI1640培养液中培养,0.1%胰酶消化传代。
1.3 主要试剂 RPM I1640培养液购自Gibco公司,胎牛血清购自天津TBD公司,鼠抗人pERK单克隆抗体购自Santa Cruz公司,兔抗人 M MP-9多克隆抗体购自 Sigma公司,PD98059购自碧云天公司。辣根过氧化物酶标记的羊抗兔、羊抗鼠二抗、兔抗人β-actin多克隆抗体、SP超敏免疫组化试剂盒、DAB酶底物显色试剂盒均购自北京中杉金桥生物技术有限公司。
1.4 免疫组织化学 按照免疫组化试剂盒说明书步骤进行pERK(1∶50)、MMP-9(1∶50)免疫组化染色,用与一抗相应的免疫前血清IgG代替一抗作为阴性对照,用已知阳性的切片作阳性对照,结果判定参考文献[2]方法,0~1分为低表达组,≥2分为高表达组。
1.5 蛋白质印迹(Western blot)待培养的细胞至90%汇合状态时,用4℃的 PBS冲洗细胞两次,加入裂解液200 μL,冰上振荡30 min,用细胞刮充分刮取细胞,离心提取上清总蛋白,按1∶4加上样缓冲液后水煮沸3~5 min,EP管分装冻存。不同终浓度的 PD98059(0、4、8、12 μ mol/L)处理腺癌 SPC-A-1细胞24 h后,按上述方法提取蛋白。用Bradford法测蛋白浓度。以每孔40 μ g蛋白上样,60 V恒压电泳,湿式电转移入醋酯纤维膜(PVDF)。5%脱脂奶粉封闭液封闭 1 h,一抗(抗MMP-9、pERK)用抗体稀释液(TBST)按1∶500稀释,4℃孵育过夜,相应二抗37℃孵育1.5 h,化学发光法(ECL)检测条带 ,试验重复3次。
1.6 统计学处理 采用 SAS8.2统计软件,行χ2检验,当样本量较小时采用 Fisher′s精确检验,Spearman相关分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 pERK、MMP-9在肺腺癌组织中的表达及相关性 免疫组化结果显示,pERK蛋白主要位于癌细胞胞浆和胞核,呈棕黄色颗粒,高表达率为65.6%(44/67),正常组织高表达率为14.3%(2/14);MMP-9蛋白主要位于癌细胞细胞质,呈棕黄色颗粒,高表达率为73.1%(49/67),正常组织高表达率为21.4%(3/14)(封2图 1)。在49例MMP-9高表达病例中pERK高表达42例(62.6%),而18例 MMP-9低表达病例中pERK高表达只有2例(4.5%),因此,pERK与MM P-9表达呈明显正相关(r=0.57,P=0.001)。
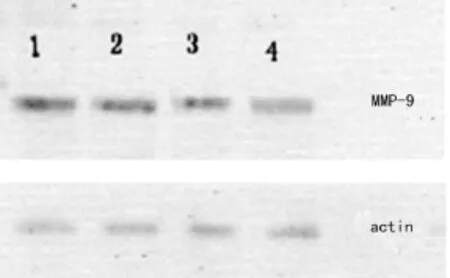
图2 PD98059处理 SPC-A-1细胞24 h后MMP-9蛋白表达变化
2.2 肺腺癌组织pERK、MM P-9表达与临床病理特征的关系 统计结果显示,pERK、MMP-9高表达率在伴淋巴结转移的高于无淋巴结转移患者(P<0.05),在Ⅲ~Ⅳ期患者高于Ⅰ~Ⅱ期患者(P<0.05);pERK、M MP-9表达与患者的年龄、肿瘤大小无明显相关性(P>0.05),见表1。
2.3 PD98059阻断ERK信号通路后肺腺癌细胞MMP-9蛋白表达的变化 将不同终浓度的 PD98059(0、4、8、12 μ mol/L)处理人肺腺癌SPC-A-1细胞24 h后,Western blot检测显示,SPC-A-1细胞MMP-9蛋白表达水平随着PD98059浓度升高而逐渐下降,见图 2。

表1 pERK、MMP-9表达与肺腺癌临床病理特征的关系
3 讨 论
MMP-9是M MPs家族中相对分子质量最大的酶,主要功能是降解、破坏细胞外基质中最主要的组份Ⅳ 、Ⅴ型胶原和明胶。有研究证明MM P-9在多种癌组织中的表达明显高于正常组织[3-5],在肿瘤侵袭和血管发生方面有重要而独特的功能,高表达预示侵袭、转移能力强、预后不良。但是对于其表达与信号转导通路的关系研究很少。
ERK为MAPK家族中最重要的成员,pERK是其活化形式,可将胞外的各种刺激信号通过一系列的级联反应传至核内,pERK在核内促进多种转录因子磷酸化,增强转录活性,对肿瘤的发生、增殖及凋亡起调节作用[6-7],在许多人类癌症(如口腔癌、黑色素瘤、乳腺癌、肺癌等)中都可发现ERK表达高于正常组织,呈现过度激活。然而ERK通路是否参与了MMP-9的表达调控?它们的关系如何?Santibdfiez等[8]研究表明,ERK的激活可诱导NIH3T3细胞中尿激酶的蛋白水解活性,增加角化上皮细胞内MM P-9的分泌;Chung等[9]研究发现乳腺癌细胞及肝细胞肝癌的细胞中ERK信号途径的活化能使MMP-9基因转录;Bartsch等[10]研究发现乳腺癌细胞中ERK可活化MMP-9,ERK抑制剂PD98059剂量依赖性抑制M MP-9表达,表明M MP-9可能是ERK信号途径的下游分子。本研究结果显示,67例肺腺癌组织中pERK和M MP-9的高表达率远高于正常组织,且与 TNM分期及淋巴结转移有关,提示pERK和MM P-9表达与肺腺癌的恶性进展、侵袭、转移及预后有关。统计学分析显示,肺腺癌组织中pERK和MM P-9表达存在正相关,表明M MP-9蛋白表达可能受ERK信号通路的调控。为了进一步研究二者之间的相互作用关系,本研究在体外研究了肺腺癌细胞中 ERK信号通路与MMP-9蛋白表达的关系。Western blot检测显示,PD98059以浓度依赖方式降低肺腺癌SPC-A-1细胞MMP-9蛋白表达,表明肺腺癌细胞MMP-9蛋白表达可能通过ERK信号通路来调控。
综上所述,ERK信号通路通过上调MM P-9的表达促进肺腺癌的恶性进展及侵袭、转移,但其确切机制有待进一步研究。本试验结果可为ERK信号通路作为肺腺癌治疗的靶点提供理论依据。
[1]王吉耀.内科学[M].北京:人民卫生出版社,2005:119.
[2]黎联,梅同华,周向东,等.基质金属蛋白酶26蛋白在非小细胞肺癌组织中的表达及其意义[J].癌症,2009,28(1):76.
[3]NagakawaY,Aoki T,Kasuya K,et al.Histologic features of venous invasion,expression of vascular endothelial growth factor and matrixmetalloproteinase-2 and matrix metalloproteinase-9,and the relation with liver metastasisin pancreatic cancer[J].Pancreas,2002,24(2):169.
[4]孔灵玲,王学春,崔文,等.子宫颈鳞癌组织中基质金属蛋白酶9表达的意义[J].第四军医大学学报,2008,29(3):242.
[5]张尧,吴小候,孙先禹,等.肾细胞癌 MMP-9、VEGF的表达及其临床意义[J].重庆医学,2007,36(13):1298.
[6]Johnson GL,Lapadat R.Mitogen-activated protein kinase pathways mediated by ERK,JNK,and p38 protein kinases[J].Science,2002,298(5600):1911.
[7]Ling H,Zhang LY,Su Q,et a1.Erk is involved in the differentiation induced by diallyl disulfide in the human gastric cancer cell line MGC803[J].Cell M ol Biol Lett,2006,11(3):408.
[8]Santibdfiez JF,Guerero J,Quintanilla M,et a1.Transforming growth factor-beta1 modulates matrix metalloproteinase-9 production through theRas/M APK signaling pathway in transformed keratinocytes[J].Biochem Biophys Res Commun,2002,296(2):267.
[9]Chung TW,Lee YC,Kim CH.Hepatitis B viral HBx induces matrix metalloproteinase-9 gene expression through activation of ERKs and PI-3K/AKTpathways:Involvement of invasive potential[J].FASEB J,2004,18(10):1123.
[10]Bartsch JE,Staten ED,Appert HE.Matrixmetalloproteinase expression in breast cancer[J].J Surg Res,2003,110(2):383.

