慢性低氧高二氧化碳对小鼠大脑线粒体功能的影响
2010-06-13吴彬金露王小同任惠明
吴彬,金露,王小同,任惠明
(温州医学院附属第二医院 脑科、康复中心,浙江 温州 325027)
慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD)发病率近年来不断上升,每年约有250万人死于COPD,已经成为威胁人类生命的第5大死因[1]。既往研究发现,在慢性低氧高二氧化碳条件下,实验动物认知功能发生损害[2]。但是引起认知功能障碍的病理生理机制目前尚未十分清楚,神经细胞凋亡可能是慢性低氧高二氧化碳导致大鼠学习记忆障碍的神经生物学机制之一[3]。此外,慢性低氧高二氧化碳还可引起老鼠神经元及胶质细胞水肿和海马部位细胞因子表达异常[3-5]。线粒体是“细胞能量工厂”,其主要功能是将有机物氧化产生的能量转化为ATP,是有氧呼吸产生能量的主要场所,对细胞的增殖、衰老、凋亡有着至关重要的作用[5-7]。本实验采用慢性低氧高二氧化碳小鼠模型,探讨慢性低氧高二氧化碳对实验动物的大脑线粒体功能的影响。
1 材料和方法
1.1 动物 C57BL/6小鼠,SPF级30只,雄性,7~9月龄,约28 g(温州医学院实验动物中心提供)。
1.2 动物分组及模型建立 实验动物随机分成2组,每组15只:分为A组(低氧高二氧化碳组)和B组(正常对照组)。A组置于低氧高二氧化碳舱中(吸入气O2浓度为9%~11%,CO2浓度为5%~6%),每天8 h每周6 d,持续4周;其余时间与B组生活在同一室内(室温22~26 ℃,相对湿度50%~70%)。为了使A组动物能适应,每次O2浓度从21%降至10%的时间控制在15~20 min,CO2浓度升高至5%的时间控制在30 min。B组小鼠吸入空气,其他条件与A组相同。
1.3 取材和方法
1.3.1 取材及SOD,GSH测定:直接用颈椎脱臼法处死,断头剥离颅骨,完整取出脑组织,置于冰盘上,去除脑干和小脑,沿矢状裂将脑组织一分为二。用脑组织匀浆测量其SOD,GSH含量(具体按照南京建成提供的说明书操作)。
1.3.2 脑组织线粒体的提取:采用差速离心法分离提取脑组织线粒体。取脑组织立即放入4 ℃新配制的分离介质(含0.25 mol/L sucrose、0.1 mol/L Tris-Hcl、0.01 mol/L EDTA,pH 7.4),反复清洗3次,洗净血迹、称重,加入少量分离介质,将组织充分剪碎至肉糜状,分离介质调整至原体积3倍,用玻璃匀浆器手动匀浆,再将匀浆液调整至原体积8倍,1000×g、4 ℃低温离心10 min,取上清液,7000×g、4 ℃低温离心15 min,弃上清液,沉淀物加入1 mL线粒体缓冲液(含0.25 mol/L sucrose、0.1 mol/L Tris-Hcl,pH 7.4),整个提取过程均在冰浴中(0~4 ℃)进行。所提取的线粒体混匀后,在-80 ℃冰箱中保存待用,1周内检测。
1.4 线粒体电镜观察 组织块经2.5%戊二醛固定后,PBS清洗,锇酸固定,再次PBS清洗,依次脱水(70%丙酮、80%丙酮、90%丙酮、100%丙酮);环氧丙烷浸透,EPON812包埋,LKB-V型超薄切片机切片,常规染色,H-600型透射电镜观察脑组织神经元细胞细胞核和线粒体超微结构。
1.5 脑组织腺苷酸的提取 断头后直接经液氮冷冻,再剥离出大脑;加入1.8 mL预冷的0.3 mol/L高氯酸,用研钵冰浴中迅速匀浆;充分匀浆后,匀浆液8000 r/min,4 ℃低温离心10 min;取上清液,用4 mol/L的KOH溶液调pH值至6.0;8000 r/min,4 ℃重复离心10 min;取上清液经0.22μm滤膜过滤,得脑组织腺苷酸溶液。
1.6 脑线粒体膜电位测定 采用2μg/μL线粒体10μL,加入稀释液C 400μL,加入染色剂B 15μL混匀,放置冰槽内孵育10 min,取30μL混合液至载玻片上。在激发波长590 nm、散发波长610 nm波段条件下,用激光共聚焦观察反映线粒体膜电位的红色荧光。在激发波490 nm、散发波590 nm条件下,用荧光分光光度计测定反映线粒体膜电位的相对荧光单位(RFU)。
1.7 线粒体呼吸链酶复合物I、III活性的测定将提取到的各组线粒体配制成蛋白浓度为1μg/μL的线粒体悬浮液,用分光光度法检测线粒体呼吸链酶复合物活性,具体方法参照上海杰美基因医药科技有限公司提供的试剂盒说明书操作。
1.8 脑组织ATP、ADP、AMP含量测定 仪器:日本岛津C18ODS色谱分析柱(5μm,200 mm×4.6 mm),柱温为16 ℃,检测波长254 nm,流速1.1 mL/min,平衡8 min。流动相A:150 mmol/L KH2PO4+150 mmol/L KCl,用2 mol/L KOH调pH至6.0;流动相B:85% A相+15%乙腈;实验当天流动相经0.45μm孔径的微孔滤膜过滤。吸取脑组织混合液20μL测定脑组织ATP,ADP,AMP含量,并计算总腺苷酸TAN(TAN=ATP+ADP+AMP)及细胞能荷EC[EC=(ATP+1/2 ADP)/TAN]值。
1.9 统计学处理方法 组间比较采用t检验。
2 结果
2.1 大脑组织SOD、GSH活性测定 见表1。
2.2 脑组织线粒体电镜观察 A组线粒体空泡化,嵴基本消失,内质网扩张;细胞浆内溶酶体、尼氏体明显增多(见图1);B组线粒体、内质网形态正常(见图2)。
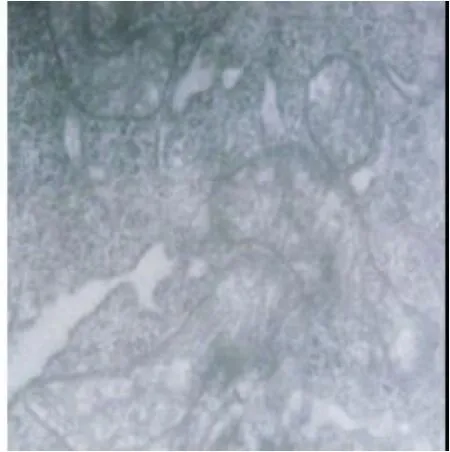
图1 A组大脑线粒体(×15000)
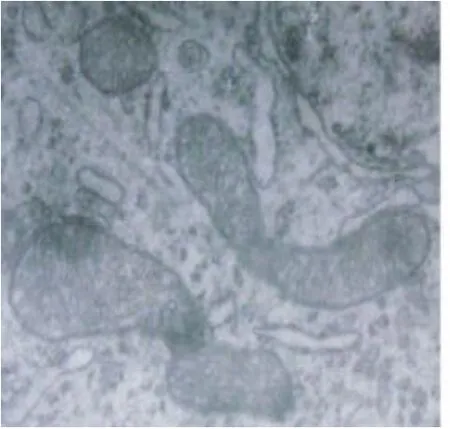
图2 B组大脑线粒体(×15000)
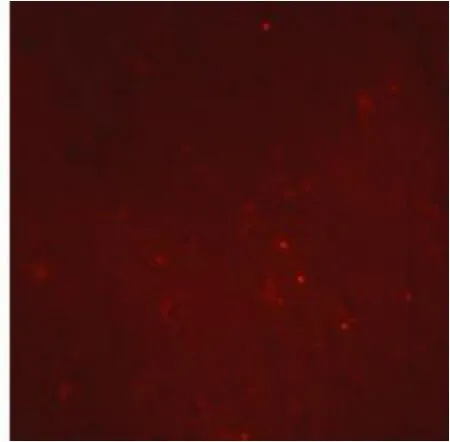
图3 A组confocal(×600)
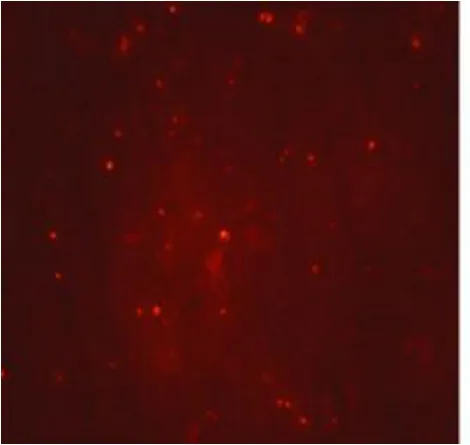
图4 B组confocal(×600)
2.3 线粒体呼吸链酶复合物Ⅰ、Ⅲ活性 与B组比较,A组大脑线粒体呼吸链酶复合物I、III活性均明显降低,差异有显著性(P<0.01),见表2。

表2 线粒体呼吸链酶复合物I、III活性变化(U/mg)
2.4 线粒体膜电位测定 与B组相比:A组小鼠大脑线粒体膜电位荧光染色红光明显减少,表明A组线粒体膜电位受到抑制(见图3、图4);荧光分光光度计的定量测量结果提示A组线粒体膜电位值明显降低,差异有显著性(P<0.01),见表3。

表3 线粒体膜电位(RFU/μg·μL)
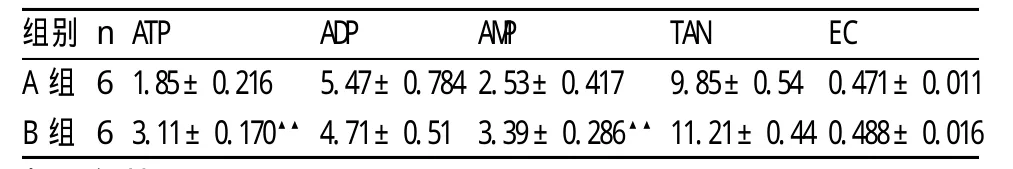
表4 两组小鼠脑组织腺苷酸含量(μmol/g干脑组织)
2.5 脑组织ATP,ADP,AMP含量的测定及EC,TAN的计算 两组小鼠脑组织腺苷酸含量及EC水平比较见表4、图5和图6。与B组相比较:A组的ATP,AMP,TAN浓度均显著降低,差异有显著性(P<0.01);两组的EC,ADP浓度差异无显著性。
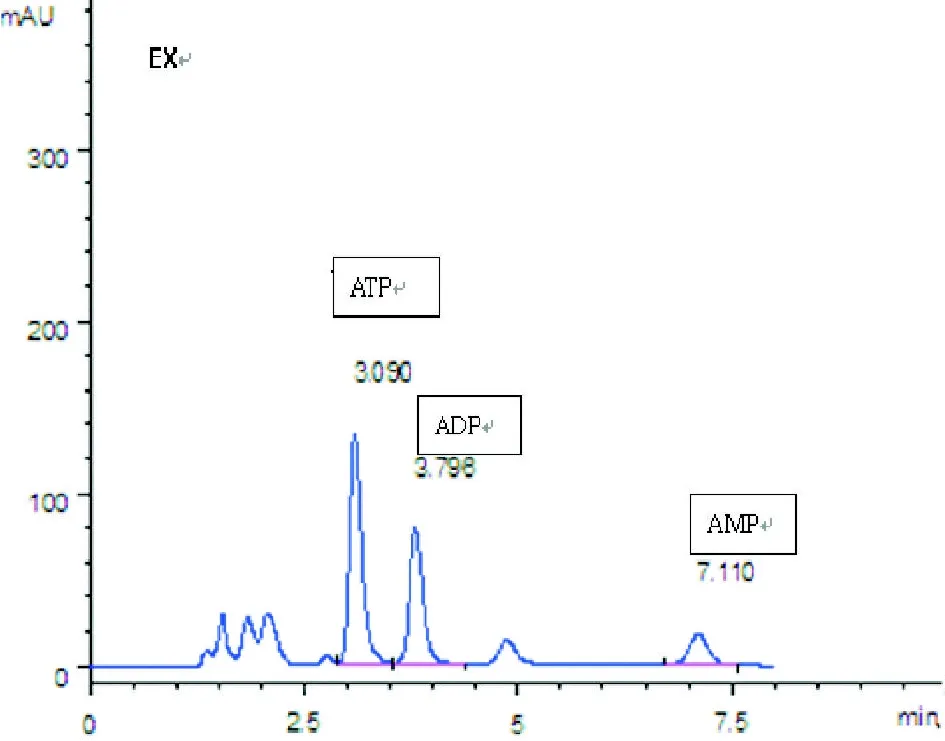
图5 A组大脑能量水平(HPLC)
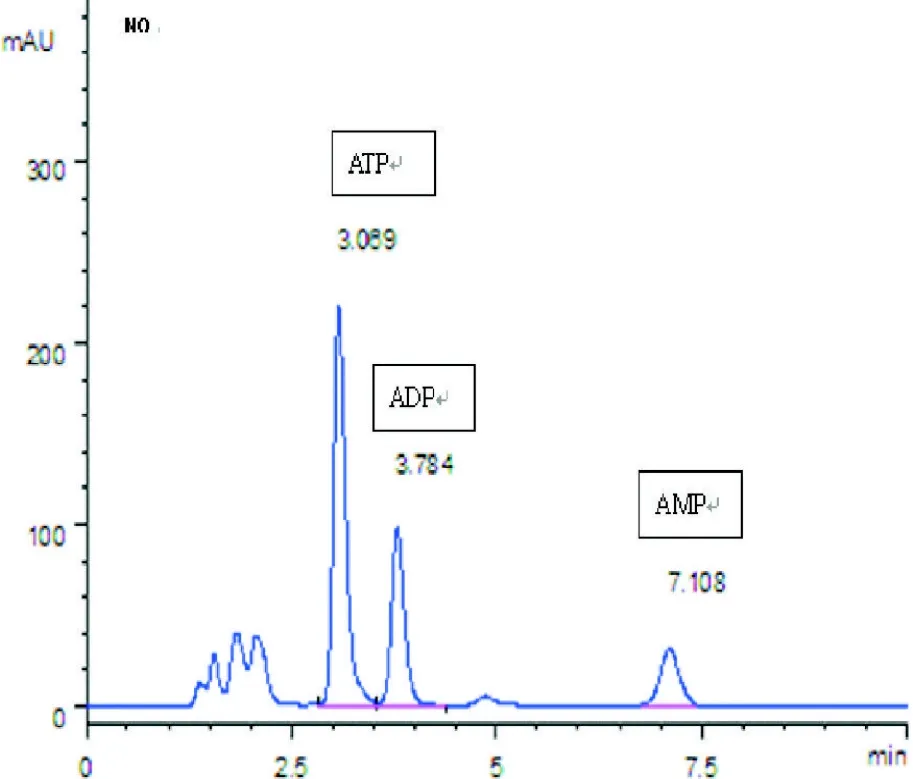
图6 B组大脑能量水平(HPLC)
3 讨论
ATP是生命活动的源泉,细胞的代谢、信号转导、电活动和肌肉收缩等生理过程都需要ATP提供能量。 ATP产生不足势必影响细胞的代谢与功能,导致细胞结构损伤[6],也是导致细胞凋亡和炎症等病理生理过程的主要原因之一[6-7]。线粒体是产生ATP主要场所,提供机体所需要能量的90%以上。本实验发现,暴露于慢性低氧高二氧化碳环境可影响小鼠的线粒体的功能:低氧高二氧化碳组小鼠的ATP,AMP,TAN浓度显著降低,表明线粒体的产能功能受到了明显影响。
暴露于慢性低氧高二氧化碳环境造成实验动物的线粒体产能功能障碍的原因很多:电镜发现低氧高二氧化碳组小鼠脑线粒体空泡化,脊消失,内质网扩张,提示慢性低氧高二氧化碳组的小鼠大脑线粒体形态破坏。其次,本实验也同时发现低氧高二氧化碳组小鼠大脑的线粒体膜电位明显抑制,而线粒体膜的完整及其电位正常是维持线粒体生物学功能必要条件。线粒体膜电位抑制可能同氧化应激反应有关,线粒体内的自由基与线粒体膜进行电子交换,导致膜电位改变[6-9]。第三,线粒体呼吸链又称电子传递链,由四种复合物、细胞色素C和辅酶Q组成,其中线粒体COXI和III,既是电子载体,又是递氢体,也是线粒体呼吸链中对自由基损害特别敏感的部位[10-11]。本实验发现低氧高二氧化碳组小鼠线粒体COXI和III活性显著下降,可能与自由基损伤有关。由于自由基具有获取电子从而达到稳定的化学状态倾向,因此它能诱发对细胞的组成成分的损伤[12-13]。线粒体既是自由基的来源,又是自由基的作用靶点。自由基作用于线粒体DNA、线粒体膜、电子传递链、Ca2+通道等使线粒体损伤,并导致细胞凋亡[14-15]。本实验结果发现低氧高二氧化碳组小鼠脑组织中SOD,GSH活性显著降低。SOD,GSH是内源性氧自由基清除剂, 保护细胞免受氧化性损伤,其活性可反映机体清除氧自由基的能力,因此,SOD,GSH活性降低,是线粒体形态功能障碍的重要原因之一。
由此可见,本实验结果,即暴露于慢性低氧高二氧化碳环境造成实验动物大脑的线粒体功能障碍,对揭示COPD所致的认知功能障碍的病理生理机制有着重要意义。
[1]Viegi G, Scognamiglio A, Baldacci S. Epidemiology of chronic obstructive pulmonary disease (COPD)[J].Respiration, 2001,68(1):4-19.
[2]胡丽燕,王小同,寇雪莲,等.慢性阻塞性肺疾病模型大鼠的学习记忆改变及咖啡因的干预作用[J].中国行为医学科学,2007(7):68-71.
[3]陈松芳,邵胜敏,吴志鹏,等.慢性低O2高CO2对大鼠空间学习记忆及脑内NMDAR1亚基表达的影响[J].中国应用生理学杂志,2007,23(4):434-437.
[4]李勇,宫剑,邵胜敏,等.慢性低O2高CO2对大鼠海马神经细胞TLR4和NFκB的影响[J].中国应用生理学杂志,2009,25(1):27-30.
[5]李笑蓉,王小同.腺苷A2A受体与慢性低O2高CO2小鼠神经系统炎症的关[J].温州医学院学报,2009,39(2):119-122.
[6]胡硕,胡成平. 线粒体与细胞凋亡的研究进展[J].国际呼吸杂志,2006,26(6):463-470.
[7]Haeberlein SL.Mitochondrial function in apoptotic neuronal cell death[J].Neurochem Res,2004,29:521-30.
[8]刘旺华,李花,周小青,等.三七总皂苷对大鼠脑缺血再灌注海马细胞Ca~(2+)及线粒体膜电位的影响[J].中华中医药学刊,2009,27(1):99-101.
[9]钟炼敏,王文文,陶慧敏,等.共固定化肿瘤坏死因子和干扰素诱导的HeLa细胞凋亡的线粒体膜电位研究[J].生物医学工程学杂志,2009,26(5):972-977.
[10]刘树森.线粒体呼吸链与活性氧[J].生命科学,2008,20(4):519-527.
[11]孙飞,周强军,孙吉,等.线粒体呼吸链膜蛋白复合体的结构[J].生命科学,2008,20(4):566-578.
[12]李兵,柳君泽,陈丽芬,等.缺氧对大鼠心肌线粒体能量代谢和腺苷酸转位酶活性的影响[J].中国病理生理杂志,2006,22(3):460-463.
[13]徐瑜,柳君泽,夏琛,等.棕榈酸对模拟高原低氧大鼠离体脑线粒体解耦联蛋白活性及质子漏的影响[J].生理学报,2008,25,60(1):59-64.
[14]夏琛,柳君泽,徐瑜,等.GDP在体外对大鼠脑线粒体脱耦联蛋白活性和表达的影响[J].生理学报, 2008,25,60(4):492-496.
[15]柳君泽,夏琛,徐瑜,等.线粒体能量生成各环节在模拟高原缺氧大鼠脑ATP生成障碍中的作用[J].高原医学杂志,2009,19(3):6-7.
