根癌农杆菌介导CYP1A1转化菠萝的研究
2010-06-08何业华吴会桃罗吉方少秋马均卢敏彭兵伍成厚
何业华,吴会桃,罗吉,方少秋,马均,卢敏,彭兵,伍成厚
(华南农业大学 园艺植物生物技术研究所,广东 广州 510642)
细胞色素P450(cytochrome P450)基因是生物体内的重要代谢基因,它们在生物与环境之间起着重要的联系作用,被认为是环境基因的典型代表[1].CYP1A1是 P450基因大家族的成员之一,它存在于哺乳动物的肝脏等组织内,其表达产物CYP1A1能催化一系列的多环芳香碳氢化合物,如苯巴芘(benzopyrene)和 3-甲基胆蒽(3-methylchol-anthene)等,生成环氧化合物而解除毒性,也能被平面多环芳香化合物TCDD、二噁咽等诱导,因此,含有CYP1A1的转基因植物可用于监测或降解环境中难分解性有机污染物质(persistent organic pollutants,简称POPs)[1].菠萝又称凤梨(Ananas comosus),是世界三大热带果树之一,也是重要的观赏植物和纤维植物,耐干旱瘠薄,生长迅速,因此,将 CYP1A1导入菠萝中可培育出具有环境净化功能的新型果树和观赏植物.虽有研究者进行过菠萝遗传转化研究[2-3],但迄今尚未见P450基因转化菠萝等果树的研究报道.笔者以菠萝愈伤组织为受体,开展了CYP1A1转化菠萝的研究,获得了转CYP1A1的转基因菠萝植株,旨在以该基因提高菠萝对本身及土壤中残留农药等POPs的降解能力.
1 材料与方法
1.1 材 料
供试菠萝品种为神湾(Ananas comosus cv.Shenwan),采自华南农业大学园艺学院果园,取吸芽作为外植体.
含有人类 CYP1A1的植物表达重组质粒(pUHA1-CYP1A1)和大肠杆菌重组质粒(pUHA1-CYP1A1)分别保存在根癌农杆菌(LBA4404菌株)和大肠杆菌(JM109菌株)中,-70 ℃贮存.质粒、农杆菌菌株和大肠杆菌菌株均由日本神户大学基因研究中心(Research Center for Environmental Genomics,Kobe University)赠送.
1.2 方 法
1.2.1 愈伤组织诱导和增殖培养
按照何业华等[4]的方法,取菠萝吸芽在MS+2.0 mg/L BA+3.0 mg/L NAA 上诱导愈伤组织, 切下该愈伤组织转到增殖培养基 MS+3.0 mg/L BA+2.0 mg/L NAA 上增殖.培养条件为:温度(26±2)℃,每天光照14 h,光照度2 000~3 000 lx.
1.2.2 植株转化
转化方法主要参照文献[5].划线培养含有pUHA1-CYP1A1的根癌农杆菌 LBA4404,挑选单菌落接种于YEB液体培养基中,在28 ℃下振荡培养过夜,将其菌液稀释至D600nm为0.5 左右.将受体愈伤组织切分成0.5 mm大小,在MS+3.0 mg/L BA+2.0 mg/L NAA上预培养2 d.将愈伤组织在农杆菌菌液中浸泡5 min,以无菌滤纸迅速吸干受体材料上多余的菌液,植于 MS+3.0 mg/L BA+2.0 mg/L NAA+100 μmol/L AS (acetosyringone,乙酰丁香酮)上于黑暗中共培养 3 d,然后转入 MS+3.0 mg/L BA+2.0 mg/L NAA+20 mg/L Km+400 mg/L Carb上进行选择分化培养(每天光照时间16 h,光照度2 000 lx ).约28 d 后,将抗卡那霉素(Km)的绿色不定芽切下,转接在 MS+2.0 mg/L NAA+30 mg/L Km+300 mg/L Carb上选择2 代.将绿芽转入MS+1.0 mg/L IBA+30 mg/L Km上生根成苗.每批次浸泡处理约500块左右愈伤组织,连续3次进行选择培养.
选择率=(绿芽数/本轮选择不定芽总数)×100%.
累积选择率=(本轮选择所得绿芽数/初代选择时的不定芽总数)×100%.
1.2.3 抗性植株的分子检测
分别取0.2 g转化植株和非转化植株叶片,采用CTAB法提取DNA.根据CYP1A1中一段长约400 bp序列设计 1对特异引物.上游引物 P1:5′-GCCAAGCTTTATAACAATGC-3′;下游引物 P2:5′-AAGGACATGCTCTGACCATT-3′(由上海生物工程公司合成).25 μL PCR反应体系包括2 μmoL/L的引物 P1和引物 P2各 2.5 μL,10×Buffer(with MgCl2)2.5 μL,10 μmol/L dNTPs 0.5 μL,0.7 U Taq酶.反应条件为:94 ℃预变性5 min,94 ℃变性40 s,55 ℃退火60 s,72 ℃延伸1 min,进行38个循环,72 ℃延伸10 min.PCR扩增产物用1.2%琼脂糖凝胶电泳检测.
按上述步骤进行PCR,扩增出的片段经电泳后转膜,用重组质粒(pUHA1-CYP1A1 )PCR 产物回收的CYP1A1片段,按DIG DNA Labeling and Detection Kit使用说明制备探针.根据文献[6]进行Southern杂交验证.
2 结果与分析
2.1 Km对菠萝愈伤组织不定芽分化的影响
菠萝对 Km比较敏感,但也具一定的耐受能力.将愈伤组织接种在含不同质量浓度Km的分化培养基(以琼脂为凝固剂)中发现,当培养基中 Km质量浓度在10 mg/L时,分化出的不定芽中白化芽只占27.6%,仍有72.4%的不定芽显现绿色;但当Km质量浓度升高到15 mg/L时,分化出的不定芽已全部都是白化芽(图1,表1).

图1 Km对菠萝愈伤组织不定芽分化的影响Fig.1 Influence of Km on adventitious shoots differentiation of pineapple callus
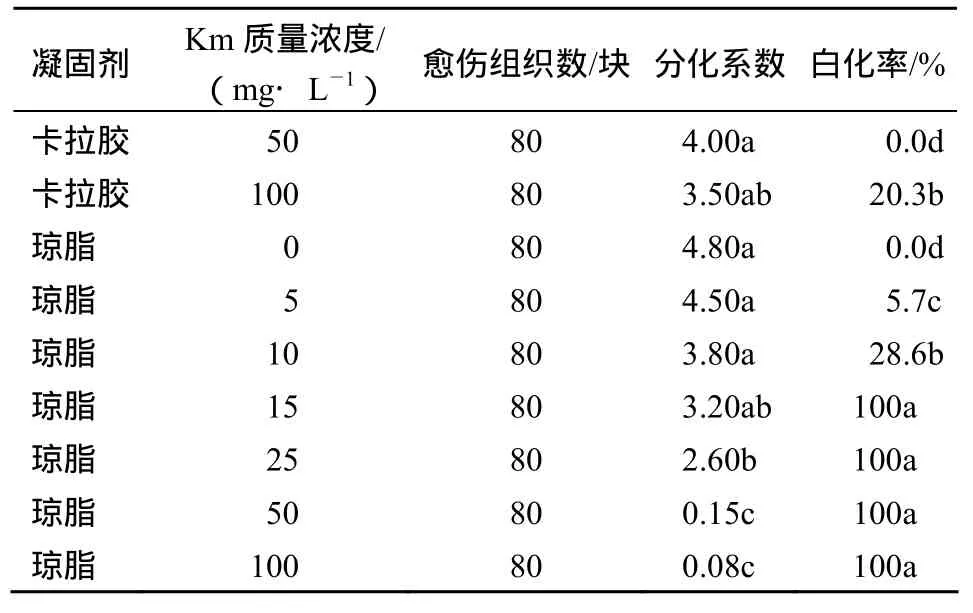
表1 Km对菠萝愈伤组织不定芽分化的影响Table 1 Influence of Km on adventitious shoots differentiation of pineapple callus
Km对愈伤组织不定芽分化的抑制作用随质量浓度的升高而加大,当Km质量浓度为50 mg/L时不定芽分化已基本被抑制(表1).为了保证较高的分化率和减少假阳性植株,增强选择培养时的筛选效果,将初次选择转化体时的Km质量浓度确定为20 mg/L;从第2轮开始,随着转化芽的长大,将选择培养基中Km质量浓度加大至30~50 mg/L.试验中还发现,菠萝不定芽对Km的耐受性随培养基凝固剂的不同而异,在成分相同的培养基中,用卡拉胶作培养基凝固剂时,即使Km质量浓度达50 mg/L,愈伤组织所分化的不定芽也都生长正常,绿芽率达100%,Km发挥不出选择作用(表1).
2.2 转化植株的获得
分4批转化了2 090块愈伤组织,经过连续3轮的选择,获得了97株抗Km植株(图2).由表2不同批次转化体的选择情况可知,不同批次间的转化率差异比较大,第3轮选择后的最终转化率(累积选择率)为 0.12%~2.69%,表现出较大的随机性(图2-a、图 2-b).

图2 CYP1A1菠萝转化体的选择Fig.2 Selection of pineapple CYP1A1 transformants
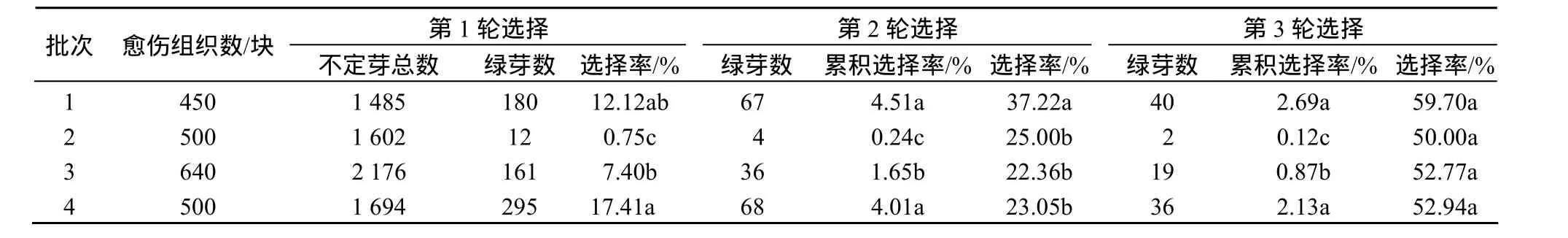
表2 不同批次的转化体选择情况Table 2 Transformants selection of different groups
第1轮选择培养时,不定芽分化系数一般在3以上,不定芽高1~5 mm,具2~5枚肉眼可辨别的叶片,绿芽(Km抗性芽)率 0.75%~17.41%,其Km抗性芽率差异极显著.一些较大的不定芽(高度 4 mm 以上)中绿芽所占比例较高,较小的不定芽(高度2 mm以下)绿芽数极少,这可能是较大的不定芽在农杆菌侵染之前就已形成芽原基,对Km抗性较强,并非真正的转化芽,而较小的不定芽是农杆菌侵染之后2~3周形成的,所以,绿芽数少.为消除侵染时受体材料造成的这种误差,在第 2、3轮选择培养继代时采取了如下3项措施:一是将第1轮选择得到的绿芽叶全部切除,只保留茎尖,使其在选择过程中重新萌发新叶;其次是使用不定芽生长培养基(不含BA),防止不定芽继续分化,以减少分化对选择过程的干扰;第三是提高Km质量浓度至30 mg/L,以加大选择压力.这样,在第2轮选择培养结束后,第1轮中的大部分假阳性植株因还原为白色植株而被清除掉,淘汰率 63%~78%;第 3轮选择时选择率已在50%以上,此时各批次之间的差异已不显著.
第3轮选择培养结束后,将抗性芽转移至生根培养基中,当培养至植株具 8枚以上长度约 3 cm的叶、5条以上长度大于1 cm的根时,即可进行炼苗移栽.移栽后转化苗能正常生长(图2-c),但不同植株之间长势差异较大.
2.3 Km抗性植株的分子检测
分别从7个独立转化批次中随机抽取2株Km抗性植株,用CYP1A1特异引物对其基因组DNA进行PCR扩增,所取的14 株Km抗性中有9株扩增出了目的片段,分别是图3-a中的第1、2、3、5、6、9、11、13、14号株,PCR阳性率达64.29%.对6株PCR阳性植株进行了Southern杂交分析,结果表明,其中只有1株(4号)与野生型植株(阴性对照)一样无杂交信号,为假阳性植株,其他5株(1、2、3、5、6号)PCR阳性植株获得了与重组质粒(阳性对照)大小相同的杂交信号,表明为转基因植株(图3-b).
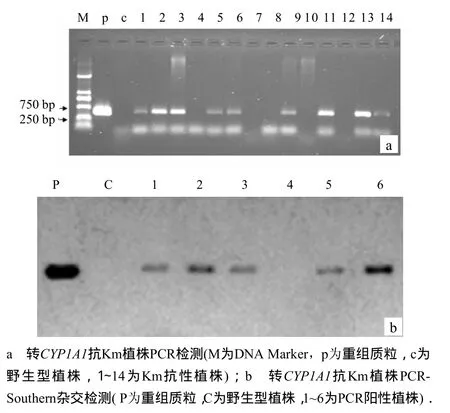
图3 CYP1A1菠萝转化体的分子生物学鉴定Fig.3 Detection in molecular biology of pineapple CYP1A1 transformants
3 结论与讨论
将预培养2 d后菠萝愈伤组织经含植物表达重组质粒(pUHA1-CYP1A1)的根癌农杆菌(LBA4404菌株)侵染后,在含有100 μmol/L AS的琼脂上共培养3 d,转入选择培养基(MS+3.0 mg/L BA+2.0 mg/L NAA+20 mg/L Km+400 mg/L Carb+8 g/L agar)上选择培养;将得到的绿色不定芽转入 MS+2.0 mg/L NAA+30 mg/L Km+300 mg/L Carb+8 g/L agar上再进行连续2轮选择,除去其中的假抗性芽;最后将绿芽转入 MS+1.0 mg/L IBA+30 mg/L Km+8 g/L agar上生根,共获得95株Km抗性植株,最高转化率可达2.69%.对其中部分抗Km植株进行PCR检测,PCR阳性植株率达64.29%.经 Southern杂交,进一步证实 CYP1A1基因已整合到菠萝基因中.以琼脂为培养基凝固剂、共培养基中添加AS、增加选择次数和逐渐增加新一轮选择培养基中的Km质量浓度等是根癌农杆菌介导菠萝愈伤组织获得转基因植株的重要条件.
npt-Ⅱ是植物遗传转化中常用的选择标记基因,其表达产物氨基糖苷磷酸转移酶(NPT-Ⅱ)通过酶促磷酸化使氨基葡萄糖苷类抗生素失活,因而含有npt-Ⅱ的转基因植株具有抗Km或新霉素等氨基葡萄糖苷类抗生素能力,但通常认为npt-Ⅱ对豆科植物和单子叶植物的转化选择效果不佳[7].有学者认为npt-Ⅱ是菠萝适宜的选择标记基因,但Km不是合适的筛选抗生素[8].本研究结果表明,在以琼脂作凝固剂时,菠萝对Km敏感,愈伤组织在含有15 mg/L Km的分化培养基上产生的不定芽全部白化,当Km质量浓度超过50 mg/L时很难分化出不定芽;用卡拉胶作为凝固剂时,50 mg/L Km还不会出现白化苗,甚至100 mg/L Km也只有约20%不定芽白化.其原因可能是卡拉胶中某些组分固定或破坏了Km,使其毒性大为降低.另外,因对Km耐受能力与芽体大小成正比,从第2轮选择开始应提高培养基中Km的浓度.
菠萝愈伤组织一旦转入不定芽选择分化培养基中,便会不断分化产生不定芽而严重干扰Km抗性芽的选择过程,因此,在选择培养继代过程中,应仔细挑选抗 Km的绿芽,并除去其基部愈伤组织.另外,在抗性芽增殖过程中发现,在所增殖出的新不定芽中,仍有较高比例的白化芽(非抗性芽)产生,这表明以愈伤组织为转基因受体,经器官发生途经所得到的转化植株可能是由转基因细胞和非转基因细胞组成的转基因嵌合体植株,因此,笔者拟对以胚性细胞为受体,经体细胞胚再生途径获得均质转基因植株的可能性进行研究.
[1]Inui H,Kodama T,Ohkawa Y,et al.Herbicide metabolism and cross-tolerance in transgenic potato plants co-expessing human CYP1A1,CYP2B6 and CYP2C19[J].Pesticide Biochemistry and Physiology,2000,66:116-129.
[2]Sripaoraya S,Marchat R,Power J B.Plant regeneration by somatic embryogenesis and organogenesis in commercial pineapple(Ananas comosus L.)[J].In Vitro Cell Dev Biol-Plant,2003,39:450-455.
[3]Ko H L,Campbell P R.The introduction of transgenes to control blackheart in pineapple(Ananas comosus L.cv.Smooth Cayenne)by microprojectile bombardment[J].Euphytica,2006,150:387-395.
[4]何业华,罗吉,吴会桃,等.菠萝叶基愈伤组织诱导体细胞胚[J].果树学报,2007,24(1):59-63.
[5]何业华,熊兴华,林顺权,等.根癌农杆菌介导反义ACC合成酶基因对枣树的转化研究[J].湖南农业大学学报:自然科学版,2004,30(1):355-360.
[6]Joseph S,Rusell D W.分子克隆实验指南[M].3版.北京: 科学出版社,2002:487-510.
[7]王关林,方宏筠.植物基因工程[M].北京:科学出版社,2003:61-110.
[8]Michael Graham,Lien Ko,Vanessa Hardy.The development of blackheart resistant pineapples through genetic engineering[J].Acta Hort,2000,529:133-136.
