大孔树脂对刺葡萄籽中原花青素的纯化
2010-06-08王辉宪马玉美罗启枚谢聃刘东波熊兴耀
王辉宪,马玉美,罗启枚,谢聃,刘东波, 熊兴耀*
(湖南农业大学a.理学院;b.园艺园林学院,湖南 长沙 410128)
原花青素(procyanidins,简称PC)是植物中广泛存在的一类属于双黄酮衍生物的天然多酚化合物,有人将其归为生物类黄酮[1-2],也有人将其归为缩合鞣质[3].这类化合物由不同数量的儿茶素或表儿茶素结合而成,最简单的是儿茶素、表儿茶素或儿茶素与表儿茶素形成的二聚体,此外还有三聚体、四聚体等直至十聚体.原花青素具有极强的抗氧化特性,一般存在于植物的果实、种子、花和皮中,在葡萄、山楂、花生、银杏、白桦树、松树等植物中的含量都很丰富[4].在原花青素各种不同聚合体中以二聚体B2的抗氧化能力最强.原花青素具有多种生物活性,能防治多种疾病,具有高效、低毒、高生物利用率等特点,在植物中的主要作用是保护植物中易被氧化的成分,在人体内的抗氧化和清除自由基的能力是V-E的50倍、V-C的20倍[5-6],并且还具有保护心血管、预防高血压、抗肿瘤、抗辐射、抗突变及美容等作用[7].中国葡萄资源丰富,每年用于酿造酒和其他饮料的鲜葡萄超过10万t,每年生产葡萄酒后的废渣中就有(400~600)万kg的葡萄籽[8].葡萄籽中含有大量的原花青素,因此充分利用好酿酒后的葡萄籽资源,不仅物尽其用,而且还会带来巨大的经济效益.笔者研究大孔树脂分离纯化葡萄籽原花青素的方法和工艺,旨在为刺葡萄的综合利用提供理论依据.
1 材料和方法
1.1 材料、仪器与试剂
以湖南怀化市芷江地区出产的高山刺葡萄籽为试材;原花青素B2标准品购自SEGMA公司;原花青素标准品(≥95%)购自天津市尖峰天然产物研究开发有限公司(探索试验条件所用原花青素为80%的低聚原花青素产品);8种大孔树脂(表1)均为乳白色不透明球状颗粒,购自沧州远威化工有限公司和沧州宝恩化工有限公司.
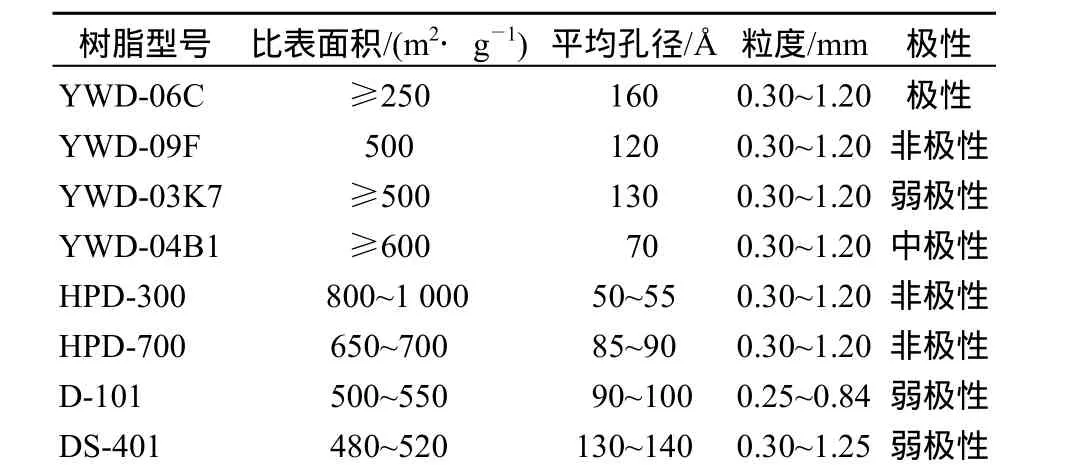
表1 8种树脂的性能参数Table 1 Capability parameter of 8 macroporous resins
主要仪器为组合恒温磁力搅拌器、RE-52AA旋转蒸发仪(上海亚荣生化仪器厂)、SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司)、DLSB-5/10型低温冷却液循环泵(郑州长城科工贸有限公司)、D2-2BC型真空干燥箱(天津泰斯特仪器有限公司)、ES-1100电子天平(长沙湘平科技发展有限公司)、VIS-7220紫外分光光度计(北京瑞利分析仪器厂)和玻璃层析柱.
主要试剂乙醇(95%)、乙酸乙酯、正丁醇、浓盐酸、NH4Fe(SO4)2、NaCl均为分析纯;甲醇为色谱纯.
1.2 方 法
1.2.1 葡萄籽中原花青素的提取与初步分离
将1 kg刺葡萄籽粉碎,用超临界CO2法提取葡萄籽油脱脂[9-10]后,用 5%NaCl水溶液以 1∶5的料液比搅拌1 h去蛋白质,然后进行原花青素的提取[11].提取液为 70%的乙醇溶液,料液比 1∶7,温度60 ℃,提取时间2 h.提取2次.将上述原花青素的提取液减压蒸馏(45 ℃)至无醇,离心分离,上清液用4倍体积的乙酸乙酯分6次萃取,合并乙酸乙酯萃取液,减压蒸馏(≤35 ℃)至有少量沉淀析出后置于真空干燥箱干燥(≤30 ℃)2 h,得低聚原花青素粗产品,备用.
1.2.2 提取物中原花青素含量的测定
在文献[12-13]的基础上,对铁盐浓度和浓盐酸-正丁醇的比例进行改进后,测定提取物中原花青素的含量.
1.2.3 大孔树脂的预处理
取8种型号的大孔树脂用无水乙醇浸泡24 h,湿法装柱,用无水乙醇冲至无浑浊,用蒸馏水洗至无醇味.经酸、碱处理后用蒸馏水洗至中性[14-15].
1.2.4 树脂静态吸附与解吸试验
(1)静态吸附试验.分别准确称取0.500 0 g预处理过的8种大孔树脂于锥形瓶中,分别加入5 mL无水乙醇使树脂充分涨溶,再分别加入50 mL原花青素水溶液(原花青素含量为0.4 mg/mL),封口,置于25 ℃水浴摇床中振摇24 h,测定溶液吸光度,检测树脂的吸附量.
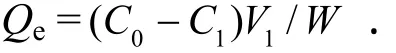
Qe为树脂吸附量(mg/g);C0为吸附前溶液中原花青素的质量浓度(mg/mL);C1为吸附后溶液中原花青素的质量浓度(mg/mL);V1为溶液体积(mL);W为树脂干重(g).
(2)静态解吸试验.将上述充分吸附后的原花青素水溶液进行过滤,去除水液,再将其置于锥形瓶中,各加入50%的乙醇水溶液50 mL,封口,置于25 ℃水浴摇床中振摇24 h,检测树脂的解吸率,并根据静态吸附和静态解析试验确定最佳树脂.
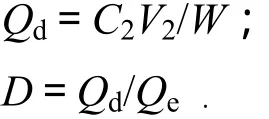
Qd为解析量(mg/g);C2为解析液中原花青素的质量浓度(mg/mL); V2为解析液体积(mL);D为解析率.
1.2.5 吸附、解吸条件的确定
(1)吸附条件的确定.取0.500 0 g预处理过的所选最佳树脂,加入0.4 mg/mL原花青素水溶液50 mL,以吸附时间、吸附温度和供试液pH值设计L16(43)正交试验,用盐酸-正丁醇法测定吸附完全后原花青素溶液的吸光度,考察吸附条件对树脂吸附性能的影响,确定最佳吸附条件.
(2)解吸条件的确定.取0.500 0 g所选最佳树脂,加入0.4 mg/mL原花青素水溶液50 mL,在相同条件下吸附饱和后,滤去水溶液,以乙醇水溶液浓度、pH值、洗脱时间及洗脱温度设计L16(44)正交试验,用盐酸-正丁醇法测定解吸完全后原花青素溶液的吸光度,考察洗脱条件对解吸效果的影响,确定最佳解吸条件.
1.2.6 树脂动态吸附试验
(1)上柱速率对吸附量的影响.分别取一定量处理过的所选树脂湿法装柱,以0.4 mg/mL原花青素溶液上柱,调节不同上柱速率,收集流出液.每收集10 mL流出液用盐酸-正丁醇法测量1次其中原花青素的含量,考察上柱速率2、4、6 BV/h对树脂吸附性能的影响.
(2)洗脱速率对洗脱解吸率的影响.分别取一定量处理过的所选树脂湿法装柱,给定相同的上柱条件,按最佳吸附条件进行吸附,使其饱和,以不同的洗脱速率洗脱,考察洗脱速率 1、2、3 BV/h对洗脱效果的影响.
通过上述试验,确定所选树脂对原花青素吸附分离的最佳工艺条件.
1.2.7 刺葡萄籽低聚原花青素的纯化
将溶剂浸提所得低聚原花青素粗提物溶于蒸馏水中,以上述试验所选定的树脂为吸附剂,上柱吸附至饱和,然后以60%乙醇水溶液按最佳工艺条件进行洗脱,每10 mL收集1次洗脱液,用盐酸-正丁醇法测定洗脱液中原花青素的含量.
1.2.8 纯化物中B2含量的测定
准确称取0.001 0 g原花青素二聚体B2标准品,用甲醇(GR)定容至10 mL,得质量浓度为0.1 mg/mL的B2标准液,稀释,配制成质量浓度为15、30、45、60、75 μg/mL的原花青素二聚体B2系列标准溶液.通过HPLC法测定原花青素二聚体B2标准曲线.测定条件:流动相甲醇与水的体积比为24∶76,并经 0.45 μm 滤膜过滤,脱气;流速 0.8 mL/min;检测波长280 nm;进样量20 μL.在相同条件下测定1.2.1方法所得低聚原花青素粗产品(质量浓度为 0.1 mg/mL)和经大孔树脂纯化后纯化物(原花青素质量浓度为120 μg /mL)中B2的峰面积,计算B2的含量.
2 结果与分析
2.1 刺葡萄籽中原花青素的初步提取与分离结果
将处理过的 1 kg刺葡萄籽在最佳提取条件下进行提取,乙酸乙酯萃取后得到低聚粗产品 4.608 g,正丁醇萃取后得高聚粗产品4.251 g,产品总质量为8.859 g,得率为0.89%.
2.2 原花青素标准品的标准曲线
以盐酸-正丁醇法测定原花青素标准品的标准曲线方程为y =0.859 7x + 0.011 3,R2=0.999 2,式中y为吸光度,x为溶液中原花青素的质量浓度(mg/mL).
2.3 树脂静态吸附试验结果
2.3.1 树脂的筛选
原花青素具有多酚键和糖苷键,有一定的极性和亲水性,生成氢键的能力较强,有利于极性和弱极性的树脂吸附,但吸附能力太强不利于解吸.由表2可见,所用树脂吸附效果最好的是HPD- 300,其次是 HPD-700、YWD-03K7、YWD-04B1和YWD-06C,几种树脂的吸附能力相差不大,其中HPD-700和YWD-03K7树脂的吸附能力完全相同.

表2 大孔树脂的静态吸附情况Table 2 Static adsorption of the resin
由表3可见,解吸率最高的树脂是YWD-06C,其次是D-101、YWD-09F和HPD-700,因此,综合考虑,选取YWD-06C为最佳树脂.
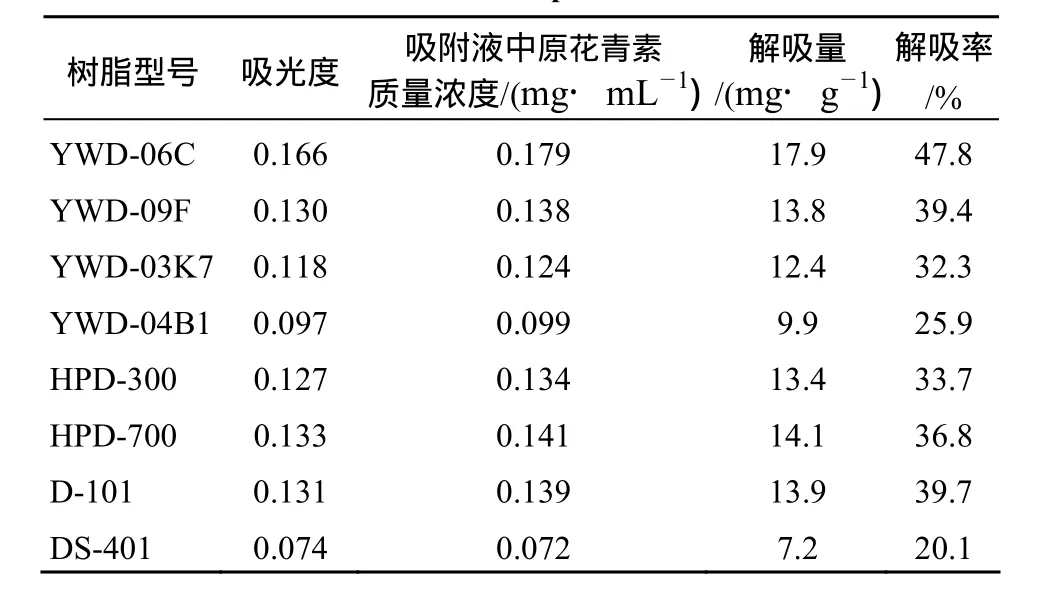
表3 大孔树脂的静态解吸情况Table 3 Static desorption of the resin
2.3.2 吸附条件正交试验结果
吸附后测得溶液的吸光度越小,吸附效果越好.由表4可知,在吸附过程中各因素对吸附效果的影响都较大,其中吸附时间的影响最大.时间太短,吸附不完全;时间太长,可能会使原花青素在树脂中重新解吸出来.50 ℃时吸光度较大可能是原花青素在较高温度下发生分解生成色素所致.最佳吸附条件为吸附温度20 ℃,吸附时间6 h,溶液pH 4.
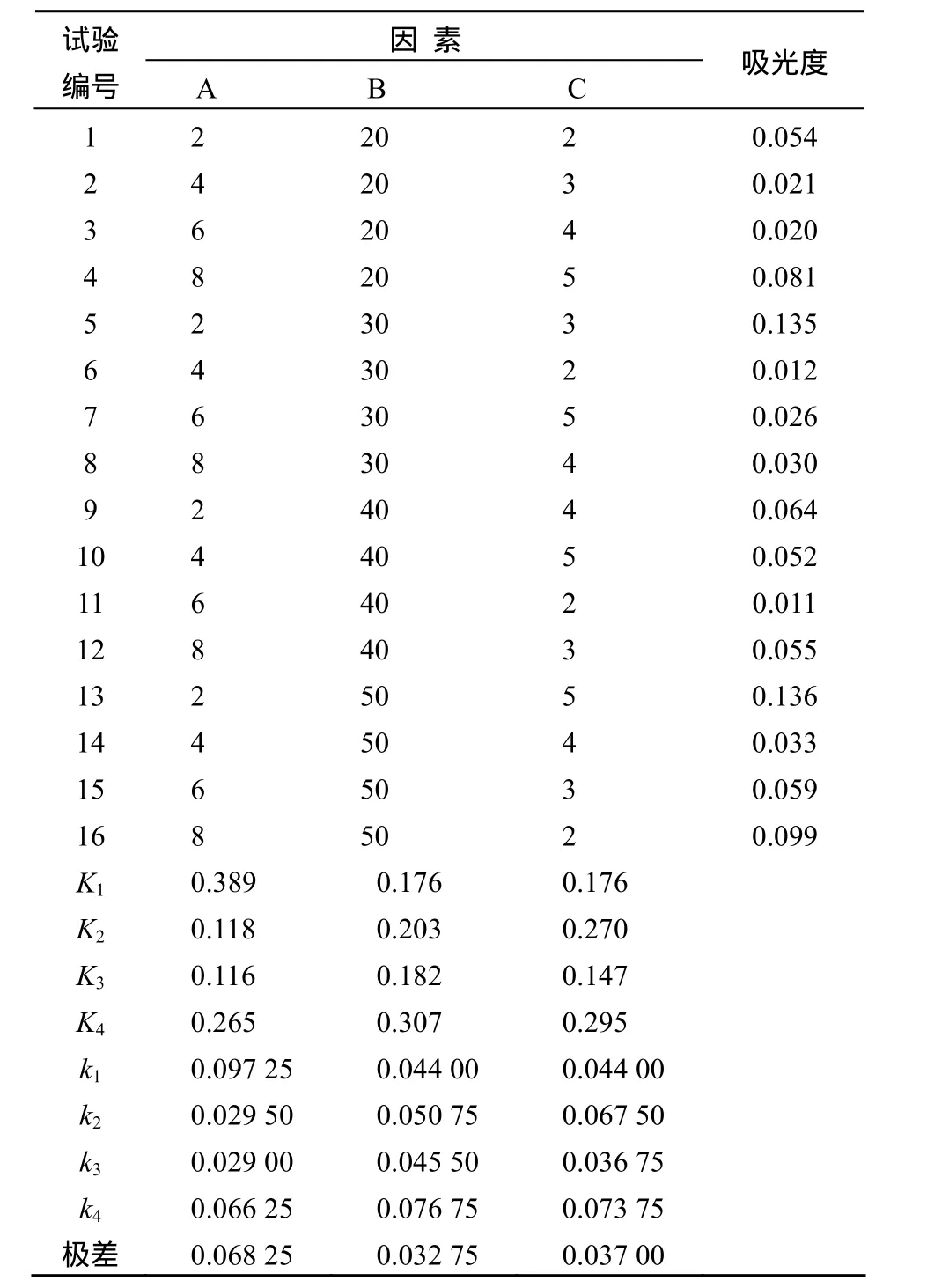
表4 吸附条件正交试验结果Table 4 The orthogonal analysis of adsorption
2.3.3 解吸条件正交试验结果
由表5可知,解吸时间对解吸效果影响最大,这是由于时间太短,解吸不完全;时间太长,可能会使解吸出来的原花青素重新吸附到树脂上.其他3个因素对解吸效果的影响基本相同.最佳解吸条件:解吸液为60%的乙醇水溶液,pH 4,解吸时间6 h,解吸温度25 ℃.
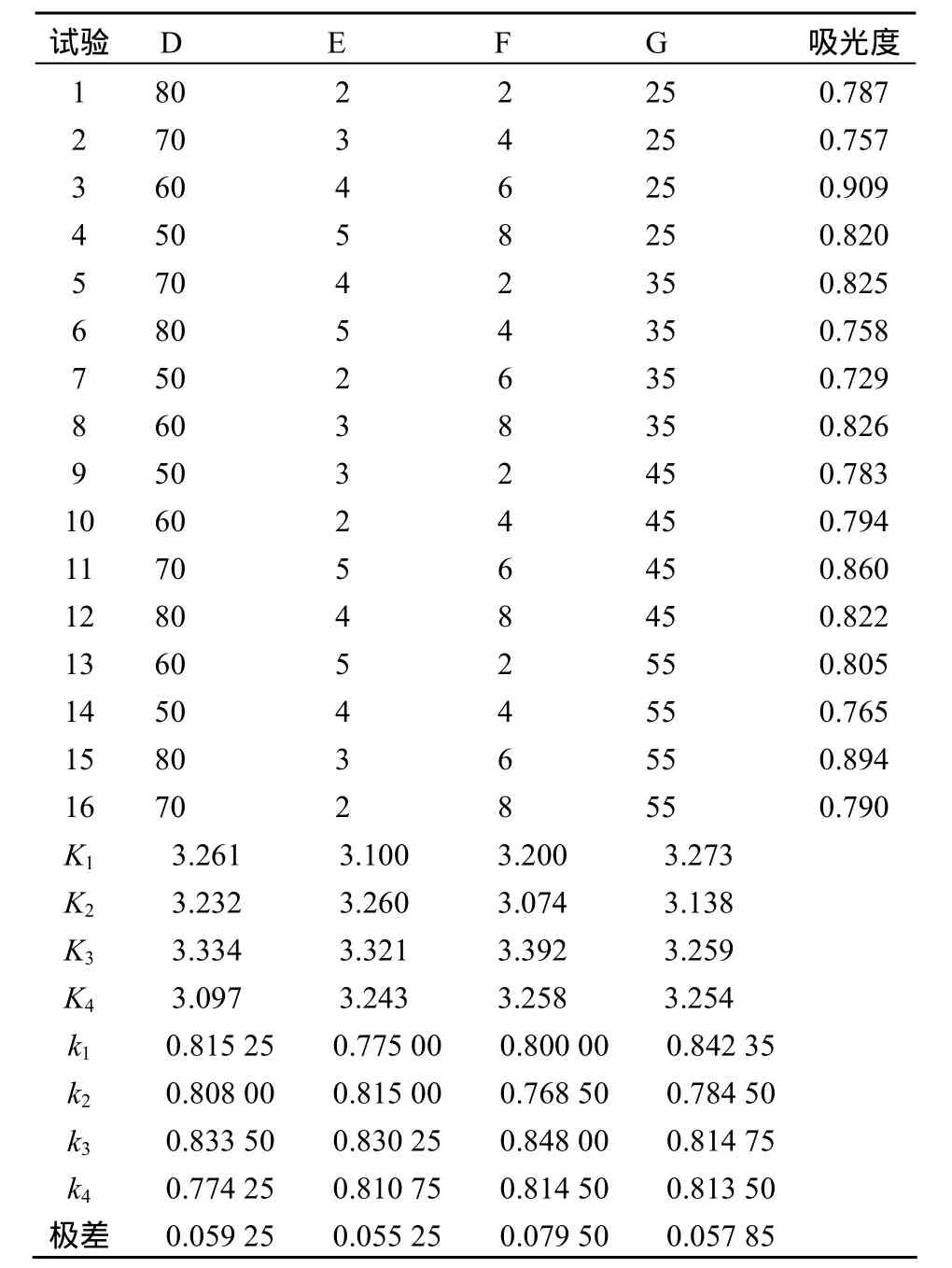
表5 解吸条件正交试验结果Table 5 The orthogonal analysis of adsorption
2.4 树脂动态吸附试验结果
2.4.1 吸附流速对吸附量的影响
以流出液体积为横坐标,以流出液中原花青素质量浓度为纵坐标,得上柱速率对吸附量影响的关系曲线(图1).由图1可知,当流速为2 BV/h时,树脂对原花青素的吸附比较完全,但由于流速太慢,使得操作时间过长;当流速为6 BV/h时,由于流速过快,原花青素还未被树脂完全吸附就随洗脱液流出,造成原花青素的浪费,因此选取 4 BV/h为最佳吸附流速.
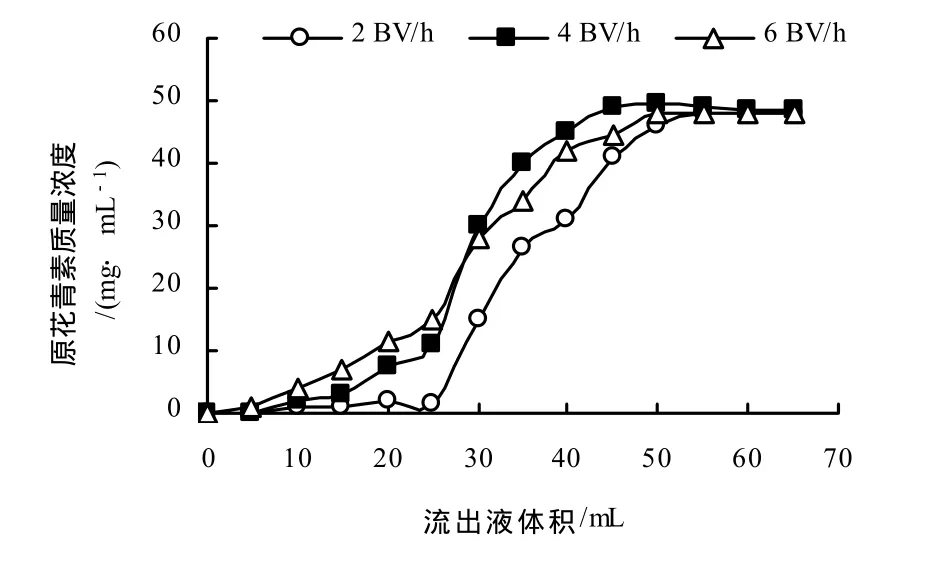
图1 不同吸附流速下树脂对原花青素的吸附Fig.1 Adsorption of different flowing velocity
2.4.2 洗脱速率对吸附量的影响
根据经验[16],洗脱速率一般为吸附速率的1/2,故笔者考察1、2、3 BV/h 3个洗脱速率对吸附量的的影响.以流出液体积为横坐标,流出液中原花青素质量浓度为纵坐标,得不同流速下树脂对原花青素的解吸曲线(图2).由图2可见,洗脱速率越小,洗脱越完全;1 BV/h时虽然洗脱效果较好,但由于流速过慢,使得操作时间过长;流速为2 BV/h时,洗脱曲线集中,对称,无明显拖尾现象;流速为 3 BV/h时,流速较快,洗脱不完全,拖尾现象严重,所以,选取2 BV/h为最佳流速.
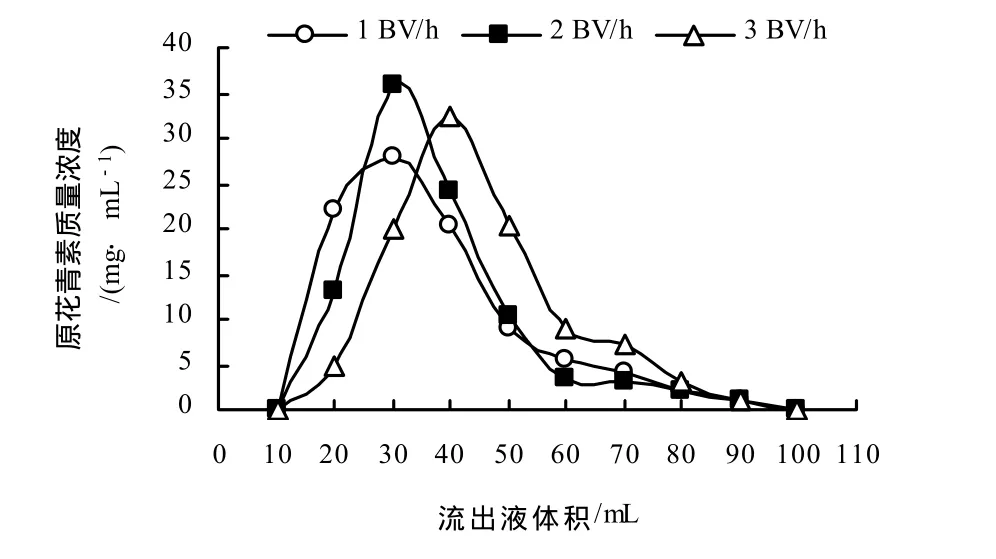
图2 不同洗脱速率下树脂对原花青素的吸附Fig.2 Desorption curve of different flowing velocity
2.5 刺葡萄籽低聚原花青素的纯化
根据静态试验和动态试验确定的吸附、解吸条件,对用溶剂法提取的低聚原花青素粗提物进行纯化,用盐酸-正丁醇法测定洗脱液中原花青素的含量,结果表明,原花青素主要集中在第3组洗脱液,即20~30 mL阶段,此阶段洗脱液中原花青素含量达到92.57%.
2.6 纯化物中原花青素B2的含量
按1.2.8色谱条件,用HPLC法分别得到原花青素B2标准品与纯化物的色谱图(图3、图4).

图3 原花青素B2标准品的HPLC图Fig.3 HPLC spectrum of B2 standard product

图4 原花青素纯化物的HPLC图Fig.4 HPLC spectrum of purified proanthocyanidins
根据试验结果,得刺葡萄籽低聚原花青素纯化物中二聚体B2峰面积与质量浓度的线性回归方程由刺葡萄籽低聚原花青素纯化物中二聚体B2峰面积与质量浓度的标准曲线可得刺葡萄籽低聚原花青素纯化物中二聚体B2的质量浓度为40.17 μg/mL,计算可得二聚体B2含量为33.5%.同样方法可测得溶剂法粗提所得低聚原花青素中二聚体B2的含量为9.19%.
3 结论与讨论
利用大孔吸附树脂对溶剂法所得刺葡萄籽低聚原花青素粗产品进行纯化.通过静态试验选择出YWD-06C树脂为最佳吸附剂,并通过正交试验确定了最佳吸附条件:吸附温度20 ℃,吸附时间6 h,溶液pH值为4;最佳解吸条件:解吸液为60%的乙醇水溶液,pH值为4,解吸时间6 h,解吸温度25 ℃;通过动态试验确定吸附速率为4 BV/h,洗脱速率为2 BV/h.刺葡萄籽低聚原花青素粗提物经YWD-06C树脂纯化后,收集20~30 mL阶段洗脱液,用盐酸-正丁醇法测得其中原花青素含量达92.57%.用本方法纯化刺葡萄籽低聚原花青素,不仅可以去除提取物中大部分杂质,提高原花青素的含量,而且可以富集原花青素纯化物中的二聚体B2,葡萄籽低聚原花青素产品中B2含量的提高,将大大提高产品的抗氧化能力和药用价值,也将大大提高产品的经济价值,因此,本纯化工艺对于葡萄籽的综合利用、对于提高葡萄籽低聚原花青素产品的品质、对于提升刺葡萄深加工的价值具有非常好的应用前景.
[1]王宪楷.天然药物化学[M].北京:人民卫生出版社,1985.
[2]吕丽爽,曹栋. 薄层色谱法分离葡萄籽中的低聚原花青素[J].无锡轻工大学学报,2001,20(1):65-67.
[3]北京医学院.中草药成分化学[M].北京:人民卫生出版社,1980.
[4]王辉宪,姜晖霞,王仁才,等.葡萄子油及原花青素研究与开发利用[J].果树学报,2005,22(5):542-547.
[5]王洪新,汤坚,吴晓燕,等.葡萄籽中抗氧化剂的精制及抗氧活性的测定[J].中国油脂,1990,15(4):9-14.
[6]万本屹,李宏,董海洲.葡萄籽原花青素提取及其应用研究进展[J].粮食与油脂,2002(2):43-45.
[7]向阳,马龙,苏德奇.比色法测定葡萄皮和葡萄籽中原花青素的含量[J].中国公共卫生,2003,19(10):1228-1229 .
[8]姚方耀.葡萄籽中葡萄籽油和原花青素的提取分离工艺研究[D].天津大学化工学院,2004.
[9]熊兴耀 欧阳建文.超临界CO2萃取刺葡萄籽油及其成分分析[J].湖南农业大学学报:自然科学版,2006,32(4):436-438.
[10]王仁才,欧阳建文.超临界流体萃取技术在果实功效成分提取中的应用[J].湖南农业大学学报:自然科学版,2006,32(2):225-228
[11]舒小艳.葡萄籽中原花青素的提取与分离纯化的研究[D].长沙:湖南农业大学理学院,2005.
[12]傅武胜,蔡一新,林丽玉,等.铁盐催化比色法测定葡萄籽提取物中的原花青素[J].食品与发酵工业,2001,27(10):57-61.
[13]孙丽华,江月仙,王巧懿.铁盐催化比色法测定丽诺养颜片中原花青素含量[J].广州食品工业科技,2004,20(2):117-118.
[14]徐晓云,潘思轶,谢笔钧,等.树脂法精制沙棘籽原花色素的研究[J].农业工程学报,2005,21(1):152-154.
[15]向海燕,周春山,杜邵龙.大孔吸附树脂法分离纯化虎帐中白藜芦醇的研究[J].中草药,2005,32(6):207-210.
[16]郑永丽.葡萄籽中原花色素的分析、提取与纯化[D].天津:河北工业大学化工学院,2004.
