永生化人肝细胞治疗小鼠急性肝衰竭的实验研究
2010-06-08房青高福云徐梅张文健叶丽亚许世清许亚平李成辉娄晋宁
房青,高福云,徐梅,张文健,叶丽亚,许世清,许亚平,李成辉,娄晋宁
急性肝衰竭(acute liver failure,ALF)是病毒性肝炎一种危重的临床综合征,由于起病急,疗效差,患者生存率不足 20%[1]。虽然肝移植是 ALF有效的治疗措施,但由于肝供体的严重缺乏,大多数患者在等待供体过程中死亡。生物人工肝支持系统(bioartificial liver support system,BALSS)被认为是未来最有希望在体外提供全面肝功能支持的有效治疗方法[2]。
BALSS 的关键生物材料是肝细胞。虽然,新鲜分离的猪肝细胞和人的肝细胞瘤细胞都曾经被应用作为生物人工肝的细胞材料,但由于这些细胞存在过敏反应、病毒感染和诱发肿瘤等不安全因素,其临床治疗应用受到很大限制。因此,建立一种永生化人肝细胞系对 BALSS 的建立具有非常重要的意义[3-4]。
我们应用 SV40 Tag 和端粒酶转染原代人肝细胞,并通过单细胞克隆筛选建立了永生化人肝细胞系(immortalized human hepatocytes,IHH)。前期的研究表明,IHH 表现高增殖活性,可在微载体上高密度培养,体内不具有成瘤性。体外分析表明:IHH 具有正常肝细胞的主要功能特性,表达与肝脏解毒、代谢、合成和生物转化相关的基因和蛋白。将 IHH 与重症肝衰竭患者血清孵育后,可使血清胆红素进行性地降低,血清尿素氮(BUN)浓度进行性升高,表明我们建立的 IHH 具有对胆红素和血氨的解毒功能[5]。在本研究中,应用微载体培养的 IHH,注射到 ALF 小鼠的腹腔内,进行腹膜透析治疗,评价其对 ALF 小鼠的治疗作用,以评价IHH 对 ALF 鼠提供肝功能支持的有效性,为利用IHH 构建人源化生物人工肝提供实验依据。
1 材料与方法
1.1 主要材料
1.1.1 试剂 cytoporeTM2 微载体购自瑞典 GE Healthcare 公司;活细胞计数试剂盒 CCK-8 购自日本 Dojindo 公司;小鼠抗人 α1-抗胰蛋白酶(α1-antitrypsin,α1-AT)抗体购自美国 Sigma 公司。
1.1.2 实验动物 BALB/c 裸鼠,雄性,SPF 级,6~8 周龄,体重 18~22 g,由北京维通利华实验动物技术有限公司提供。
1.2 方法
1.2.1 IHH 细胞的微载体培养 1 g cytoporeTM2微载体用 100 ml PBS(pH 7.4)水化,120℃高压消毒 20min,PBS 洗 2 次,含 20%胎牛血清的肝细胞培养基浸泡过夜。每毫升微载体接种 105个对数生长期 IHH,最初 6 h 内每隔 30min 轻柔摇动,细胞贴附微载体后每隔 3 d 更换新鲜肝细胞培养基。微载体上 IHH Giemsa 染色光镜下观察并拍照。IHH 接种微载体后每隔 5 d,取 0.1 ml 微载体,加入含 10%CCK-8 的肝细胞培养液,设5 个平行样,37℃孵育 3 h,上清用酶标仪测定450 nm 吸光度,绘制生长曲线。
1.2.2 裸鼠急性肝衰竭模型的制备 45 只裸鼠腹腔注射 CCl4诱导急性肝衰竭,用橄榄油将 CCl4稀释成 20%的溶液,分 2 次腹腔注射,剂量分别为15 和 5 μl/g 体重,间隔 24 h。第2 次腹腔注射 CCl4后,所有裸鼠均在 24~48 h 内死亡,肝组织病理发现明显肝细胞坏死。
1.2.3 IHH-微载体透析治疗 急性肝衰竭模型制备成功后,裸鼠随机分为3 组,每组 15 只。⑴未治疗组:未给予任何治疗;⑵空微载体组:在第2 次 CCl4注射后 6 h,给予 2 ml 空微载体腹腔注射;⑶IHH 治疗组:在第2 次 CCl4注射后 6 h,给予 2 ml 培养 IHH 的微载体(5×106/ml)腹腔注射。各组动物在第2 次注射 CCl4后 24 h,取血检测谷丙转氨酶 ALT,取肝脏做病理学和免疫组化分析,各组剩余动物每天记录生存率,连续 14 d。
1.2.4 肝脏病理及免疫组化分析 取各组动物肝脏组织,多聚甲醛固定,石蜡包埋切片,常规 HE 染色,显微镜下观察,拍照。免疫组化分析时,各组肝组织切片用 3%H2O2封闭,与小鼠抗人 α1-抗胰蛋白酶(α1-antitrypsin,α1-AT)抗体(稀释至10 μg/ml)在 37℃孵育 1 h,PBS 洗 3 次后与辣根过氧化物酶(HRP)标记羊抗鼠 IgG 在 37℃孵育 30min,PBS 洗 5 次后加入 DAB 显色液显色,显微镜下观察拍照。
1.3 统计学分析
用 SPSS16.0 统计分析软件处理数据,计量资料采用±s表示,多组计量资料的比较采用F检验,以寿命表法计算累计生存率,生存率的比较采用 Kaplan-Meier 法。P<0.05 认为差异有统计学意义。
2 结果
2.1 IHH 的微载体培养
每毫升微载体接种 105个 IHH 后 24 h,几乎所有 IHH 均贴附于微载体,培养约 21 d 后,90%以上微载体上细胞汇合,IHH 可在大孔微载体表面及孔道内高密度生长(图1)。
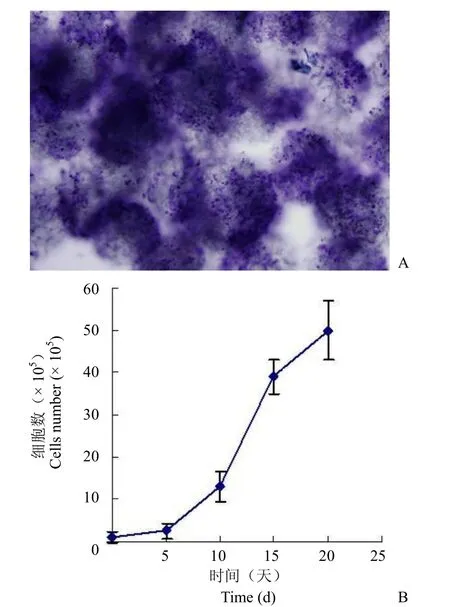
图1 IHH 在微载体 cytoporeTM 2 上培养(A:Giemsa 染色,放大倍数:100 倍;B:微载体培养 IHH 细胞生长曲线)Figure 1 IHH cultured on microcarrier cytoporeTM 2.A:Giemsa staining of IHH (magnification is×100); B: Growth curve of IHH cultured on microcarriers.
2.2 IHH 微载体治疗对 ALF 裸鼠生存率的影响
所有裸鼠在第2 次注射 CCl424 h 后,转氨酶升高至正常值的 10 倍以上,提示肝细胞明显受损(表1)。未治疗组 12 只裸鼠全部于第2 次注射 CCl424 h 后死亡,空微载体组在第2 次注射CCl424 h 后死亡 11 只,另外 1 只也在第2 天死亡。而 IHH 治疗组在第2 次注射 CCl424 h 后死亡 2 只,其余 10 只均存活至实验结束(14 d),生存率为83.3%,与两对照组相比有显著性差异(u= 24.855,P= 0.000,P<0.01)(图2)。
表1 CCl4 诱导的 ALF 裸鼠转氨酶检测结果(IU/L,±s)Table 1 Aminotransferase levels of ALF mice induced by CCl4 (IU/L,±s )
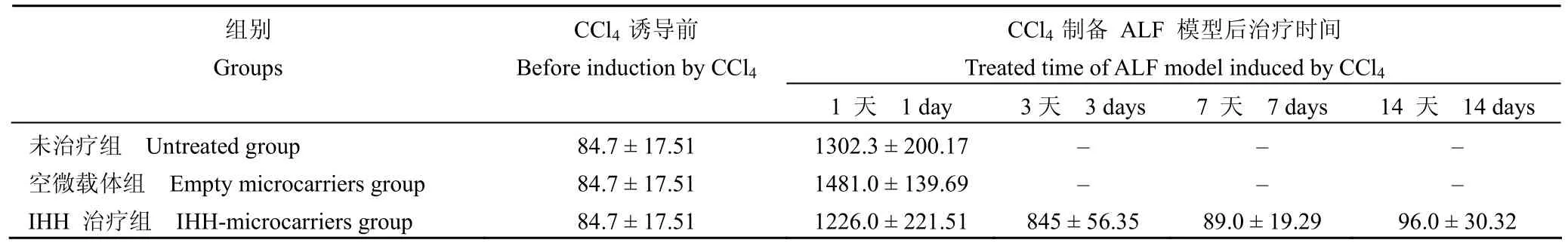
表1 CCl4 诱导的 ALF 裸鼠转氨酶检测结果(IU/L,±s)Table 1 Aminotransferase levels of ALF mice induced by CCl4 (IU/L,±s )
CCl4 制备 ALF 模型后治疗时间Treated time of ALF model induced by CCl4组别Groups CCl4 诱导前Before induction by CCl4 1 天 1 day 3 天 3 days 7 天 7 days 14 天 14 days未治疗组 Untreated group 84.7±17.51 1302.3±200.17 – – –空微载体组 Empty microcarriers group 84.7±17.51 1481.0±139.69 – – –IHH 治疗组 IHH-microcarriers group 84.7±17.51 1226.0±221.51 845±56.35 89.0±19.29 96.0±30.32

图2 CCl4 诱导裸鼠 ALF 的生存曲线Figure 2 Survival curve of ALF mice induced by CCl4
2.3 肝组织病理学分析
肝脏组织切片 HE 染色结果显示,CCl4诱导急性肝衰竭后 1 d,与正常裸鼠肝脏(图3A)相比,未治疗组(图3B)、空微载体组(图3C)和 IHH治疗组(图3D)均可见广泛的肝细胞坏死,坏死区自小叶中央静脉向四周蔓延,仅在肝小叶周边区有少数残余肝细胞,肝窦明显扩张充血。而经 IHH治疗后存活的裸鼠肝脏随着治疗时间的延长,与IHH 组 1 d(图4B)相比,IHH 治疗 7 d(图4C)可见肝细胞坏死逐渐减少,肝索结构逐渐恢复,淤血减轻,IHH 治疗 14 d(图4D)的裸鼠肝脏组织无明显肝细胞坏死,正常肝索结构恢复,未见淤血,已类似正常裸鼠肝脏组织(图4A),IHH 治疗组各个时间点的肝组织切片均可见长有 IHH 的微载体填充了肝细胞的坏死缺损(图4)。
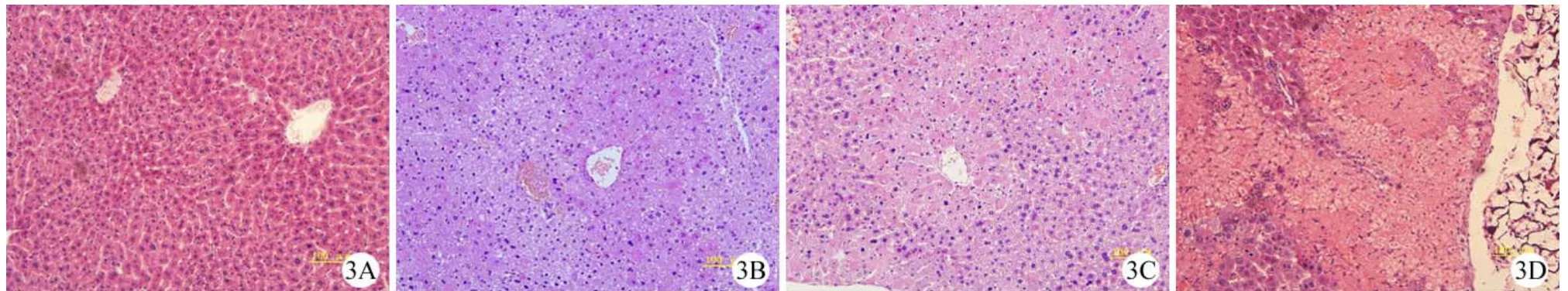
图3 正常及制备 ALF 模型后 1 d 鼠肝脏组织病理学检查(A:正常肝脏;B:未治疗组;C:空微载体组;D:IHH治疗组。HE 染色,放大倍数 200 倍)Figure 3 HE staining of normal liver and liver affected by ALF for 1 day.A: Normal liver; B: Untreated group; C: Empty microcarriers group; D: IHH-microcarriers group, Magnification×200.
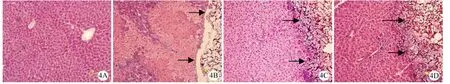
图4 IHH 治疗不同时间 ALF 鼠肝脏组织病理学变化(A:正常组;B:IHH 治疗1 天;C:IHH治疗 7 天;D:IHH 治疗 14 天。HE 染色,放大倍数 200 倍)Figure 4 HE staining of ALF mice liver treated by IHH.A: Normal liver; B: IHH-microcarriers treated for 1 day; C: IHH-microcarriers treated for 7 days; D: IHH-microcarriers treated for 14 days, Magnification×200.
2.4 微载体上 IHH 免疫组化染色检查
图5 显示肝组织切片中 α1-AT 的免疫组化染色结果,空微载体组蛋白染色为阴性(图5A)。IHH 治疗组微载体上细胞可见棕黄色反应产物(图5B),而裸鼠肝细胞和背景无染色。所用的抗体为小鼠抗人 α1-抗胰蛋白酶(α1-AT)抗体,与小鼠的相应抗原无交叉反应。
3 讨论
肝细胞是生物人工肝支持系统的核心成分。理想的肝细胞是决定生物人工肝成功与否的关键。国际消化系统疾病顾问委员会在《暴发性肝衰竭的控制现状》生物人工肝专题中将理想的肝细胞描述为:①人源性、正常(非恶性)表型肝细胞;②能够高活性地准备;③容易快速高密度地培养,且能稳定保持良好的分化状态;④保持大部分成熟肝细胞的合成、解毒及其他特殊功能[6]。
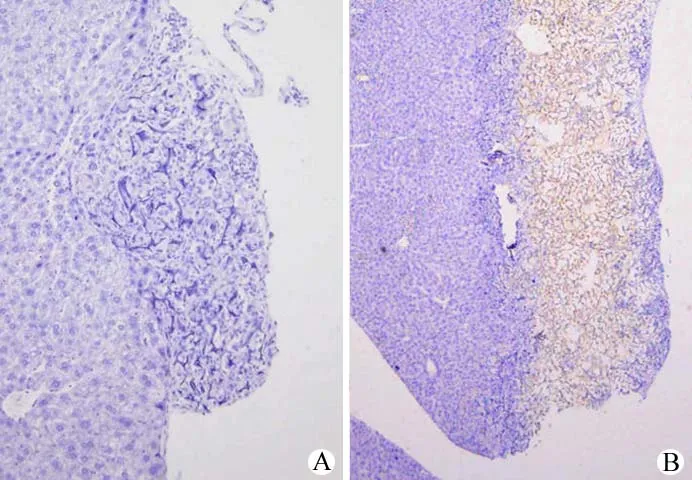
图5 ALF 鼠肝免疫组化分析(A:空微载体;B:IHH 微载体)Figure 5 Immunohistochemical staining for α1-AT.A: The empty microcarriers; B: IHH-microcarriers.
正常成人肝细胞由于来源匮乏,体外不增殖,难以成为生物人工肝的理想细胞。我们通过SV40Tag 和端粒酶催化亚单位 HERT 转染正常成人肝细胞,建立了永生化的人肝细胞系 IHH。生物学特性分析表明,我们建立的 IHH 具备较完备的肝细胞功能,包括表达参与胆红素代谢的酶UGT1、参与氨代谢的酶 GS、参与生物转化的酶GST 及合成凝血因子等。进一步,我们应用 IHH在体外与肝衰竭患者的血清共培养,结果发现血清中的胆红素随共培养时间进行性地降低,而血清尿素随共培养时间进行性地升高,表明这些细胞具有胆红素代谢解毒和转氨的功能。
为了评价 IHH 的体内解毒功能,制备一种适宜的 ALF 动物模型是必要的。Terblanche 和Hickman[7]提出理想的 ALF 模型应该具备以下标准:①具有可逆性:动物对适宜的治疗有反应并可能存活;②具有可重复性:未经治疗,动物有较一致的死亡率;③动物死于肝衰竭本身;④具有治疗窗口期:由肝衰竭到死亡应有足够时间可进行治疗。采用 CCl4制备小鼠 ALF 模型,当剂量过大时由于伴有神经系统和肾脏损伤,动物死亡迅速,治疗窗口期过短;而剂量过小时肝损伤轻微,动物不治疗的死亡率低[8]。我们采用间隔 24 h 两次腹腔注射 CCl4的方法:第1 次给予总剂量的 75%,第2 次给予总剂量的 25%,这样可使肝损伤的程度在死亡的临界值,使微载体肝细胞的移植能够发挥明显的作用,并且两次给药间提供较充分的治疗时间。实验结果表明此方法具有很好的重复性。
由于肝细胞需要贴附于表面恢复极性才能存活和保持功能状态[9]。我们将 IHH 培养于大孔微载体 cytoporeTM2 上。这种微载体表面经过特殊处理,细胞贴附牢固不易脱落,其表面积与体积比大,不易发生接触抑制,有利于 IHH 细胞的高密度培养;由于微载体的孔道直径约为30 μm,肝细胞可进入到微载体孔道内生长增殖,有利于避免液体流动时剪切力对细胞的伤害。
将永生化人肝细胞系 IHH 培养于微载体,对ALF 裸鼠进行腹腔透析治疗,可使 ALF 裸鼠的转氨酶降低至正常水平(表1),并且治疗后 ALF小鼠的存活率显著提高,由两对照组存活率的 0%提高到 83.3%,并持续至长期存活(图2)。肝组织病理检查显示,CCl4诱导 ALF 后,肝组织可见大量肝细胞坏死,坏死区波及整个肝小叶,肝索结构被破坏,肝窦淤血(图3)。经 IHH 治疗后存活的小鼠肝组织随治疗时间延长,肝细胞坏死逐渐减轻,肝索结构逐渐恢复。IHH 治疗 14 d 的肝脏组织已类似正常肝脏组织(图4)。IHH 治疗后存活 14 d 的裸鼠肝脏组织的免疫组化染色,可见微载体上细胞染色阳性,而裸鼠肝细胞和背景无染色,表明小鼠抗人 α1-抗胰蛋白酶 (α1-AT)抗体与小鼠的相应抗原无交叉反应,进一步证实微载体上的细胞为人源化肝细胞,即 IHH。结果表明注射入 ALF 鼠腹腔的 IHH 可存活并填补了肝坏死缺损处(图5)。
目前,国内外许多实验室都试图建立永生化人肝细胞系,但这些肝细胞在永生化后大多具有功能缺陷[10]。具有正常人肝细胞主要生物学特性,并具有体内、体外代谢解毒功能的永生化人肝细胞系罕见文献报道。结果表明,我们所建立的 IHH 具有正常肝细胞的代谢解毒功能,可作为未来制备人源化生物人工肝的细胞材料。
[1]Pathikonda M, Munoz SJ.Acute liver failure.Ann Hepatol, 2010,9(1):7-14.
[2]Stravitz RT, Kramer DJ, Medscape.Management of acute liver failure.Nat Rev Gastroenterol Hepatol, 2009, 6(9):542-553.
[3]Schrem H, Kleine M, Borlak J, et al.Physiological incompatibilities of porcine hepatocytes for clinical liver support.Liver Transpl, 2006,12(12):1832-1840.
[4]Harm S, Stroble K, Hartmann J, et al.Alginate-encapsulated human hepatoma C3A cells for use in a bioartificial liver device - the hybrid-MDS.Int J Artif Organs, 2009, 32(11):769-778.
[5]Zhang RX, Li M, Zhang WJ, et al.Establishment and biological characteristics of immortalized human hepatocyte cell line.Chin Med Biotechnol, 2008, 3(1):11-18.(in Chinese)张然星, 李宓, 张文健, 等.永生化人肝细胞系的建立和生物学特性研究.中国医药生物技术, 2008, 3(1):11-18.
[6]Hoofnagle JH, Carithers RL Jr, Shapiro C, et al.Fulminant hepatic failure: summary of a workshop.Hepatology, 1995, 21(1):240-252.
[7]Terblanche J, Hickman R.Animal models of fulminant hepatic failure.Dig Dis Sci, 1991, 36(6):770-774.
[8]Brattin WJ, Glende EA Jr, Recknagel RO.Pathological mechanisms in carbon tetrachloride hepatotoxicity.J Free Radical Bio Med, 1985,1(1):27-38.
[9]Erwin K, Hans-Dieter K.Hepatology textbook and atlas.3rd ed.Berlin: Springer, 2008:20-26.
[10]Tsuruga Y, Kiyono T, Matsushita M, et al.Establishment of immortalized human hepatocytes by introduction of HPV16 E6/E7 and hTERT as cell sources for liver cell-based therapy.Cell Transplant,2008, 17(9):1083-1094.
